Karbokációs intermedierek stabilitása
Tudjuk, hogy egy SN1 reakció sebességkorlátozó lépése az első lépés – a karbokációs intermedier képződése. Ennek a lépésnek a sebessége – és így a teljes szubsztitúciós reakció sebessége – annak a folyamatnak az aktiválási energiájától függ, amelyben a szén és a kilépő csoport közötti kötés megszakad, és karbokation képződik. Hammond posztulátuma szerint (6.2B. szakasz) minél stabilabb a karbokation-intermedier, annál gyorsabban fog bekövetkezni ez az első kötésbontó lépés. Más szóval, annak valószínűsége, hogy egy nukleofil szubsztitúciós reakció disszociatív (SN1) mechanizmussal megy végbe, nagymértékben függ a kialakuló karbokation-intermedier stabilitásától.
A kritikus kérdés most az lesz, hogy mi stabilizálja a karbokációt?
Ha tehát egy negatív töltés stabilizálásához elektronelvonó csoportra van szükség, akkor mi stabilizálja a pozitív töltést? Egy elektrondonor csoport!
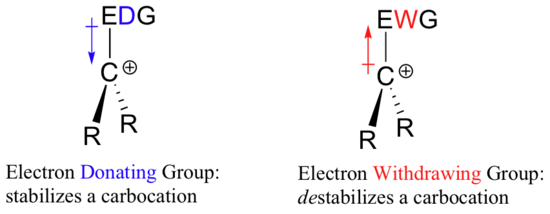
Egy pozitív töltésű faj, mint például egy karbokation, nagyon elektronszegény, és így bármi, ami elektronsűrűséget adományoz az elektronszegénység központjának, segít stabilizálni azt. Fordítva, egy karbokációt destabilizál egy elektronelvonó csoport.
Az alkilcsoportok – metil, etil és hasonlók – gyenge elektrondonor csoportok, és így stabilizálják a közeli karbokációkat. Ez azt jelenti, hogy általában a szubsztituáltabb karbokationok stabilabbak: egy terc-butil-karbokation például stabilabb, mint egy izopropil-karbokation. Az elsődleges karbokationok nagyon instabilak, és nem gyakran figyelhetők meg reakcióközéptermékként; a metil-karbokationok még kevésbé stabilak.
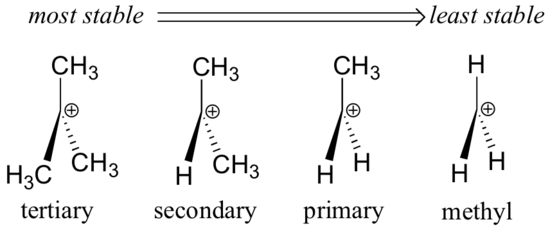
Az alkilcsoportok elektrondonáló és karbokation-stabilizáló hatásúak, mert a szomszédos szénatomok körüli elektronokat a közeli pozitív töltés felé vonzzák, így a pozitív töltésű szén elektronszegénysége kissé csökken.
Nem pontos azonban azt állítani, hogy a nagyobb szubsztitúciójú karbokationok mindig stabilabbak, mint a kisebb szubsztitúciójúak. Ahogyan az elektron-leadó csoportok stabilizálhatják a karbokációt, úgy az elektron-elvonó csoportok destabilizálják a karbokációkat. A karbonilcsoportok a C=O kettős kötés polaritása miatt induktív hatásra elektronelvonó hatásúak. Laboratóriumban bebizonyítható (lásd a 16.1D. szakaszt), hogy az alábbi A karbokáció stabilabb, mint a B karbokáció, annak ellenére, hogy A primer karbokáció, B pedig szekunder.
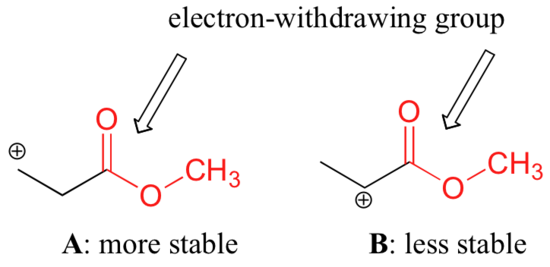
A stabilitásbeli különbség az észterkarbonil elektronelvonó induktív hatásának figyelembevételével magyarázható. Emlékezzünk vissza, hogy az induktív hatások – akár elektronelvonó, akár elektrondonáló – kovalens kötéseken keresztül továbbítódnak, és hogy a hatás erőssége a köztes kötések számának növekedésével gyorsan csökken. Más szóval, a hatás a távolsággal csökken. A B fajban a pozitív töltés közelebb van a karbonilcsoporthoz, így a destabilizáló elektronelvonó hatás erősebb, mint az A fajban.
A következő fejezetben megnézzük, hogy az elektronelvonó fluorszubsztituensek karbokation-destabilizáló hatása hogyan használható fel olyan kísérletekben, amelyek célja annak a kérdésnek a megválaszolása, hogy egy biokémiai nukleofil szubsztitúciós reakció SN1 vagy SN2.
A karbokation stabilizálása rezonanciahatások révén is bekövetkezhet, és amint azt a sav-bázis fejezetben már tárgyaltuk, a rezonanciahatások általában erősebbek, mint az induktív hatások. Tekintsük egy benzil-karbokáció egyszerű esetét:
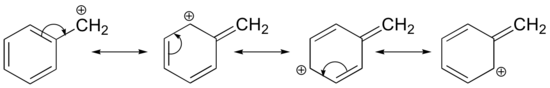
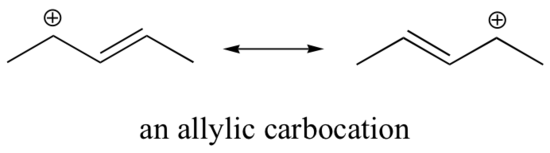
Ez a karbokáció viszonylag stabil. Ebben az esetben az elektrondonáció rezonanciahatás. Erre a karbokációra három további rezonanciaszerkezet rajzolható, amelyekben a pozitív töltés a három aromás szénatom egyikén helyezkedik el. A pozitív töltés nem izolálódik a benzilszénen, hanem delokalizálódik az aromás szerkezet körül: a töltésnek ez a delokalizációja jelentős stabilizációt eredményez. Ennek eredményeképpen a benzil- és az allil-karbokationok (ahol a pozitív töltésű szén egy vagy több nem aromás kettős kötéshez kapcsolódik) lényegesen stabilabbak, mint még a tercier alkil-karbokationok is.
Mivel az olyan heteroatomok, mint az oxigén és a nitrogén, elektronegatívabbak, mint a szén, azt várhatnánk, hogy ezek definíció szerint elektronelvonó csoportok, amelyek destabilizálják a karbokationokat. Valójában gyakran éppen az ellenkezője igaz: ha az oxigén- vagy nitrogénatom a megfelelő pozícióban van, az általános hatás a karbokation stabilizálása. Ez annak köszönhető, hogy bár ezek a heteroatomok indukciósan elektronelvonó csoportok, rezonancia alapján elektrondonor csoportok, és ez a rezonanciahatás az, ami erősebb. (Korábban ugyanezzel a gondolattal találkoztunk a fenolok és az aromás aminok relatív savasságának és bázicitásának vizsgálatakor a 7.4. szakaszban). Tekintsük az alábbi két karbokationfaj-párt:
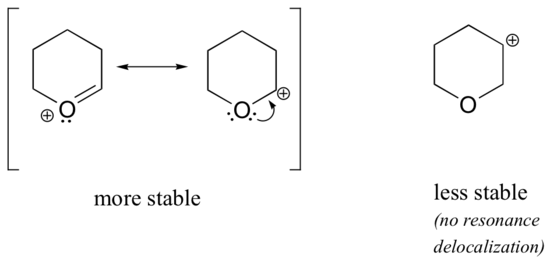
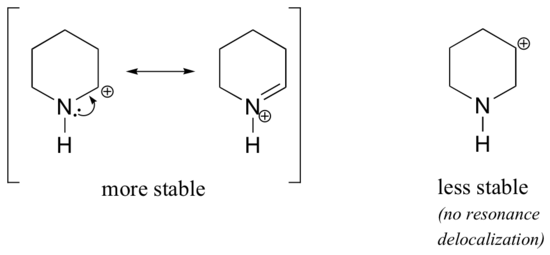
A stabilabb karbokationokban a heteroatom rezonancia révén elektrondonorcsoportként viselkedik: valójában a heteroatomon lévő magányos pár áll rendelkezésre a pozitív töltés delokalizálására. A kevésbé stabil karbokationokban a pozitív töltésű szén több mint egy kötésnyire van a heteroatomtól, így rezonanciahatás nem lehetséges. Valójában ezekben a karbokation-fajokban a heteroatomok valójában destabilizálják a pozitív töltést, mivel indukciósan elektronelvonóak.
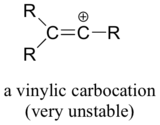
Végül a vinil-karbokationok, amelyekben a pozitív töltés egy kettős kötésű szénen található, nagyon instabilak, és így nem valószínű, hogy bármely reakcióban köztitermékként képződnek.
Példa 7.9.1
Az alábbi szerkezetek közül melyikben várható, hogy a karbokation stabilabb lesz? Magyarázza meg.
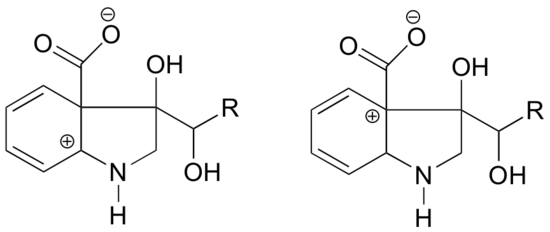
Válasz
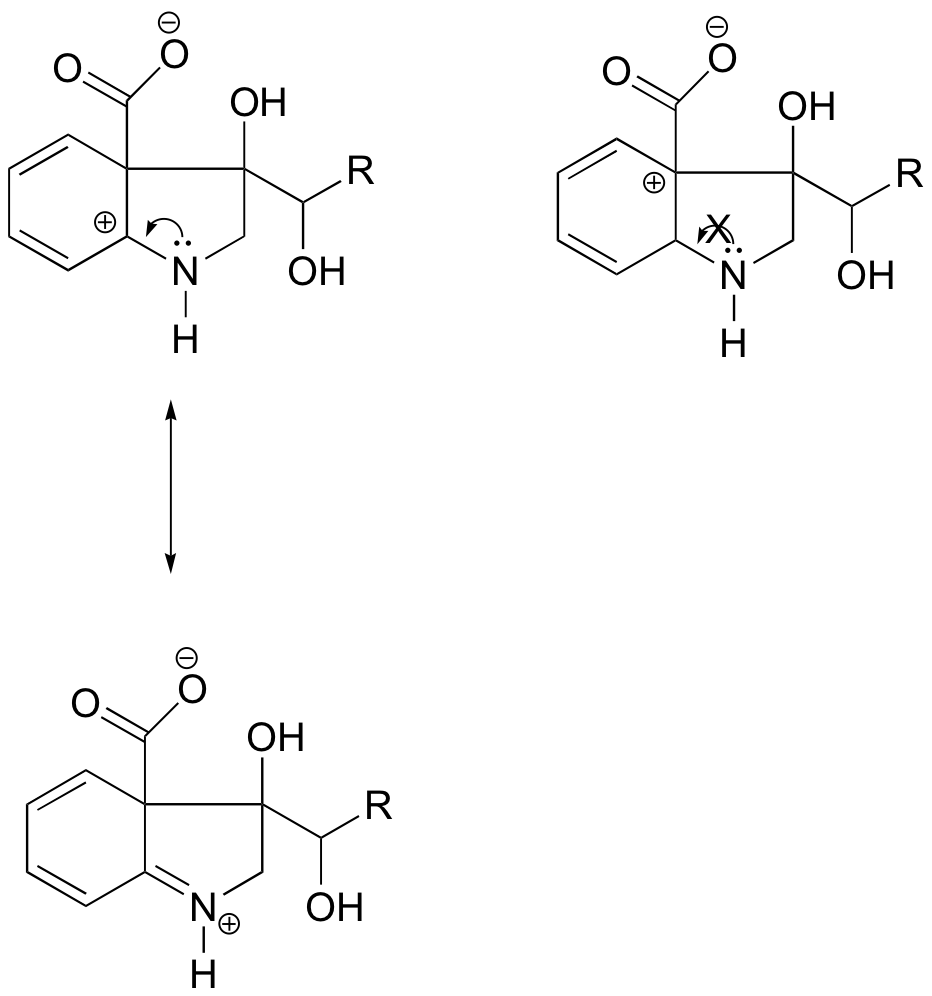
A bal oldali karbokationban a pozitív töltés a nitrogénhez képest olyan helyzetben van, hogy a nitrogén magányos elektronpárja adományozható az üres orbitál betöltésére. A jobb oldali karbokation faj esetében ez nem lehetséges.
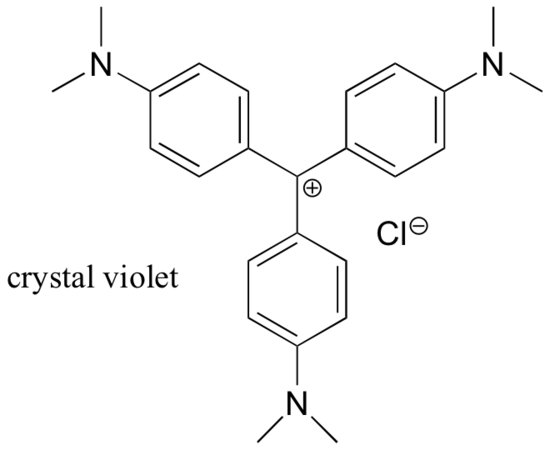
A karbokationok többnyire nagyon nagy energiájú, átmeneti köztes fajok a szerves reakciókban. Van azonban néhány szokatlan példa a nagyon stabil karbokationokra, amelyek szerves sók formájában jelennek meg. A kristályviola a közös neve annak a karbokationnak a kloridsójának, amelynek szerkezete az alábbiakban látható. Figyeljük meg a pozitív töltés kiterjedt rezonancia delokalizációjának szerkezeti lehetőségeit, valamint a három elektrondonáló amincsoport jelenlétét.
Példa 7.9.2
Rajzoljuk meg a kristályibolya kation rezonancia szerkezetét, amelyben a pozitív töltés az egyik nitrogénatomra delokalizálódik.
Válasz 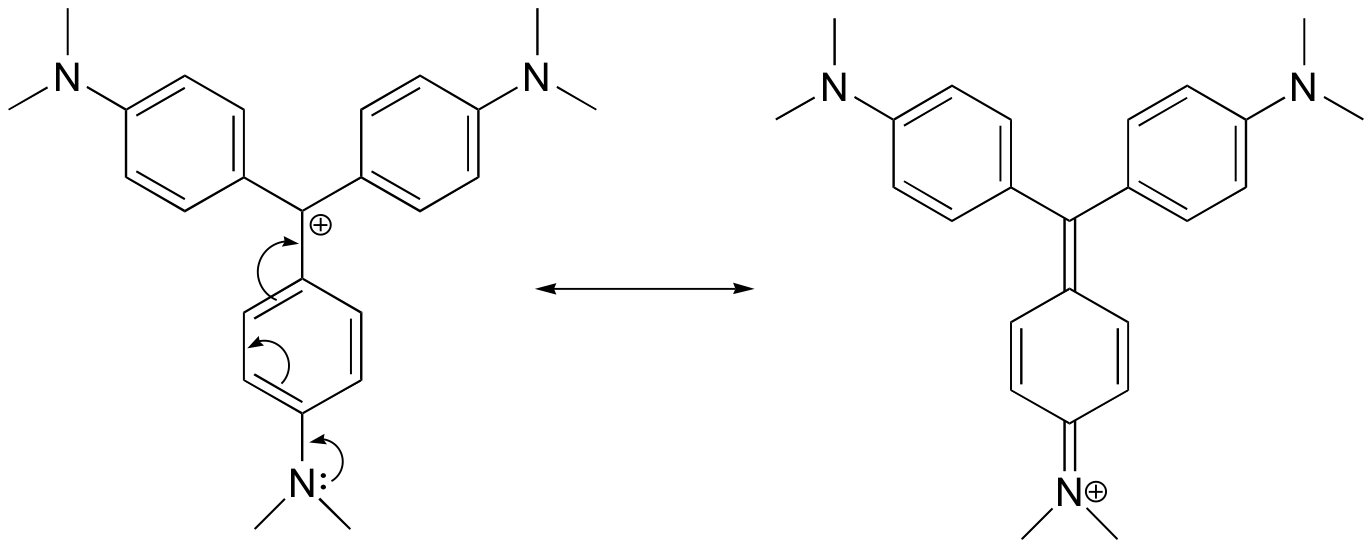
Ha azt a lehetőséget vizsgáljuk, hogy egy nukleofil szubsztitúciós reakció SN1 útvonalon keresztül megy végbe, kritikus fontosságú a hipotetikus karbokációs köztitermék stabilitásának értékelése. Ha ez a köztitermék nem elég stabil, akkor az SN1 mechanizmust valószínűtlennek kell tekinteni, és a reakció valószínűleg SN2 mechanizmussal megy végbe. A következő fejezetben számos példát fogunk látni biológiailag fontos SN1-reakciókra, amelyekben a pozitív töltésű köztes vegyületet a saját molekulaszerkezetében rejlő induktív és rezonanciahatások stabilizálják.
Példa 7.9.3
Mondja meg, hogy az alábbiakban az egyes párok közül melyik karbokation a stabilabb, vagy ha várhatóan közel azonosak. Magyarázza meg érvelését.
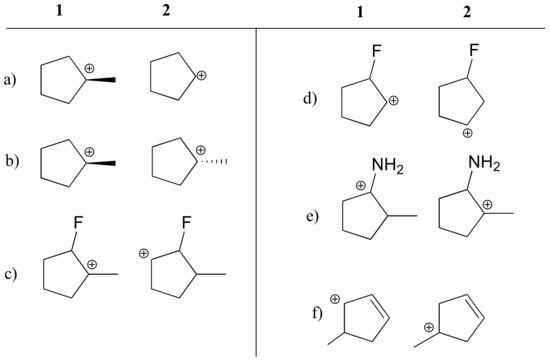
Válasz
a) 1 (tercier vs. szekunder karbokation)
b) egyenlő
c) 1 (tercier vs. szekunder karbokation)
b) egyenlő
c) 1 (tercier vs. szekunder karbokation). szekunder karbokation)
d) 2 (a pozitív töltés az elektronelvonó fluortól távolabb van)
e) 1 (a nitrogén magányos párja rezonancia révén elektronokat adományozhat)
f) 1 (allylikus karbokation – a pozitív töltés delokalizálódhat egy második szénre)