A legegyszerűbb esetben az elektrokémiai cella két elektronvezetőből áll, amelyeket egy ionvezető választ el egymástól, és egy elektronvezető köt össze.
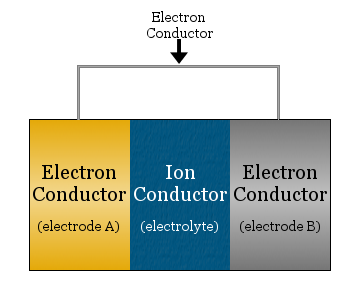
- az ionos vezetőt elektrolitnak nevezzük
- az elektrolittal elválasztott elektronvezetőket elektródáknak nevezzük
- az elektródák összekötésére használt elektronvezető gyakran egy fémhuzal, például rézvezeték
A cella két típusa
Az elektrokémiai cellának két alapvető típusa van: galván és elektrolit.
Az energiaátalakítás spontán (ΔG < 0) redoxireakciókkal történik, amelyek során elektronáramlás jön létre.
Az elektronok áramlása nem spontán (ΔG ≥ 0) redoxireakciókat hajt.
Példák
- A galváncellára példa az akkumulátor, amely valaminek az áramellátását biztosítja.
- Az újratölthető akkumulátorok mindkét cellatípusra példák: galvánelemként működnek, amikor egy eszközt táplálnak, és elektrolitikus cellaként, amikor újratöltik őket.
- Az elektrolitikus cellákra példák közé tartoznak azok is, amelyeket a víz hidrogénre és oxigénre bontására használnak, és azok, amelyek az alumíniumércet alumíniumfémmé alakítják.
A termodinamikai adatok forrása
Az elektrokémiai cellák a fent leírtakhoz hasonló gyakorlati felhasználások mellett kiváló lehetőséget nyújtanak termodinamikai adatok gyűjtésére.
Reakciók szétválasztása
Az elektrokémiai cellák például lehetővé teszik a standard redoxpotenciálok meghatározását, amelyekből a reakciók standard entalpia, standard entrópia és standard Gibbs-féle szabad energia adatok kényelmesen nyerhetők:
- elektromot szolgáltatni, vagy
- fémérceket fémmé alakítani, vagy
- termodinamikai adatokat szolgáltatni,
mert a redoxireakciók külön-külön zajlanak.
Példa: A Daniell-cella
Az elektrokémiai cellákban a reakciók különálló elektródákon zajlanak – sőt, maguk az elektródák különböző edényekben is elhelyezhetők.Tekintsük a korai galváncellák egyikét, a Daniell-cellát.
A Daniell-cella energiaforrása a cinkfém rézszulfáttal való spontán reakciója, melynek során cink-szulfát és rézfém keletkezik.
ΔG° = -212.6 kJ mol-1
Az anyagok találkozásakor:
- egy edényben közvetlen érintkezésben a kémiai potenciális energia hőenergiává alakul és a reakcióedény felmelegszik
- elektrokémiai cellában a kémiai potenciális energia elektromos energiává alakul
A Daniell-cella
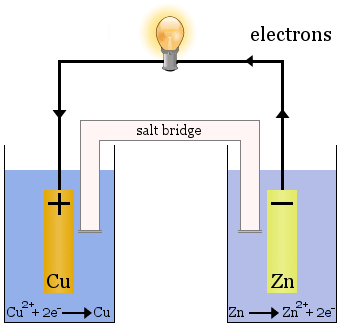
A Daniell-cella két félcellából áll: Az egyikben a rézionok redukálódnak, a másikban a cink oxidálódik.
A cella működése során az egyik cellából Cu2+ távozik, a másik cellában pedig Zn2+ keletkezik.
A rézelektróda növekedni kezd, mivel frissen lerakódott rézfémmel van bevonva, a cinkelektróda pedig csökkenni kezd, mivel a cink ionként az oldatba kerül.
A sóhíd a fenti esetben telített KNO3 oldattal töltött üvegcső.A végein frittekkel van ellátva, amelyek megakadályozzák az oldatok keveredését az egyes félcellákban, de átengedi az ionokat, hogy az elektromos áramkör kiteljesedjen, és az egyes félcellák elektromosan semlegesek maradjanak.
A hajtóerő ugyanaz a ΔG° = -212.6 kJ mol-1, amit akkor kapunk, ha egyszerűen összekeverjük a reaktánsokat egy edényben;a két félreakció szétválasztásával az elektronoknak át kell haladniuk a vezetéken, és felhasználhatjuk az elektromos energiát.
