Azidion: Azidionok: Szerkezet, tulajdonságok és szubsztitúciós reakciók
Az azidion (N3- ) egyike azoknak a kémiai egységeknek, amelyek egyszerűen csak furcsán néznek ki.

- Három nitrogén egy sorban? pipa
- Két negatív és egy pozitív töltés, a nettó töltés -1 ? pipa
- Stabil? pipa (amíg óvatosan bánunk vele).
Mint kiderült, az azidion rendkívül hasznos lehet C-N kötések kialakítására nukleofil szubsztitúciós reakciókban.
Tartalomjegyzék
- Az azidion egy nagyszerű nukleofil
- Organikus azidok, mint “maszkos” aminok
- Elbukkanás a kilövőálláson
- Nukleofil acil-szubsztitúció azid-sókkal: Acyl Azides
- Acilazidok átrendeződése: A Curtius-féle átrendeződés
- Még több példa az azid nukleofilekre: Epoxidnyitás és konjugált addíció
- Jegyzetek
- (Haladó) Hivatkozások és további olvasmányok
- 1. Az azidion nagy nukleofil az SN2-reakciókban
- 2. A szerves azidok a leghasznosabb tulajdonságuk. Szerves azidok mint “maszkolt aminok”
- Robbanás a kilövőálláson
- 4. Nukleofil acil-szubsztitúció azid-sókkal Acilazidok előállítása
- 5. A nukleofil acil-szubsztitúciós reakció a nukleofil acil-szubsztitúciós termék. Rearrangement of Acyl Azides: A Curtius-átrendeződés
- Még több példa az azid nukleofilekre: Az azidion mint nukleofil két további alkalmazása közé tartozik az epoxidok megnyitása (ami lényegében egy SN2 folyamat – figyeljük meg a konfiguráció inverzióját) és az alfa,béta telítetlen ketonok konjugált addíciója:
- Megjegyzések
- (Haladó) Hivatkozások és további olvasmányok
1. Az azidion nagy nukleofil az SN2-reakciókban
Az azidion a hidrazoesav, HN3 konjugált bázisa. Annak ellenére, hogy csak gyengén bázikus (a HN3 pKa értéke mindössze 4,6), az N3 rendkívül jó nukleofil – egy mérés szerint nukleofilabb, mint bármelyik amin (lásd a következő bejegyzést: Az aminok nukleofilitása). Nem nehéz racionalizálni, hogy miért lehet ez így, ha megállunk gondolkodni rajta. Négy nukleofil magányos párral, amelyek nagyon kis térfogatra korlátozódnak, sokkal nagyobb a valószínűsége annak, hogy egy elektrofillel való ütközés reakciót eredményez, mint egy terjedelmes alkilcsoportokkal rendelkező amin esetében, hogy csak egy példát említsünk.
Az N3-ról úgy gondolhatunk, mint egy sovány, gonosz, nitrogénnel töltött rakétáról, amely gyorsan, hatékonyan és jelentős mellékreakciók nélkül juttatja el a szénre a rakományát.
Az SN2-reakciókban az elsődleges és másodlagos alkil-halogenideket és szulfonátokat könnyen kiszorítja az N3- , ami alkil-azidokat eredményez:
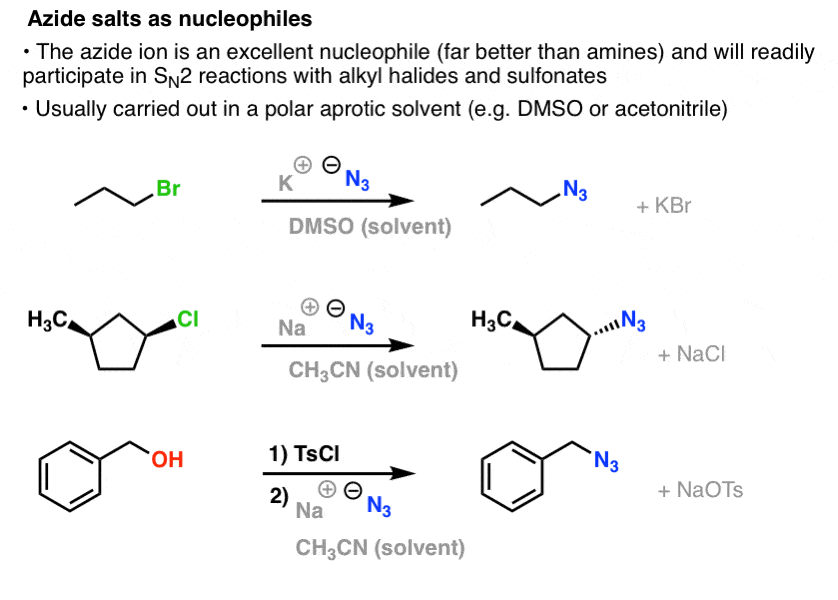
A szokásos eljárás az, hogy egy azid sót, például NaN3-t vagy KN3-t használunk a megfelelő alkil-halogeniddel egy poláros aprotikus oldószerben, például acetonitrilben (CH3CN) vagy dimetilszulfoxidban (DMSO).
A szerves azid termékek meglehetősen stabilak, még ha kissé furcsán is néznek ki. Néhányuk még gyógyszerként (pl. AZT, jobbra lent) vagy a kémiai biológia tanulmányozásához hasznos szondaként is felhasználásra talált. .
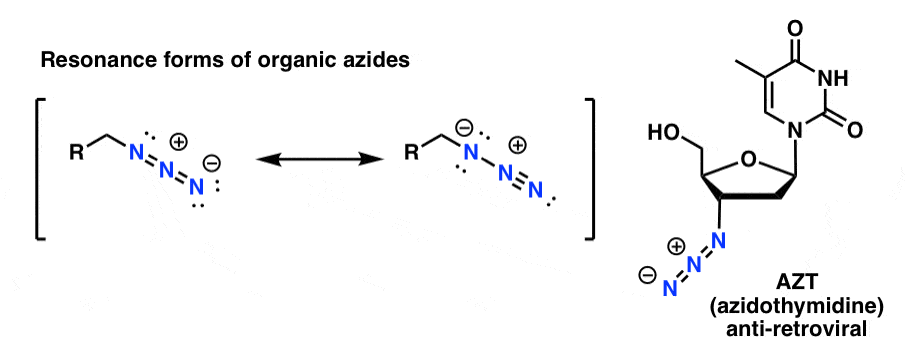
Céljainkra a szerves azidok leghasznosabb tulajdonsága az, hogy “maszkolt” aminokként szolgálnak.
2. A szerves azidok a leghasznosabb tulajdonságuk. Szerves azidok mint “maszkolt aminok”
Megjegyezzük a fenti rezonanciaformát nitrogén-nitrogén hármas kötéssel. Ha redukálószerrel, például LiAlH4-gyel vagy akár katalitikus hidrogénezéssel (Pd/C , H2) kezeljük, a szerves azidok primer aminokká redukálhatók, miközben N2 szabadul fel.
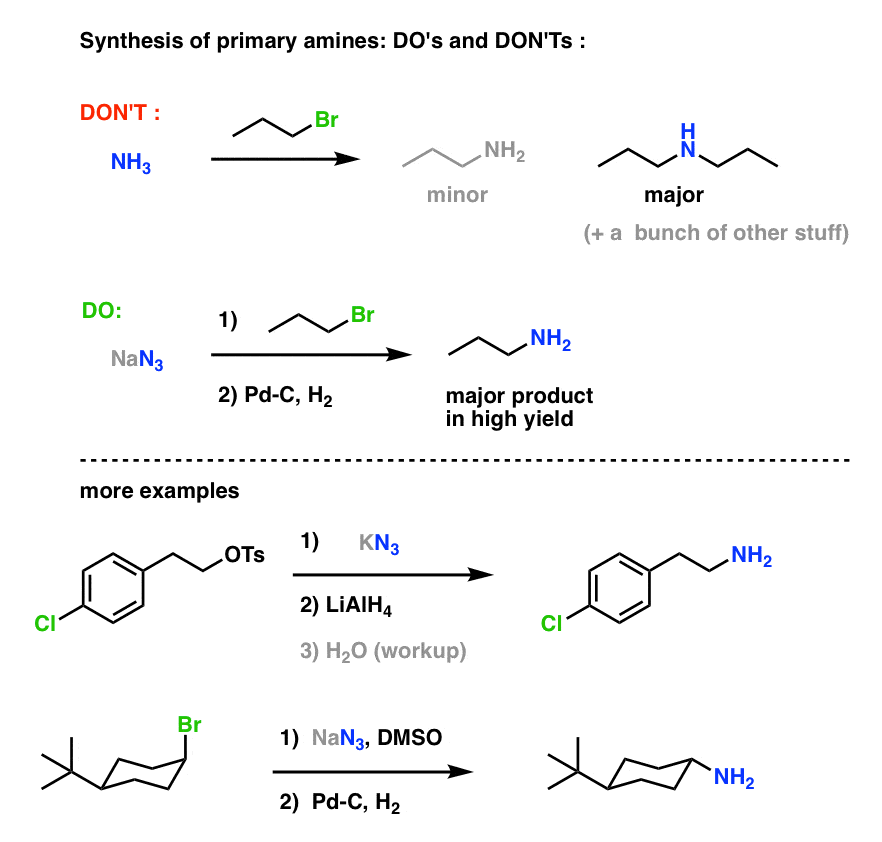
Ez egy nagyon hasznos útvonal az alkil-halogenidekből származó primer aminokhoz!
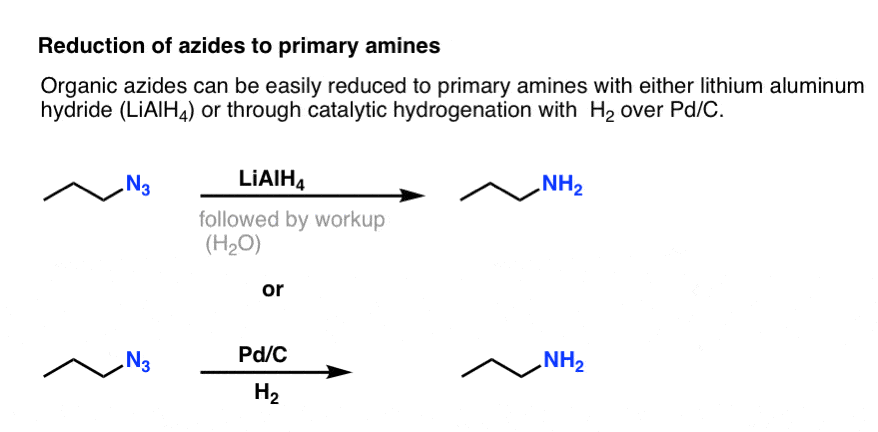
Korábban már vizsgáltuk a Gabriel-szintézist, mint primer aminokhoz vezető utat , de ez az útvonal azért jobb, mert az azidot kíméletes körülmények között (pl. hidrogénezéssel) lehet az aminná redukálni. Nem kell aggódni a ftalimid hidrazinnal történő magas hőmérsékletű hasítása miatt.
Azt is láttuk, hogy primer aminok előállítása alkilhalogenidek NH3-mal történő közvetlen kezelésével gyakran nem a kívánt terméket eredményezi, mert az aminok Cookie-Monster-szerű hajlamuk van arra, hogy többször reagáljanak alkilhalogenidekkel: mivel az amintermékek általában nukleofilabbak, mint a reaktánsok, nehéz rávenni az aminokat, hogy megálljanak egyetlen alkilhalogenid megrágásánál.
Robbanás a kilövőálláson
Ha az N3 egy “nitrogénnel töltött rakéta”, ahogy fentebb megjegyeztük, érdemes felidézni, mi történik, ha egy rakétával nem bánunk óvatosan: lényegében egy bomba.
A NaN3 és a KN3 fehér porok, amelyeket szobahőmérsékleten korlátlan ideig lehet tárolni, és a padban minden gond nélkül ki lehet kanalazni.
De ha felmelegítik vagy sokknak teszik ki – minden tétnek vége. Ugyanez vonatkozik ezeknek az azid-sóknak savval való érintkezésére is, ami robbanásveszélyes HN3-at képez.
És a NaN3 és a KN3 a szép azidok! Ha ólom, higany, kadmium, cink vagy ezüst fémsókkal keverednek, még robbanékonyabb azidvegyületek keletkezhetnek. Ezek a fémazidok kontakt robbanóanyagok, amelyek némelyike olyan érzékeny, hogy akkor is felrobban, ha valaki húsz méterrel arrébb fingik a folyosón. Néhány őrült vegyész még szándékosan is készít ilyeneket, de ebben a blogban soha, de soha nem fogunk a téma robbanási sugarának közelébe utazni.
NaN3-t és KN3-at ésszerűen hígított koncentrációban, robbanópajzs mögött, preparatív méretekben kell használni, és mellesleg soha nem szabad CH2Cl2 oldószerrel használni, ami rendkívül robbanékony diazidometánt eredményezhet.
Most, vannak esetek, amikor egy hirtelen nitrogéngázrobbanás hasznos – és potenciálisan életmentő. Lehet, hogy a nap egy részét már töltötte nátrium-azid közvetlen közelében, anélkül, hogy észrevette volna. Ez azért van, mert a NaN3 egyike a légzsákokban használt hajtóanyagoknak; amint egy gyorsulásmérő beindítja, a NaN3 detonációja több mint 200 km/órás sebességgel kilövi az N2 gázt, ami a másodperc 1/25-öd része alatt felfújja a zsákot.
Yay for azide saltsók!
via GIPHY
(De ne legyél ez a fickó):
via GIPHY
Végeredmény: Az alkil-halogenidek vagy szulfonátok és azidok közötti SN2-reakciók valószínűleg az egyetlen legjobb módja annak, hogy alkil-halogenidekből primer aminokat szintetizáljunk. Minden bizonnyal felülmúlja a Gabriel-féle szintézist.
4. Nukleofil acil-szubsztitúció azid-sókkal Acilazidok előállítása
Az SN2-reakció nem az egyetlen általunk vizsgált szubsztitúciós reakciótípus. Létezik nukleofil acil szubsztitúció is. Egy jó távozó csoporthoz (például savkloridhoz vagy anhidridhez) kötött karbonil megfelelő nukleofil hozzáadásával szubsztitúcióra kerül.
A mechanizmus első lépésében a nukleofil (Nu) megtámadja a karbonil szénatomot, C-Nu-t képezve és C-O-t (pi) bontva. Ezáltal egy tetraéderes köztitermék keletkezik. A második lépésben a C-O pi kötés újraképződik, és a szén-(kilépőcsoport) kötés megszakad, így keletkezik a nukleofil acil-szubsztitúciós termék.
Itt egy példa a nukleofil acil-szubsztitúciós reakcióra egy sav-klorid és az N3-ion között egy acilazid keletkezése érdekében:
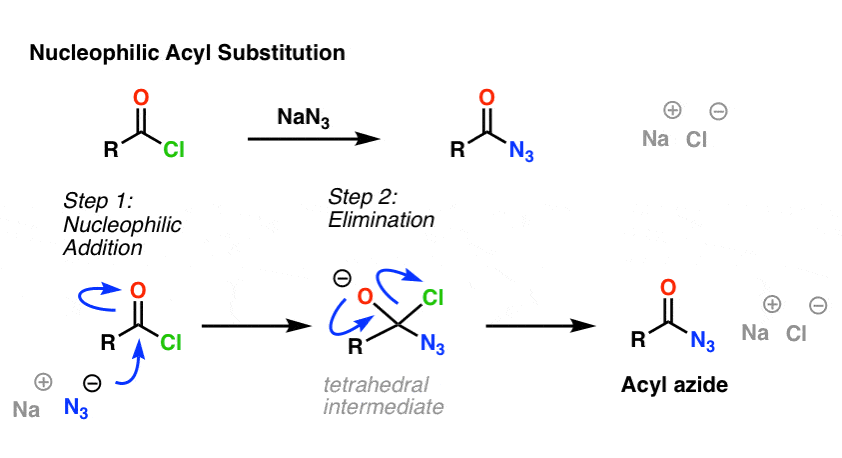
5. A nukleofil acil-szubsztitúciós reakció a nukleofil acil-szubsztitúciós termék. Rearrangement of Acyl Azides: A Curtius-átrendeződés
Az acilazidok leggyakoribb felhasználása az, hogy hevítés hatására átrendeződnek izocianátokká a Curtius-átrendeződésnek nevezett reakcióban.
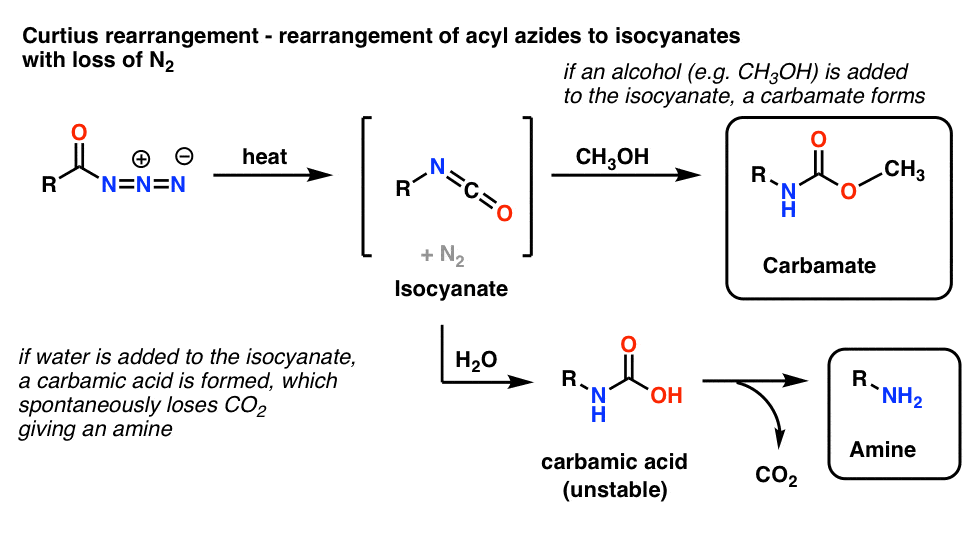
- Ha a Curtius-átrendeződést alkohol, például metanol jelenlétében hajtjuk végre, karbamát keletkezik.
- Ha helyette vizet adunk, rövid ideig instabil karbaminsav keletkezik, amely szén-dioxidot veszít, és primer amint ad.
Miért lehet ez hasznos? Íme egy lehetőség.
Az aromás karbonsavak előállítására rengeteg módszer létezik, de az aromás gyűrűk C-N kötéseinek kialakítására nem olyan sok jó módszer. Tegyük fel, hogy van egy benzoesavunk (pl. p-metil-benzoesav), de egy (védett) aromás amint kell képeznünk. A Curtius-protokoll egy szép módját jelenti egy új C-N-kötés kialakításának a gyűrűn anélkül, hogy nitrálás + redukcióhoz kellene folyamodnunk.
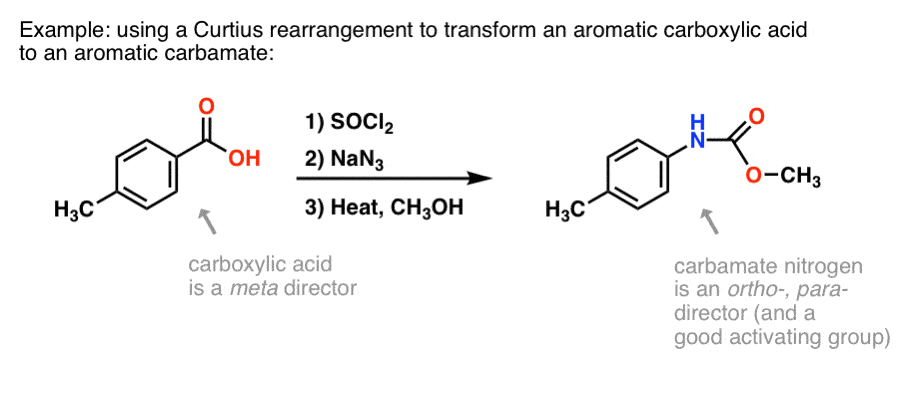
(Ily módon ez némileg analóg a Baeyer-Villiger-oxidáció nitrogén-egyenértékével. )
Még több példa az azid nukleofilekre: Az azidion mint nukleofil két további alkalmazása közé tartozik az epoxidok megnyitása (ami lényegében egy SN2 folyamat – figyeljük meg a konfiguráció inverzióját) és az alfa,béta telítetlen ketonok konjugált addíciója:
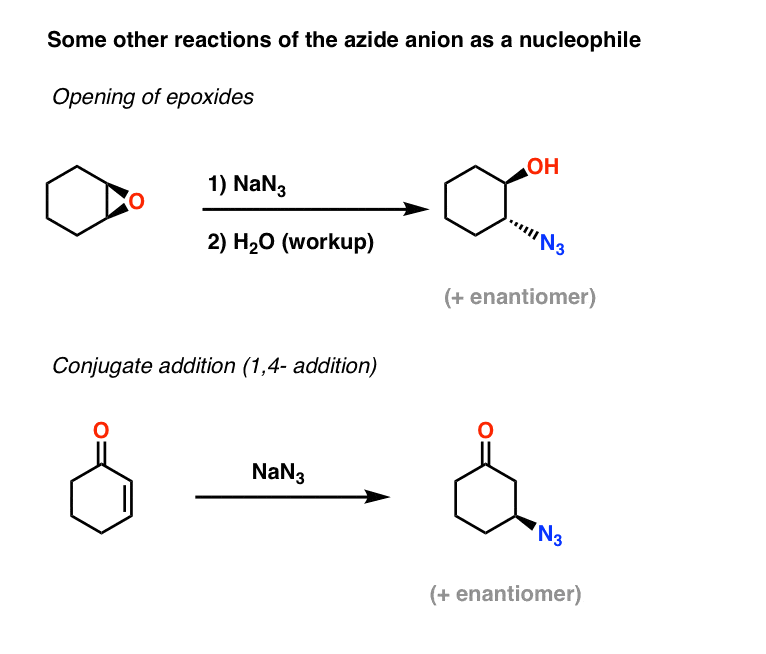

A kapott alkil-azidok ezután a fentebb tárgyalt módszerekkel primer aminokká redukálhatók.
Megjegyzések
Lábjegyzet: Azid-alkin cikloaddíciók, ill. “Click” kémia
A szerves azidok érdekes és hasznos alkalmazása, amely még nem került be a bevezető szerves kémiai tankönyvekbe (de valószínűleg a közeljövőben be fog kerülni), egy olyan folyamat, amelyet technikailag “rézkatalizált azid-alkin cikloaddíciónak”, de gyakrabban csak “alkin-azid click-reakciónak” neveznek.
Amikor egy terminális alkint rézkatalizátorral kezelnek egy szerves azid jelenlétében, gyorsan cikloaddíció jön létre, ami 1,2,3-triazol képződéséhez vezet.
Nem megyünk bele mélyen a részletekbe, de ez a gyűrűképző reakció 6 pi-elektron bevonásával zajlik, és a Diels-Alder-reakció unokatestvére (a fanyalgók joggal jegyzik meg, hogy a rézkatalizált változat technikailag nem koncertált folyamat, de a nem katalizált változat igen)
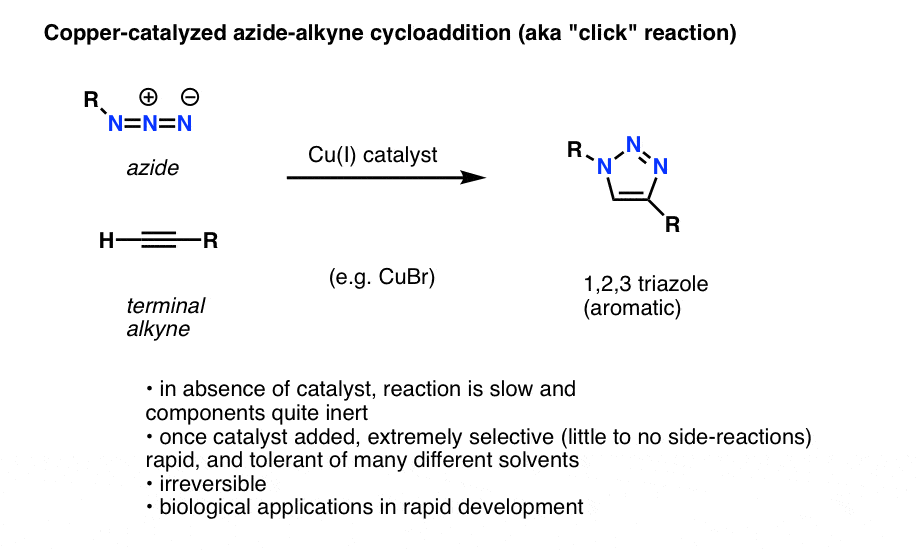
A reakció több okból is figyelemre méltó:
- a reaktív partnerek (terminális alkin és szerves azid) katalizátor hiányában a legtöbb körülmények között viszonylag inertek.
- a réz hozzáadásával a reakció enyhe körülmények között és különböző oldószerekben (beleértve a vizet is) rendkívül gyorsan lejátszódik.
- Ez ilyen körülmények között rendkívül szelektív,az alkin és az azid partnerek csak egymással reagálnak, visszafordíthatatlanul.
- a termék, egy triazolgyűrű, aromás és stabil
A reakciót az egyik megalkotója, Barry Sharpless “kattintási” reakciónak nevezte el, mert ez az egyik legközelebbi dolog, ami a kémikusoknak olyan reakcióhoz áll, mint két komplementer legótömb sima “összecsapása”.
Azt tette ezt a reakciót az utóbbi időben különösen hasznossá, hogy az azid és az alkin partnereket biológiai érdekű molekulákba lehet beépíteni, és kívánság szerint “össze lehet kattintani”.
Például:
- Az acetilént egy cukor 5′ pozíciójába és egy azidot a 3′ pozícióba helyezve “kattintott” DNS-t készítettek, ahol a triazol helyettesíti a szerves foszfátot.
- Hihetetlen, de egy csoport “kattintott” DNS-t készített, emberi sejtekbe helyezte, és sikerült elérni, hogy azt a hírvivő RNS átírja.
- Azidtartalmú AZT (fent) úgy működik, hogy eltömíti a transzkripciós gépezetet. Néhány okos ember megtalálta a módját, hogy az azid-alkin kattintási reakciót a gyors genomszekvenáláshoz, a ClickSeq néven ismert technikához alkalmazza.
A Takata az 1990-es évek elején nátrium-azidot használt, majd áttért a tetrazolra, majd az ammónium-nitrátra.
A “Hatvanmillió autóbomba: Inside Takata’s Air Bag Crisis”.
Az ammónium-nitrát körülbelül tizedannyiba került, mint a tetrazol Upham szerint, aki az ipari szabadalmakat is áttekintette. Az ammónium-nitrátnak azonban volt egy kritikus hibája, ami szerinte arra késztette a többi légzsákgyártót, hogy lemondjanak róla: Az ammónium-nitrátnak öt különböző sűrűségű fázisa van, amelyek miatt nehéz stabilan tartani az idő múlásával. Az ammónium-nitrátból készült hajtóanyag a hőmérséklet változásával megduzzadna és összezsugorodna, és végül a tabletta porrá bomlana. A víz és a nedvesség felgyorsítaná a folyamatot. A por gyorsabban ég, mint a tabletta, így egy olyan légzsák, amelynek hajtóanyaga szétmorzsolódott, valószínűleg túl agresszívan fog kinyílni. Az ellenőrzött robbanás csak egy robbanás lenne. “Mindenki végigment egy bizonyos úton, és csak a Takata ment egy másik úton” – mondja Jochen Siebert, aki az 1990-es évek óta követi a légzsákipart, és jelenleg a JSC Automotive Consulting ügyvezető igazgatója. “Ha elolvassa az akkori konferenciadokumentumokat, láthatja, hogy az emberek azt mondták: ‘Nem, nem kellene. Ez veszélyes. “
A hibás légzsákokból származó repeszek világszerte 13 ember halálát okozták, és több mint 100-at megsebesítettek.
2017. június 25-én a Takata több mint 11 milliárd dolláros kötelezettséggel szembesülve csődöt jelentett.
Primer aminszintézis “Do’s and Don’ts” :
(Haladó) Hivatkozások és további olvasmányok
Azidok hasznosak a szerves szintézisben, az azidok kémiájának kiemelését az alábbi hivatkozások tartalmazzák.
- Az azidion nukleofil reakcióképessége különböző oldószerekben
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI: 10.1002/poc.1063
Prof. Herbert Mayr (LMU, München, Németország) pályafutása során az elektrofilitás és nukleofilitás számszerűsítésével, valamint a különböző nukleofilek és elektrofilek reaktivitásának összehasonlítására szolgáló skálák kidolgozásával járult hozzá az alapvető fizikai szerves kémiához. - Az SN2-eltolódások 2-norbornyil-brozilátokon
Klaus Banert és Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI: 1021/ja00377a057 - An Improved Synthesis of Azidothymidine
I. Balagopala, A. P. Ollapally, & H. J. Lee
Nucleosides, Nucleotides & Nucleic Acids 1996, 4, 899-906
DOI: 10.1080/07328319608002136
Azidok nukleofilként használhatók SN2 reakciókban. Ref. #3 az azidion használatát mutatja be az AZT (azidotimidin) szintézisében. Az 1 átalakítása 5-re a 3-on keresztül a ref. #3 a Mitsunobu-reakciót használja, amely lehetővé teszi egy -OH csoport kiszorítását egy nukleofillal a konfiguráció inverziójával. - Szerves azidok redukciója primer aminokká lítium-alumínium-hidriddel
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
A szerves azidok primer aminokká történő redukciója kényelmes módszer olyan primer aminok szintézisére, amelyeket egyébként a szokásos módszerekkel nehéz szelektíven szintetizálni. - A fémazidok robbanásszerű érzékenysége a hatásra
P. G. Fox
J. Solid State Chem. 1970, 2 (4), 491-502
DOI: 10.1016/0022-4596(70)90043-5
An investigation of the shock sensitivity of NaN3, TlN3, and Pb(N3)2. - The Curtius Reaction
Smith, P. A. S. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
A Curtius-reakció régi, de átfogó áttekintése, amely tartalmazza az átrendeződés felfedezésének történetét, a szubsztrátkörnyezetet, a korlátokat, az összehasonlítást más hasonló reakciókkal és a kísérleti eljárásokat. - Szintetikus módszerek és reakciók. 121. Cink-jodiddal katalizált aroil-azidok előállítása aroil-kloridokból és trimetil-szilil-azidból
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi és George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051b
Kényelmes eljárás aromás aril-azidok előállítására a Nobel-díjas Prof. George A. Olah-tól. Ezek aztán felhasználhatók Curtius átrendeződésekhez.
Epoxid-nyitás és konjugált addíció:
- CYCLOHEXENE IMINE (7-AZA-BICYCLOCLOHEPTANE)
Iain D. G. Watson, Nicholas Afagh és Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI: 10.15227/orgsyn.087.0161
Ez egy különösen hasznos eljárás, mivel ez egy Staudinger-reakció az epoxidok NH-aziridinekké (az epoxidok nitrogénanalógjai) történő átalakítására. A szintézis trükkös lehet, de sok részletet közöltek itt, hogy ez reprodukálható legyen, ahogyan illik egy eljárás az Organic Syntheses-ben. - Amine-Catalyzed Addition of Azide Ion to α,β-Unsaturated Carbonyl Compounds
David J. Guerin, Thomas E. Horstmann, and Scott J. Miller
Organic Letters 1999, 1 (7), 1107-1109
DOI: 10.1021/ol9909076
Ez a cikk azért érdekes, mert a szervokatalízis egy korai formáját képviseli, és valószínűleg egy imin- vagy imíniumion-intermedieren keresztül zajlik. Sajnos a kifejezés sehol sem szerepel a dolgozatban – ezek a szerzők megelőzhették volna MacMillan professzort! - Click Chemistry: Diverse Chemical Function from a Few Good Reactions
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI: 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
Az azidok és alkinek Cu-katalizált cikloaddícióját a Nobel-díjas prof. K. Barry Sharpless (The Scripps Research Institute, La Jolla, CA) egyszerűsége, nagy hozama, gyors kinetikája, valamint a körülmények és szubsztrátok széles skálájával való kompatibilitása miatt. Cu nélküli reakciók is lehetségesek, ha szűrt alkineket használunk (pl. ciklooktinokat).