- Közleménycikk
- Enterocutan fisztula: Ryan P Dumas1*, Sarah A Moore1 és Carrie A Sims21Department of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA2Department of Surgery, Division of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
- Abstract
- Bevezetés
- 1. táblázat
- 1. táblázat: Besorolás.
- Táblázat 2
- 2. táblázat: ECF prognosztikai változók.
- Klasszifikáció
- Az ECF prognosztikai tényezői
- Diagnózis
- 1. ábra
- Menedzsment
- Élesztés
- forráskontroll
- Efluencia kezelése
- Sebellátás
- 3. táblázat
- 3. táblázat: Időzítés a végleges kezelésig.
- Táplálkozás
- Következtetés
Közleménycikk
Enterocutan fisztula: Ryan P Dumas1*, Sarah A Moore1 és Carrie A Sims2
1Department of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
2Department of Surgery, Division of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
*Corresponding author: Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstract
Az enterokutan fisztula (ECF) kezelése olyan klinikai készség, amelynek minden általános sebész felszerelésében ott kell lennie. Bár a végleges kezelés gyakran a sebészi zárásra támaszkodik, a műtét előtti gondosság és körültekintés kiemelkedő fontosságú a sikeres kimenetel biztosítása érdekében. E betegek gondozásának négy kulcsfontosságú fázisra kell összpontosítania. Az első fázist a megfelelő felismerés és újraélesztés jellemzi. A második fázisban teljes körű táplálkozási felmérést és tervet kell végezni. A harmadik fázisban a röntgenvizsgálat segít meghatározni az ECF anatómiáját. Végül a negyedik fázist a végleges lezárás jellemzi, amennyiben a sipoly nem gyógyul spontán.Ez az áttekintés az egyes fázisokat meghatározó kulcsfontosságú szempontokra összpontosít, és segít az általános sebésznek maximalizálni a pozitív kimenetel esélyeit.
Bevezetés
A béllumen és a külső bőr közötti rendellenes kapcsolatként meghatározott enterokutan sipoly (ECF) kialakulása a sebészeti és orvosi ellátás fejlődése ellenére is jelentős morbiditás és mortalitás forrása. Az ECF általános előfordulása azonban ismeretlen, és az ECF-re vonatkozó adatok többsége nagy intézményi retrospektív vagy sebészspecifikus sorozatokból származik. Figyelemre méltó, hogy az összes ECF-nek csak 25%-a másodlagos gyulladásos bélbetegség, divertikuláris patológia, trauma, sugárzás és rosszindulatú daganatos megbetegedés miatt. Ezzel szemben az összes ECF közel 75%-a laparoszkópos vagy nyitott műtét közvetlen következménye, és a venterectomiát követő astomoticus szivárgás az ilyen fisztulák több mint 50%-áért felelős. A fennmaradó sipolyokért a véletlen iatrogén sérülések, például az enterotómiák vagy a műtét során elszenvedett, fel nem ismert hősérülések felelősek. Mivel az ECF leggyakrabban sebész által okozott probléma, a megelőzés, valamint a megfelelő kezelés, tervezés és végleges kezelés felelőssége jogosan hárul a sebészre.
Az ECF-et követő megbetegedés és halálozás rendkívül magas. A becslések szerint a betegek 90%-ánál fordul elő ECF-hez kapcsolódó morbiditás, amely a bőrkiválástól kezdve a kiszáradáson át a szepszisig terjed.Továbbá, az ECF-nek tulajdonítható mortalitás 5-20% között mozog, és számos tényezőtől függ, beleértve az alapfertőzést és a fisztula elhelyezkedését. Mivel az ECF-ben szenvedő betegek halálának vezető oka a szepszis, a forrás ellenőrzése továbbra is a terápia egyik sarokköve. Retrospektív sorozatokban a halálozás 16-szorosára emelkedett szepszis és 22-szeresére kontrollálatlan fertőzés esetén. Így a lefolyástalan folyadékgyülemek korai és végleges kezelése rövid távú antimikrobiális kezeléssel együtt jelentősen javíthatja a kimeneteleket. A legtöbb sorozatban a mortalitás is korrelálni látszik a fisztula kimenetelével és elhelyezkedésével. A mortalitás 26%-ról 50%-ra emelkedik az alacsony outputú sipolyok esetében a magas outputúak esetében, tekintettel az ECF kezelésével járó folyadék-, elektrolit- és táplálkozási kihívásokra. A mortalitás szintén korrelál az elhelyezkedéssel, és csökken a distalisabb fisztulák esetében. Míg a jejunalis sipolyok mortalitása a legmagasabb, 29%, és kezelésük jelentősen nagyobb kihívást jelent, a kolonikus sipolyok mortalitása a legalacsonyabb, 6% .
A fiziológiai és pszichológiai hatásokon túlmenően az ECF kezelése óriási terhet ró az egészségügyi erőforrásokra. Becslések szerint az ECF kezelésének költségei jóval meghaladják az 500 000 dollárt, és a jó kimenetel biztosítása érdekében táplálkozási szakemberekből, sebész ápolókból és sebészekből álló multidiszciplináris csapatra van szükség. Nem szabad alábecsülni a nagy szakértelemmel rendelkező kezelőközpontok jelentőségét, amelyekről kimutatták, hogy 42%-ról 20%-ra csökkentik a halálozást.
1. táblázat

| Anatómiai | Proximalis vagy distalis | Gastricus, duodenalis, jejunalis, ilealis, Colonic |
| Physiológiai | Nagy, mérsékelt, alacsony output | Nagy output >500 cc/nap Mérsékelt 200-500cc/nap alacsony output < 200cc/nap |
| Etiológia | Iatrogén vs. Spontán Traumatikus |
Malignus Sugárzás Gyulladásos bélbetegség Divertikuláris |
1. táblázat: Besorolás.
1. táblázat
Klasszifikáció.
Táblázat 2

| KEDVEZMÉNYES. | NEM KEDVEZMÉNYES |
|---|---|
| Táplálékban gazdag | Táplálékban szegény |
| – Albumin >3.0 | -alacsony albuminszint, alacsony transzferrinszint |
| Hosszú fisztulavezeték (>2cm) | Rövid fisztula, többszörös, összetett fisztulák |
| Divertikuláris fisztula | Nagy enterális defekt (>1cm), látható nyálkahártya |
| alacsony teljesítmény | nagy teljesítmény (>500cc/nap) |
| egyetlen fisztula | előzetes sugárkezelés |
| Bélfolytonosság | Több korábbi műtét |
| Egyazon központban elvégzett első műtét | Külső beutaló magasKözpontba |
2. táblázat: ECF prognosztikai változók.
2. táblázat
ECF prognosztikai változók.
Klasszifikáció
Nincs általános vagy jól bevált osztályozási séma azECF-ekre. A fisztulákat általában anatómiailag, fiziológiailagvagy a betegség folyamata szerint osztályozzák . A sipolyok ezen kívül a napi kibocsátás mennyisége szerint is osztályozhatók. Elengedhetetlen, hogy a fisztulakibocsátást pontosan dokumentálják, mivel a mennyiség diktálhatja a kezelésben bekövetkező változásokat. Az 1. táblázat három különböző osztályozási paradigmát részletez.
Az ECF prognosztikai tényezői
Az ECF prognosztikai tényezőit nagyon jól leírták és összhangban vannak a standard sebészeti dogmákkal. Azok a betegek, akiknek proximalis, magas outputú fisztulája alacsony albuminszintet kísér(. Ezzel szemben a társbetegségek nélküli betegek, akiknek sebészi beavatkozás eredményeként kialakult fisztulájuk van, és alacsony outputúak, kedvezőbben járnak, magasabb spontán záróértékekkel. A 2. táblázat számos olyan változót részletez, amelyek előre jelezhetik a sikeres kimenetelt.
Az intézményi támogatás és a multidiszciplináris szakértelem mint pozitív prognosztikai tényező fontosságát nem lehet eléggé hangsúlyozni.Több tanulmány is megerősítette, hogy az intézményi tapasztalat és a volumen kritikus tényezők a morbiditás csökkentésében és a mortalitás javításában. A közelmúltban a Canadian Association for EnterostomalTherapy kodifikálta a multidiszciplináris ellátás fontosságát azáltal, hogy az “ECF Best Practice” ajánlásaiban kilenc alapvető csapattagot azonosított. A sebészektől kezdve a gyógyszerészeken át a kórházi orvosokig, ez az integrált csapatmegközelítés elismeri azt a szakértelmet, amelyet az egyes szakterületek nyújtanak ezen összetett betegek ellátásához.
Diagnózis
Az ileus és a műtét utáni sebfertőzés kialakulása által komplikált posztoperatív lefolyás azECF előjele. Ha a fisztula gyanúja felmerül, vagy a fizikális vizsgálat során azonosították, a radiológiai vizsgálatok szükséges kiegészítő vizsgálatok, és az összes beteg 97%-a átesik a radiológiai értékelés valamilyen formáján. A kontrasztanyaggal kiegészített CT-vizsgálat alapvető fontosságú, mivel értékeli a kapcsolódó tályog vagy lefolyástalan folyadékgyülem jelenlétét. A forrásellenőrzés optimalizálása után a fluoroszkópos fisztulográfia fontos szerepet játszik a fisztula anatómiájának meghatározásában. A fisztulográfia segít lokalizálni az eredetet, meghatározni a hosszát, értékelni a distalis elzáródás jelenlétét, és meghatározni, hogy a fisztula folytonosságban van-e a bél többi részével. Miután az ECF diagnózisát megerősítették, a hangsúlyt a kezelésre kell helyezni.
1. ábra
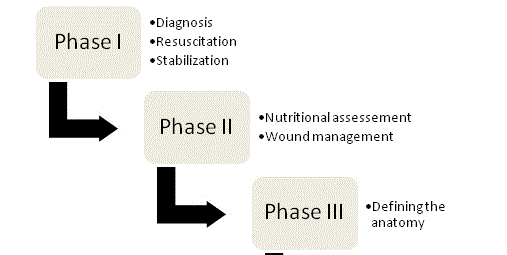
1. ábra
Az ECF kezelés négy fázisa.
Menedzsment
Az ECF menedzsment alapelveit előszörChapman és munkatársai hirdették 1964-ben, és a mai napig a terápia sarokkövei. Eredeti cikkükben Chapman és munkatársai négy kulcstényezőt határoztak meg: folyadék újraélesztés, forráskontroll, szennyvízkezelés és bőrvédelem. A táplálkozás fontossága nemrégiben ötödik kulcsfontosságú elemként jelent meg. A sikeres kimenetel esélyeinek optimalizálása érdekében szervezett, szisztematikus megközelítést kell alkalmazni minden sipolyos betegnél; és a kezelés végső soron a négy fázisra bontható (1. ábra).
Élesztés
A frissen diagnosztizált ECF-el rendelkező beteg újraélesztése sok tekintetben ugyanazokat az elveket követi, mint a szeptikus betegek újraélesztése, és a Surviving Sepsis Campaign tételei szolgálhatnak keretként. A kezdeti ellátásnak az agresszív folyadék-újraélesztésre, az elektrolit-egyensúlyhiány gyors felmérésére és korrekciójára, valamint a tejsavas acidózis normalizálására kell összpontosítania. Az ECF-ben szenvedő betegek a folyamatos GI-veszteségek miatt általában hiponatrémiásak, hipokalémiásak és acidotikusak.A nagy teljesítményű fisztulával rendelkező betegek folyadék-, elektrolit- és bikarbonátveszteségét intravénásan kell pótolni a kezdeti stabilizációs időszakban a dehidratáció és a mély metabolikus instabilitás elkerülése érdekében. A vizeletürítés gondos ellenőrzése és a fisztulából származó folyadék célzott pótlása 4-8 óránként megakadályozza a folyamatos dehidratációt.
forráskontroll
A beteg újraélesztése után a figyelmet a forráskontroll megteremtésére kell fordítani. Amint korábban említettük, a kontrasztanyaggal megerősített CT-vizsgálat fontos a lefolyástalan gyűjtőhelyek és tályogok azonosításában. A posztoperatív betegeknél a forrásellenőrzést nagy valószínűséggel az intervenciós radiológia végzi. A hozzáférhetetlen gyűjtőedények vagy a kontrollálatlan intraabdominális sepsis esetén azonban elkerülhetetlen lehet a műtét. Széles spektrumú, empirikus intravénás antibiotikumokat nem szabad rutinszerűen alkalmazni az EKF kezelésére, kivéve, ha bizonyíték van intraabdominális gyűjtődésre vagy kapcsolódó cellulitisszel járó sebfertőzésre. Amikor csak lehetséges, az antibiotikumokat a specifikus tenyésztési adatokra kell irányítani, és legfeljebb 2 hétre kell korlátozni.
Efluencia kezelése
A sikerrel járó effluens kezelése jelentős hatást gyakorolhat a volumenstátuszra, az elektrolitegyensúlyra, a táplálkozásra és a bőr integritására.Az ECF-elvezetés kiegészítő orvosi kezelése hagyományosan két fő területre összpontosít: savsemlegesítés és térfogatcsökkentés.A protonpumpa-gátlók alkalmazása mindkét célt elérheti, és az adagot addig kell titrálni, amíg az elvezetés pH-ja 6-nál nagyobb, és az elvezetett mennyiség kevesebb, mint 1 l/nap. Bár a psyllium rendkívül hasznos lehet a folyás térfogatnövelésében és a tranzitidő növelésében, az antimotilitás és a kiválasztás elleni szerek, beleértve a loperamidot, az atropindifenoxilátot, a kodeint, az ópiumtinktúrát és még a metadont is, a térfogatcsökkentés fő támaszai. Tekintettel arra, hogy a szomatosztatin a gyomor-bélrendszeri hormonok univerzális gátlója, számos kutatás foglalkozott az exogén szomatosztatin hatásának vizsgálatával az ECF-ben szenvedő betegeknél. A jelentős számú randomizált, kontrollált vizsgálat ellenére a kis mintanagyság és a következetlen vizsgálati terv miatt nehéz jelentős következtetéseket levonni. Az octreotidot, egy hosszabb élettartamú szomatosztatin-analógot szintén vizsgálták ECF-kiegészítőként, ígéretes eredményekkel. A naponta háromszor 100 mcg Octreotid csökkentheti a kiáramló mennyiséget, és néhány vizsgálatban kimutatták, hogy csökkenti a spontán záródásig eltelt időt. Mint ilyen, indokolt lehet az octreotidterápia kipróbálása 72 órán keresztül, szoros fisztulakimeneti monitorozással, különösen olyan esetekben, amikor más terápiák nem tudták csökkenteni a kimeneti mennyiséget. A gyakori mellékhatások közé tartozik ahiperglikémia, fejfájás és epekőgyulladás.
Míg az adatok egyértelműek, hogy az alacsony outputú sipolyoknál megnő a spontán záródás aránya, kevésbé egyértelmű, hogy az output mennyiségének csökkentése javítja a sipoly záródását. Mindazonáltal, az output mennyiségének csökkentése jelentősen megkönnyítheti a sipolykezelés terhét, és pozitívan befolyásolhatja a betegek jólétét.
Sebellátás
Az ECF kezelésének talán egyik legnagyobb kihívást jelentő és erőforrásigényes aspektusa az effluens helyi ellenőrzése. Sikerenterikusan gyorsan lebonthatjuk a bőrt és nehezen kezelhető irritációt okozhatunk. Mint ilyen, a megfelelő bőrkezelés barrier krémekkel, nedvességgátlókkal, tasakoló eszközökkel és szívóeszközökkel kiemelkedő fontosságú. Különösen a nagy teljesítményű fisztuláknál gyakran szükség van csatornák, tasakok és szívókészülékek bonyolult hálózatára a folyás megfelelő szabályozásához. A magasan specializált sebellátó csapatok és az enterosztomális terapeuták felbecsülhetetlen értékűek mind a sebkezelés, mind a betegek kényelme szempontjából.
A negatív nyomású terápia (NPT) mindenütt elterjedt alkalmazása a sebek és a nyitott hasüregek kezelésében, nem meglepő, hogy az NPT azECF kezelésére szolgáló sebészeti eszköztár részévé vált. Az eddigi legnagyobb sorozatban Wainstein és munkatársai 91, -350 és -600 mmHg közötti negatív nyomással kezelt, nagy teljesítményű fisztulával rendelkező beteggel kapcsolatos tapasztalataikról számoltak be. Amellett, hogy az átlagos 1400 köbcentiméter/napról 138 köbcentiméter/napra csökkent a kiáramlás, a betegek 46%-ánál spontán záródást értek el. 2016-ban Misky és munkatársai egy metaanalízist tettek közzé, amelyben az NPT alkalmazását vizsgálták ECF-ben. Tíz retrospektív tanulmányt használva, összesen 151 beteggel, ezek a szerzők azt találták, hogy a spontán záródás medián aránya 65% volt (7%-100% között), a záródás medián ideje 58 nap volt. Ezek a kutatók 4,4%-os új sipoly kialakulásának arányáról is beszámoltak – ez egy olyan ismert szövődmény, amely néhány szakembert elbizonytalanított.Bár egyértelműen további vizsgálatokra van szükség annak meghatározásához, hogy az NPT véglegesen javíthatja-e az ECF záródási arányát vagy csökkentheti-e a spontán záródásig eltelt időt, nem szabad figyelmen kívül hagyni e kötések pozitív előnyeit. Ez a technológia legalábbis megkönnyítheti az ECF kezelését azáltal, hogy szabályozza a kiáramlást, védi a bőrt és csökkenti a kötéscserék gyakoriságát.
3. táblázat

| Kutatók | Intézményi gyakorlat |
|---|---|
| Hollington | 8 hónap |
| Evenson | 4 hónap |
| Rahbour | 12 hónap |
| Datta | 6 hónap |
| Lynch | 6 hónap. |
| Li | 6 hónap |
| Mcintyre | 6 hónap |
3. táblázat: Időzítés a végleges kezelésig.
3. táblázat
A végleges kezelésig való időzítés.
Táplálkozás
ÉrtékelésAz ECF beteg tápláltsági állapota kiemelkedően fontos. A peptidalapú enterális tápszerek és a teljes parenterális táplálás (TPN) megjelenése előtt a retrospektív történeti sorozatok rávilágítanak az ECF betegek alultápláltságának terhére. Egy az 1950-es és 1960-as években készült, 157 betegből álló sorozatban a proximális fisztulával rendelkező betegek közel 75%-a alultáplált volt. Hasonló eredményekről számoltak be Chapman és munkatársai, akik megállapították, hogy a betegeknek csak egy kis kisebbsége rendelkezett optimális táplálkozással; és hogy amint a táplálkozás javult, az ECF-hez kapcsolódó halálozás 55%-ról 12-16%-ra esett vissza.
A teljes tápláltsági állapotfelmérést minden ECF-es betegnél el kell végezni. Bár a Harris-Benedict-egyenlet jó kiindulópontot biztosít a táplálkozási szükségletek kiszámításához, széles körben elfogadott, hogy az ECF-betegek katabolikusak és hiperstabolikusak.Általában ezek a betegek fokozott kalóriatámogatást igényelnek, legalább 25-30 kcal/kg/nap szénhidrát és zsír és 1,5-2 gramm fehérje/kg/nap mennyiségben.
A táplálkozási állapotot és a fejlődést rendszeresen újra kell értékelni. A napi testsúly mellett rendszeresen követni kell a táplálkozással kapcsolatos laboratóriumi vizsgálatokat, mint például az albumin, a prealbumin, az átvitel és a CRP.Különösen a preoperatív albumin bizonyult az általános műtétet követő mortalitás és morbiditás legerősebb előrejelzőjének, és a hypoalbuminémia továbbra is jelentős előrejelzője a rossz kimenetelnek az ECF betegeknél. Az ECF-ben azonban talán a legtöbbet vizsgált fehérje a transzferrin, és a 140-nél magasabb szintek a spontán záródási arányok növekedésével és a mortalitás csökkenésével hozhatók összefüggésbe. Bár a nitrogénmérleg hasznos eszköz lehet, ez a standard mérés nehézségekbe ütközhet a nagy teljesítményű fisztulákkal rendelkező betegeknél. További vizsgálatok, mint például az indirekt kalorimetria megfontolandó olyan bonyolultabb esetekben, amelyek nem reagálnak a standard ellátásra.
Parenterális vs. enteralis táplálás
A parenterális táplálás kritikus szerepet játszott az ECF kezelésében, mivel használatát Dudrick 1969-ben szilárdan megalapozta.A TPN optimális kezelését leíró cikkében Dudrick arra a következtetésre jutott, hogy: “a parenteralis hiperalimentáció kizárólagos alkalmazásával a súlygyarapodás, a pozitív nitrogénegyensúly, a növekedés és a fejlődés rendszeresen megvalósul”. Azóta a TPN általánosan elfogadott eszköz a táplálkozás biztosítására, miközben elősegíti a “bélpihenést” és egyszerűsíti a szennyvízkezelést.Míg a TPN 30-50%-kal csökkenti a GI-szekréciót, ezáltal csökkenti a dehidratáció és az elektrolitegyensúlyhiány előfordulását, nincsenek randomizált tanulmányok a TPN anabolikus konverzióra, spontán záródási arányra vagy halálozásra gyakorolt hatásáról. Mindazonáltal a TPN továbbra is népszerű hosszú távú kezelési mód annak ellenére, hogy súlyos szövődményekkel jár, beleértve a fertőzést és a májműködési zavarokat.
A közelmúltban azonban egyre nagyobb teret nyert az enterális táplálás alkalmazása az ECF-ben. Az enterális táplálás alkalmazása számos előnnyel jár, beleértve a csökkent költségeket, a kevesebb fertőzést és a jobb immunológiai funkciót a TPN-hez képest. Sőt, még a kalóriák mindössze 20%-ának enterális úton történő biztosítása is segíthet a bélflóra fenntartásában és a baktériumtranszlokáció csökkentésében.
Sok sorozat számolt be meglepő sikerekről az enteralis táplálással kapcsolatban ECF betegeknél. Li és munkatársai retrospektív sorozatában 1168 beteg 86,4%-át kezelték eredményesen enterális táplálással.Az enterális táplálás még nagy teljesítményű fisztula esetén is sikeresen alkalmazható, ha elemi tápszerekkel, antimotilitás elleni szerekkel és rosttömegnövelő szerekkel kombinálják. Egy 335 betegből álló, nagy teljesítményű fisztulával rendelkező sorozatban Levy és munkatársai a kohorsz 85%-ánál tudták sikeresen elérni a TPN-függetlenséget enteralis táplálással. Érdekes módon az enterális táplálás és a “bélpihenő” hiánya ellenére a mortalitás és a spontán záródás aránya hasonló volt a korábbi sorozatokhoz.
A nagy teljesítményű, disztális mucocutan végtaggal rendelkező ECF esetén a fisztuloklizis fontos kiegészítője lehet a standard enterális táplálásnak. A fistuloclysis gyakorlata az újszülötteknél a chyme visszatáplálásának gyakorlatából származik, és utalhat akár a visszatáplálásra, akár az ECF disztális végtagjába helyezett katéteren keresztül történő további enterális szondatáplálás kiegészítésére. Teubner és munkatársai 2004-ben írták le először a fisztuloklizist mint az ECF terápiáját egy tizenkét proximális fisztulával rendelkező betegből álló esetsorozatban. Azóta számos esetjelentés és kisebb sorozat bizonyította a módszer táplálkozási hatékonyságát. A fisztuloklizis nélkül TEN-ben részesülő betegek megfelelő kohorszával összehasonlítva a fisztuloklizissel kezelt, nagy teljesítményű fisztulával rendelkező betegek májfunkciója és táplálkozási paraméterei szignifikánsan javultak. A fisztuloklizis különösen hasznos lehet azoknál a betegeknél, akiknél a TPN-hez kapcsolódó szövődmények, például fertőzések, vénás hozzáférési problémák vagy májelégtelenség alakul ki. Szövődmények azonban előfordulhatnak, és ezek közé tartozhat az elzáródás, ha a vékonybél perisztaltikus aktivitása a fisztulakatétert distalisan a vékonybélbe tolja.
A vitaminok és ásványi anyagok gyakran hiányoznak az ECF betegeknél.A zsírban oldódó vitaminok hiánya gyakori, míg a vízben oldódó vitaminok hiánya ritka, kivéve, ha a fisztula a proximális jejunumban van. Továbbá, mivel a B12-vitamin csak a végbél 50-60 cm-es szakaszán szívódik fel, sok ECF-betegnél szükség lehet injekciós B12-vitamin beadására. A magnézium gyakran pazarolódik a nagy teljesítményű fisztulákban, és a jobb enterális felszívódás érdekében intravénás magnézium-szulfáttal vagy szájon át szedhető magnézium-kloriddal kell pótolni. Végül mind a cink, mind a C-vitamin nagy dózisú pótlását javasolták. Míg az Omega-3 és a halolaj bizonyos előnyökkel járt az intenzív ellátásban, ezeket a táplálékkiegészítőket soha nem vizsgálták ECF-betegeknél, és nem alkalmazzák rutinszerűen.
Műtéti megfontolások
A spontán ECF-záródás aránya 15 és 75% között változik a szakirodalomban. A záródási arányok e széles skálája valószínűleg a betegpopulációk és az intézményi gyakorlatok eltéréseit tükrözi. A sipolyok lényegesen kisebb valószínűséggel záródnak spontán 4 hét után, és csak a sipolyok 10%-a záródik két hónap után. Mivel a spontán ECF-záródás aránya alacsony, a műtéti beavatkozás gyakran az egyetlen végleges kezelési stratégia.
Az ECF megműtésére vonatkozó döntést azonban nem szabad félvállról venni, mivel az ECF eltávolítását követő kiújulási arány 13-34% között mozog. Bár az ECF műtéti beavatkozásának alapelvei az általános sebészet számos alapelvét tartalmazzák, a műtét ideje talán a legfontosabb tényező, amelyet figyelembe kell venni. Fazio és munkatársai kimutatták a várakozó kezelés fontosságát az ECF-es betegek gondozása során. Ha a műtétre kevesebb mint 6 héttel az ECF kialakulása után került sor, a mortalitás meghaladta a 20%-ot. A műtét 6 hétnél hosszabb késleltetésével azonban a mortalitás 11%-ra csökkent, továbbá a korai műtét valószínűleg a kiújulás kockázatának növekedését eredményezi. Lynch és munkatársai sorozatában a 2 és 12 hét között operált betegeknél 28%-os volt a kiújulási arány, míg a 12 hétnél hosszabb késleltetés 15%-ra csökkentette ezt az arányt. A 3. táblázat mutatja, hogy a szakértő szerzők milyen hosszú várakozási időt javasolnak a nem gyógyuló ECF esetén a műtéti beavatkozás megfontolása előtt.
A műtéti kezelés csak a beteg és a sebész teljes befektetése és megértése mellett végezhető. Az ECF-záródások hosszú, technikailag kihívást jelentő esetek, jelentős szövődmények kockázatával. A műtétek gyakran szükségessé teszik a bél teljes mobilizálását a Treitz-szalagtól a végbélig.Tekintettel arra, hogy a visszatérő sipolyok 36%-a az ECF-záró műtét során keletkezett sérülések eredménye, nagy gondossággal kell eljárni az összenövések lízise során, hogy elkerüljük az egészséges bél véletlen sérülését. A sipolyos bél kezelésének mindig bélrezekciót és elsődleges asztomózist kell magában foglalnia. A fisztula túlvarrása vagy szélső reszekciója mindig magasabb recidívát eredményez (36% vs. 16%).
Következtetés
Az entero cutan fisztula az egyik legnagyobb kihívást jelentő komplikáció, amellyel az általános sebész szembesül. A gondos, szisztematikus és betegközpontú megközelítés alkalmazása segít a sikeres klinikai eredmények maximalizálásában. Annak ellenére, hogy az ECF kezelésének alapelvei következetesek a betegeknél, minden egyes sipoly egyedi, és kezelését nagyrészt a kimenete, valamint elhelyezkedése és a beteg társbetegségei határozzák meg. A sebészspecifikus és intézményi tapasztalatok aláhúzzák a késleltetett beavatkozás fontosságát.Bár a sebészek és a betegek egyaránt erős vágyat érezhetnek a műtéti lezárás iránt, a betegeket a legjobban a legalább 6 hónapos nem operatív kezelés szolgálja. Végső soron az ECF betegek hosszú távú ellátása multidiszciplináris, gyakran a sebész által koordinált ellátást igényel.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. Az enterocutan fisztula 11 éves tapasztalata. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Az enterocutan fisztulák kezelése: 30 éves klinikai tapasztalat. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Management of enterocutaneous fistulas: A review of 132 cases. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. 404 gasztrointesztinális fisztulában szenvedő beteg áttekintése. A parenterális táplálás hatása. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Seven-year experience of enterocutaneous fistula with univariate and multivariate analysis of factors associated with healing: development of a validated scoring system. Colorectal Dis. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. A felső gasztrointesztinális fisztulák kezelésének optimalizálása. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Az enterocutan fisztula táplálása és kezelése. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Az enterocutan fisztulák osztályozása és patofiziológiája. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. Az enterokutan fisztulák patofiziológiája. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM. Enterocutan fistula: javulnak-e a kezelések? Surgery: Surgery (Sebészet). 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Systematic management of postoperative enterocutaneous fistulas: factors related to outcomes. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. A systematic literature review on the use of vacuum assisted closure for enterocutaneous fistula. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. Többváltozós modell a gasztrointesztinális fisztulák prognosztikai tényezőinek meghatározására. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. High-output external fistulae of the small bowel: management with continuous enteral nutrition. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Történelmi perspektívák az enterocutan fisztulában szenvedő betegek ellátásában. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Metabolic support of the enterocutaneous fistula patient. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Enterocutan fistula complicating trauma laparotomy: A major resource burden. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Three years’ experience with an intestinal failure unit. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Enteric fistulas: principles of management. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Enterocutan fisztulák: bevált stratégiák és frissítések. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Summary of best practice recommendations for management of enterocutaneous fistulae from the Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Az enterokutan fisztula jelenlegi kezelése. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. A bélsistulák kezelése. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: International guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. A szomatosztatin-14 és analógjainak szerepe a gasztrointesztinális fisztulák kezelésében: klinikai adatok. Gut. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. A nagy teljesítményű enterokutan fisztulák kezelése vákuumtömörítő készülékkel. Egy tízéves tapasztalat. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr., Williams GM, Welch CE. A gyomor-bél traktusból eredő külső fisztulák. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Az enterocutan fisztulás beteg metabolikus és táplálkozási támogatása: háromfázisú megközelítés. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. A preoperatív szérum albuminszint mint a műtéti mortalitás és morbiditás előrejelzője: a National VA Surgical Risk Study eredményei. Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Az enterokutan fisztula sebészi helyreállítását követő kiújulást és mortalitást előrejelző tényezők. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract. 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. Támogathatja-e az intravénás táplálás mint a táplálkozás kizárólagos eszköze a gyermek növekedését és helyreállíthatja-e a felnőttkori fogyást? Egy igenlő válasz. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enterális versus parenteralis táplálás kritikusan beteg betegeknél: randomizált, kontrollált vizsgálatok frissített szisztematikus áttekintése és metaanalízise. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. A fistuloclysis sikeresen helyettesítheti a parenteralis táplálást az enterocutan fisztulában szenvedő betegek táplálási támogatásában. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloclysis: esetjelentés és irodalmi áttekintés. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. Fistuloclysis improves liver function and nutritional status in patients with high-output upper enteric fistula. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Az enterocutan fisztulák kezelése. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. A nagy teljesítményű enterocutan fisztulák sebészi kezelése: 24 év tapasztalata. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Az enterokutan fisztula operatív sebészete. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Klinikai kimenetel és a kiújulást előrejelző tényezők enterocutan fisztulaműtét után. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Outcome of 132 consecutive reconstructive operations for intestinal fistula–staged operation without primary anastomosis improved outcome in retrospective analysis. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. A külső gasztrointesztinális fisztulák kezelése. Ann Surg. 1978;188:460-7.