Tanulmányi célok
- A cellás jelölés használatát a galvánelemek leírására
- A galvánelemek alapvető összetevőinek leírását
A galvánelemek, más néven voltaikus cellák olyan elektrokémiai cellák, amelyekben spontán oxidációs-redukciós reakciók elektromos energiát termelnek. Az egyenletek felírásakor gyakran célszerű az oxidációs-redukciós reakciókat félreakciókra szétválasztani, hogy megkönnyítsük a teljes egyenlet kiegyensúlyozását, és kiemeljük a tényleges kémiai átalakulásokat.
Gondoljuk meg, mi történik, ha egy tiszta rézfémdarabot ezüstnitrátoldatba helyezünk (1. ábra). Amint a rézfém hozzáadódik, ezüstfém kezd képződni, és rézionok kerülnek az oldatba. A jobb oldali oldat kék színe a rézionok jelenlétét jelzi. A reakció két félreakciójára bontható. A félreakciók elválasztják az oxidációt a redukciótól, így mindkettő külön-külön is vizsgálható.
A redukciós félreakció egyenletét meg kellett duplázni, hogy a redukciós félreakcióban “nyert” elektronok száma megegyezzen az oxidációs félreakcióban “elveszített” elektronok számával.

A galván- vagy voltaelemek spontán elektrokémiai reakciókat foglalnak magukban, amelyekben a félreakciókat szétválasztják (2. ábra), hogy egy külső vezetéken keresztül áram folyhasson. Az ábra bal oldalán lévő főzőpoharat félcellának nevezzük, és 1 M réz(II)nitrát-oldatot tartalmaz, amelyben egy rézfémdarab részben az oldatba merül. A rézfém egy elektród. A réz oxidáción megy keresztül, ezért a rézelektród az anód. Az anód egy vezetékkel egy feszültségmérőhöz van csatlakoztatva, a feszültségmérő másik kapcsa pedig egy vezetékkel egy ezüst elektródához van csatlakoztatva. Az ezüst redukcióban van, ezért az ezüst elektróda a katód. Az ábra jobb oldalán látható félcella az ezüstelektródból áll, amely ezüstnitrát (AgNO3) 1 M-os oldatában van. Ezen a ponton nem folyik áram – azaz nem történik jelentős elektronmozgás a vezetéken keresztül, mert az áramkör nyitott. Az áramkört egy sóhíddal zárjuk, amely az áramot mozgó ionokkal továbbítja. A sóhíd egy koncentrált, nem reaktív elektrolitoldatból áll, mint például a példában használt nátrium-nitrát (NaNO3) oldat. Ahogy az elektronok balról jobbra áramlanak az elektródon és a vezetéken keresztül, a nitrátionok (anionok) a bal oldali porózus dugón keresztül a réz(II)nitrátoldatba jutnak. Ezáltal a bal oldali főzőpohár elektromosan semleges marad azáltal, hogy semlegesíti a réz(II)-ionok töltését, amelyek az oldatban keletkeznek, amikor a rézfém oxidálódik. Ugyanakkor, amikor a nitrátionok balra mozognak, a nátriumionok (kationok) jobbra, a porózus dugón keresztül a jobb oldali ezüst-nitrátoldatba áramlanak. Ezek a hozzáadott kationok “helyettesítik” az oldatból ezüstfémmé redukálódás közben eltávolított ezüstionokat, így a jobb oldali főzőpohár elektromosan semleges marad. A sóhíd nélkül a rekeszek nem maradnának elektromosan semlegesek, és nem folyna jelentős áram. Ha azonban a két rekesz közvetlenül érintkezik egymással, nincs szükség sóhídra. Abban a pillanatban, amikor az áramkör befejeződik, a feszültségmérő +0,46 V-ot mutat, ezt nevezzük a cella potenciáljának. A cellapotenciál akkor jön létre, amikor a két különböző fém összekapcsolódik, és az oxidációs-redukciós reakcióból származó, egységnyi töltésre jutó energia mértékegysége. A volt az elektromos potenciál származtatott SI-egysége
Ebben az egyenletben A az áram amperben, C pedig a töltés coulombban. Megjegyezzük, hogy a voltot meg kell szorozni a coulombban kifejezett töltéssel (C), hogy megkapjuk az energiát joule-ban (J).
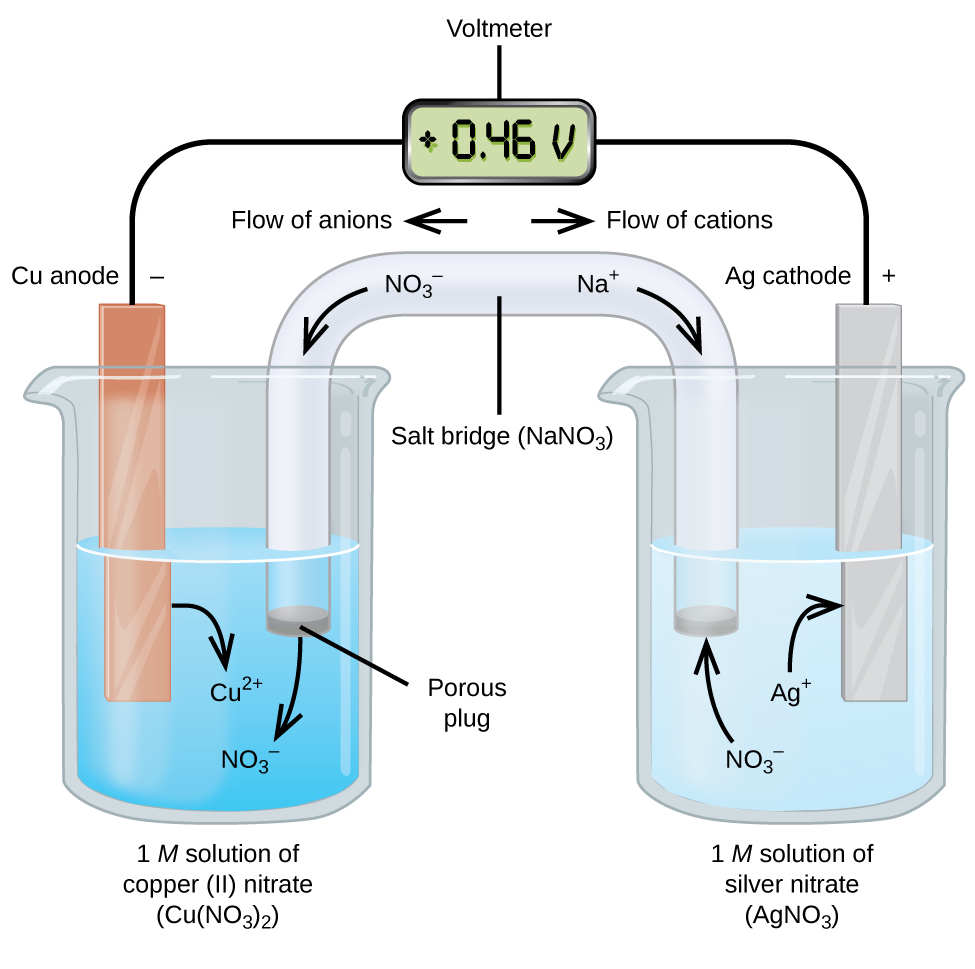
Ha az elektrokémiai elem ilyen módon van felépítve, a pozitív cellapotenciál spontán reakciót jelez, és azt, hogy az elektronok balról jobbra áramlanak. A 2. ábrán sok minden történik, ezért hasznos összefoglalni a dolgokat erre a rendszerre vonatkozóan:
- Az elektronok az anódtól a katód felé áramlanak: balról jobbra az ábrán látható szabványos galvánelemben.
- A bal oldali félcellában lévő elektród az anód, mert itt történik az oxidáció. Az elnevezés arra utal, hogy a sóhídban lévő anionok áramlanak felé.
- A jobb oldali félcellában lévő elektród a katód, mert itt redukció történik. Az elnevezés arra utal, hogy a sóhídban a kationok áramlása feléje történik.
- Az oxidáció az anódon (az ábrán a bal oldali félcellán) történik.
- A redukció a katódon (az ábrán a jobb oldali félcellán) történik.
- A cella potenciálja, +0.46 V ebben az esetben a két félcella előállításához használt anyagok természetének eredendő különbségeiből adódik.
- A sóhídnak jelen kell lennie ahhoz, hogy az áramkör bezáruljon (teljes legyen), és mind az oxidációnak, mind a redukciónak meg kell történnie ahhoz, hogy áram folyjon.
A galvánelemek sokféleképpen lehetségesek, ezért általában rövidített jelölést használunk a leírásukra. A cella jelölés (néha celladiagramnak is nevezik) információt nyújt a reakcióban részt vevő különböző fajokról. Ez a jelölés más típusú cellák esetében is működik. A függőleges vonal, │, a fázishatárt, a kettős vonal, ‖ pedig a sóhidat jelöli. Az anódra vonatkozó információkat balra írjuk, ezt követi az anódoldat, majd a sóhíd (ha van), majd a katódoldat, és végül jobbra a katódra vonatkozó információk. A 2. ábrán látható galvánelem cella jelölése tehát
Megjegyezzük, hogy a spektátorionok nem szerepelnek, és hogy az egyes félreakciók legegyszerűbb formáját használtuk. Ha ismertek, a különböző ionok kezdeti koncentrációit általában feltüntetjük.
A legegyszerűbb cellák egyike a Daniell-cella. Ezt az akkumulátort úgy lehet megépíteni, hogy egy rézelektródot helyezünk egy befőttesüveg aljára, és a fémet rézszulfát-oldattal fedjük le. A rézszulfátoldat tetejére cink-szulfátoldatot úsztatunk; majd a cink-szulfátoldatba cinkelektródot helyezünk. A rézelektródot a cinkelektródhoz csatlakoztatva elektromos áram folyik. Ez egy sóhíd nélküli cella példája, és a két oldat közötti határfelületen keresztül ionok áramolhatnak.
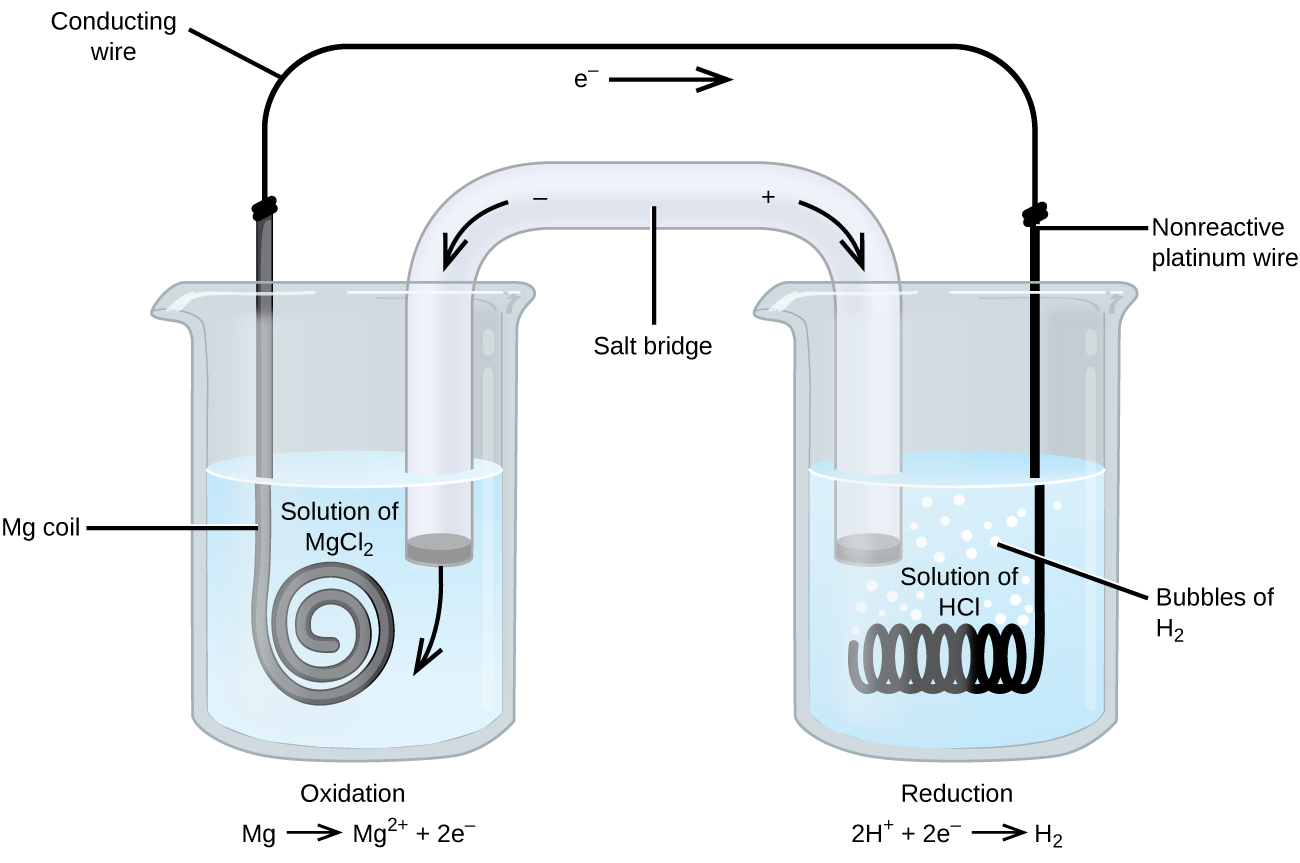
Egyes oxidációs-redukciós reakciókban olyan fajok vesznek részt, amelyek rossz áramvezetők, ezért olyan elektródot használnak, amely nem vesz részt a reakciókban. Az elektród gyakran platina, arany vagy grafit, amelyek mind inertek számos kémiai reakcióban. Az egyik ilyen rendszer a 3. ábrán látható. A magnézium az ábrán bal oldali anódon oxidáción megy keresztül, a hidrogénionok pedig a jobb oldali katódon redukción. A reakció a következőképpen foglalható össze:
A cella inert platinadrótot használt katódként, így a cella jelölése
A magnéziumelektród aktív elektród, mert részt vesz az oxidációs-redukciós reakcióban. Az inert elektródák, mint a 3. ábrán látható platinaelektród, nem vesznek részt az oxidációs-redukciós reakcióban, és azért vannak jelen, hogy áram folyhasson a cellán keresztül. A platina vagy az arany általában azért jó inert elektródák, mert kémiailag nem reagálnak.
1. példa
A cella jelölésének használata
Gondoljunk egy galváncellára, amely
Írd fel az oxidációs és redukciós félreakciókat, és írd fel a reakciót a cella jelölésével. Melyik reakció megy végbe az anódon? A katódon?
Solution
A vizsgálat szerint a Cr oxidálódik, amikor három elektront veszít Cr3+ képződéséhez, és a Cu2+ redukálódik, amikor két elektront nyer Cu képződéséhez. A töltések kiegyenlítése adja
A cellás jelölés az egyes egyenletek legegyszerűbb formáját használja, és a reakciót az anódnál kezdi. Így nem adtunk meg koncentrációkat: \text{Cr}(s){\mid}\text{Cr}^{3+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s). Az oxidáció az anódon, a redukció pedig a katódon történik.
A cella jelölésének használata
Gondoljunk egy galváncellára, amely
Írd fel az oxidációs és redukciós félreakciókat, és írd fel a reakciót cellás jelöléssel. Melyik reakció megy végbe az anódon? A katódon?
Solution
Az ellenőrzés szerint a Fe2+ oxidáción megy keresztül, amikor egy elektront veszít, hogy Fe3+ képződjön, és a MnO4- redukálódik, amikor öt elektront nyer, hogy Mn2+ képződjön. A töltések kiegyenlítése
A cellás jelölés az egyes egyenletek legegyszerűbb formáját használja, és a reakciót az anódnál kezdi. Azért kell inert elektródot, például platinát használni, mert nincs jelen olyan fém, amely az elektronokat az anódról a katódra vezetné. Így nem adtak meg koncentrációkat: \text{Pt}(s){\mid}\text{Fe}^{2+}(aq)\text{,}\;\text{Fe}^{3+}(aq){\parallel}\text{MnO}_4^{\;\;-}(aq)\text{,}\;\text{H}^{+}(aq)\text{,}\;\text{Mn}^{2+}(aq){\mid}\text{Pt}(s). Az oxidáció az anódon, a redukció pedig a katódon történik.
Check Your Learning
A cellás jelölés segítségével írja le a galvánelemet, ahol a réz(II)-ionok rézfémmé redukálódnak, a cinkfém pedig cinkionokká oxidálódik.
Válasz:
A feladatban megadott információk alapján:
\begin{array}{lr @{{{}\longrightarrow{}} l}} \text{anode\;(oxidáció):} & \text{Zn}(s) & \text{Zn}^{2+}(aq)\;+\;2\text{e}^{-} \\ \text{katód\;(redukció):} & \text{Cu}^{2+}(aq)\;+\;2\text{e}^{-} & \text{Cu}(s) \\ \ \hline \\\ \text{összességében:} & \text{Zn}(s)\;+\;\text{Cu}^{2+}(aq) & \text{Zn}^{2+}(aq)\;+\;\text{Cu}(s) \end{array}
A cellás jelölés használata:
\text{Zn}(s){\mid}\text{Zn}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s).
Az elektrokémiai cellák általában két félcellából állnak. A félcellák elválasztják az oxidációs félreakciót a redukciós félreakciótól, és lehetővé teszik, hogy egy külső vezetéken keresztül áram folyjon. Az egyik félcella, amelyet az ábrán általában a bal oldalon ábrázolnak, az anódot tartalmazza. Az oxidáció az anódon történik. Az anód a másik félcellában lévő katódhoz van csatlakoztatva, amely az ábrán gyakran a jobb oldalon látható. A redukció a katódon történik. Egy sóhíd hozzáadása kiegészíti az áramkört, lehetővé téve az áram áramlását. A sóhídban lévő anionok az anód felé, a sóhídban lévő kationok pedig a katód felé áramlanak. Ezeknek az ionoknak a mozgása kiegészíti az áramkört, és elektromosan semlegesen tartja az egyes félcellákat. Az elektrokémiai cellákat a cella jelöléssel lehet leírni. Ebben a jelölésben az anódon lejátszódó reakcióra vonatkozó információk a bal oldalon, a katódon lejátszódó reakcióra vonatkozó információk pedig a jobb oldalon jelennek meg. A sóhidat egy kettős vonallal ábrázoljuk, ‖. A szilárd, folyékony vagy vizes fázisokat egy félcellán belül egyetlen vonal, │ választja el. A különböző fajok fázisa és koncentrációja a faj neve után szerepel. Az oxidációs-redukciós reakcióban részt vevő elektródokat aktív elektródoknak nevezzük. Azokat az elektródokat, amelyek nem vesznek részt az oxidációs-redukciós reakcióban, de arra szolgálnak, hogy áramot engedjenek folyni, inert elektródáknak nevezzük. Az inert elektródák gyakran platinából vagy aranyból készülnek, amelyek számos kémiai reakció során nem változnak.
Kémia Fejezet vége Gyakorlatok
- Írd fel a következő kiegyensúlyozott reakciókat a cellás jelölés segítségével. Használjon platinát inert elektródként, ha szükséges.
(a) \text{Mg}(s)\;+\;\text{Ni}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Ni}(s)
(b) 2\text{Ag}^{+}(aq)\;+\;\text{Cu}(s)\;{\longrightarrow}\;\text{Cu}^{2+}(aq)\;+\;2\text{Ag}(s)
(c) \text{Mn}(s)\;+\;\text{Sn(NO}_3)_2(aq)\;{\longrightarrow}\;\text{Mn(NO}_3)_2(aq)\;+\;\text{Au}(s)
(d) 3\text{CuNO}_3(aq)\;+\;\text{Au(NO}_3)_3(aq)\;{\longrightarrow}\;3\text{Cu(NO}_3)_2(aq)\;+\;\text{Au}(s)
- A következő cellák jelölése alapján határozzuk meg az oxidált és redukált fajokat, valamint az oxidáló és redukáló anyagot anélkül, hogy felírnánk az egyensúlyi reakciókat.
(a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s)
(b) \text{Ni}(s){\mid}\text{Ni}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s)
- Az előző feladatban szereplő cellák jelölésére, írja fel a megfelelő egyensúlyi reakciókat.
- Hozzuk egyensúlyba a következő reakciókat, és írjuk fel a reakciókat a cellás jelölésekkel. Hagyja figyelmen kívül az inert elektródákat, mivel azok soha nem részei a félreakcióknak.
(a) \text{Al}(s)\;+\;\text{Zr}^{4+}(aq)\;{\longrightarrow}\;\text{Al}^{3+}(aq)\;+\;\text{Zr}(s)
(b) \text{Ag}^{+}(aq)\;+\;\text{NO}(g)\;{\longrightarrow}\;\text{Ag}(s)\;+\;\text{NO}_3^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(acidic\;solution)}
(c) \text{SiO}_3^{\;\;2-}(aq)\;+\;\text{Mg}(s)\;{\longrightarrow}\;\text{Si}(s)\;+\;\text{Mg(OH)}_2(s)\;\;\;\;\;\;\;\text{(basic\;solution)}
(d) \text{ClO}_3^{\;\;-}(aq)\;+\;\text{MnO}_2(s)\;{\longrightarrow}\;\text{Cl}^{\;\;-}(aq)\;+\;\text{MnO}_4^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(bázis\;oldat)}
- Az előző feladatban szereplő összes reakció esetében határozzuk meg az oxidált és redukált fajokat, valamint az oxidáló és redukáló anyagot.
- A megadott információk alapján használjon cellás jelölést a következő rendszerek leírásához:
(a) Az egyik félcellában egy Pt(NO3)2 oldat Pt fémet képez, míg a másik félcellában Cu fém megy Cu(NO3)2 oldatba, ahol minden oldott anyag koncentrációja 1 M.
(b) A katód egy arany elektródból áll 0,55 M Au(NO3)3 oldatban, az anód pedig egy magnézium elektród 0.75 M Mg(NO3)2 oldatban.
(c) Az egyik félcella egy ezüstelektródból áll 1 M AgNO3 oldatban, a másik félcellában pedig egy rézelektródot oxidálnak 1 M Cu(NO3)2 oldatban.
- Miért van szükség sóhídra a 2. ábrához hasonló galvánelemekben?
- Az aktív (fém) elektródról megállapították, hogy az oxidációs-redukciós reakció előrehaladtával tömeget veszít. Az elektród az anód vagy a katód része volt? Magyarázza meg.
- Az aktív elektródák részt vesznek az oxidációs-redukciós reakcióban. Mivel a fémek kationokat képeznek, az elektród tömeget veszítene, ha az elektródban lévő fématomok oxidálódnának és oldatba kerülnének. Az oxidáció az anódon történik.
- Három különböző galvánelemből származó fémelektród tömegét határoztuk meg, mielőtt és miután az egyes cellákban az oxidációs-redukciós reakció által létrehozott áramot néhány percig folyni hagytuk. Megállapítottuk, hogy az első, A jelű fémelektród tömege nőtt; a második, B jelű fémelektród tömege nem változott; a harmadik, C jelű fémelektród tömege pedig csökkent. Tegyen egy megalapozott becslést arra vonatkozóan, hogy melyik elektróda volt az aktív és melyik az inert elektróda, illetve melyik volt az anód(ok) és melyik volt a katód(ok).
Glosszárium
aktív elektród olyan elektród, amely részt vesz egy elektrokémiai cella oxidációs-redukciós reakciójában; az aktív elektród tömege az oxidációs-redukciós reakció során változik anódelektród egy elektrokémiai cellában, amelyen oxidáció történik; az anódra vonatkozó információkat a sóhíd bal oldalán rögzítjük a cella jelölésében katódelektród egy elektrokémiai cellában, ahol redukció történik; a katódra vonatkozó információkat a sóhíd jobb oldalán rögzítjük a cella jelölésében cella jelölésében cella jelölése rövidített módja az elektrokémiai cellában lejátszódó reakciók ábrázolásának cellapotenciál különbség az elektromos potenciálban, amely akkor keletkezik, ha különböző fémeket kapcsolnak össze; az oxidációs-redukciós reakciókban a töltésáramlás (áram) hajtóereje galváncella elektrokémiai cella, amely spontán oxidációs-redukciós reakcióval jár; pozitív cellapotenciállal rendelkező elektrokémiai cellák; más néven voltaikus cella inert elektród Elektroda, amely lehetővé teszi az áram folyását, de egyébként nem vesz részt az elektrokémiai cellában zajló oxidációs-redukciós reakcióban; az inert elektród tömege nem változik az oxidációs-redukciós reakció során; az inert elektródok gyakran platinából vagy aranyból készülnek, mivel ezek a fémek kémiailag nem reagálnak. voltaikus cella a galvánelem másik neve
megoldások
Válaszok a kémia fejezet végi feladatokra
1. (a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Ni}^{2+}(aq){\mid}\text{Ni}(s); (b) \text{Cu}(s){\mid}\text{Cu}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s); (c) \text{Mn}(s){\mid}\text{Mn}^{2+}(aq){\parallel}\text{Sn}^{2+}(aq){\mid}\text{Sn}(s); (d) \text{Pt}(s){\mid}\text{Cu}^{+}(aq)\text{,\;Cu}^{2+}(aq){\parallel}\text{Au}^{3+}(aq){\mid}\text{Au}(s)
3. (a) \text{Mg}(s)\;+\;\text{Cu}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Cu}(s); (b) 2\text{Ag}^{+}(aq)\;+\;\text{Ni}(s)\;{\longrightarrow}\;\text{Ni}^{2+}(aq)\;+\;2\text{Ag}(s)
5. Oxidált faj = redukálószer: (a) Al(s); (b) NO(g); (c) Mg(s); és (d) MnO2(s); Redukált faj = oxidálószer: (a) Zr4+(aq); (b) Ag+(aq); (c) \text{SiO}_3^{\\;\;2-}(aq); és (d) \text{ClO}_3^{\;\;-}(aq)
7. A sóhíd nélkül az áramkör nyitott (vagy megszakadt) lenne, és nem folyhatna áram. Sóhíddal minden félcella elektromosan semleges marad, és áram folyhat az áramkörön keresztül.
9. Megállapították, hogy egy aktív (fém) elektróda tömeget nyer, ahogy az oxidációs-redukciós reakciót hagyják lezajlani. Az elektród az anód vagy a katód része volt? Magyarázza meg.