Az adaptív immunválasz sejtközvetített ágában a rövid peptideket a major histocompatibility complex (MHC) I. és II. osztályú molekulák kötik meg, és a sejtfelszínen mutatják be, ahol a T-limfociták antigénreceptorai felismerik őket. Az adott MHC-peptidkomplexet felismerő T-sejt-receptor (TCR) kötődése arra készteti a naiv limfocitákat, hogy differenciálódjanak effektorsejtekké (citotoxikus és helper T-sejtek), amelyek elpusztítják a fertőzött gazdasejteket vagy serkentik az ellenanyagtermelést, illetve memória sejtekké, amelyek védelmet nyújtanak az újrafertőződéssel szemben.
MHC-molekulák szerkezete és funkciója
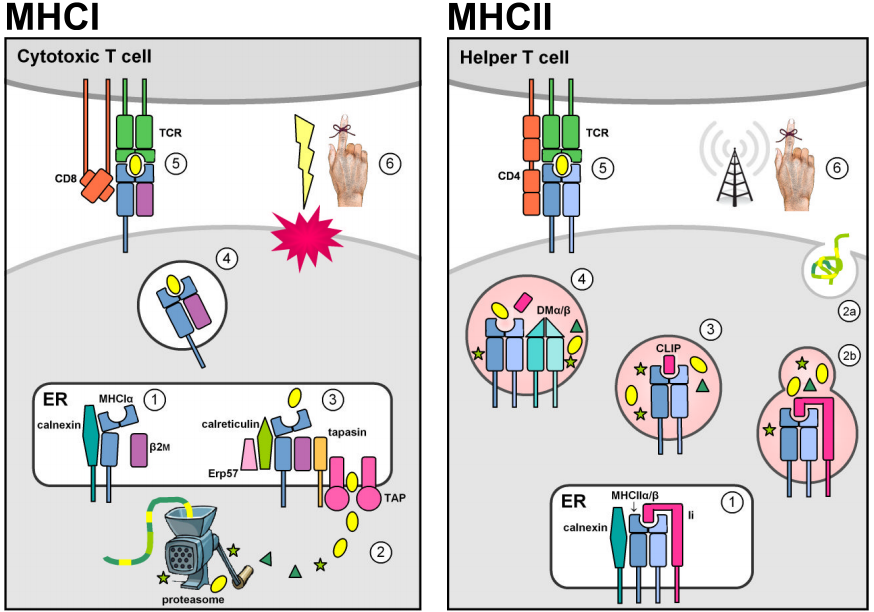
Az MHC genomiális régióban található két multigéncsalád olyan antigénkötő molekulákat kódol, amelyek idegen peptideket mutatnak be a sejtfelszínen. Valójában az MHC-molekulák saját maguk által előállított peptideket is bemutatnak. Az autoreaktív T-sejtekkel szembeni negatív tímiás szelekció azonban megakadályozza, hogy az MHC-self-peptid komplexek immunválaszt váltsanak ki. Az MHC I. osztályú molekulák a legtöbb sejtmagon expresszálódnak, és jellemzően a citoszolban szaporodó intracelluláris patogénekből (pl. vírusok) származó endogén peptideket tartalmaznak. A citoszolikus fehérjéket a proteaszóma rövid peptidfragmentumokká bontja le, és az ATP-függő TAP1 & 2 transzporterek először az endoplazmatikus retikulumba (ER) szállítják őket MHCI-töltés céljából, majd a sejtfelszínre, hogy a keringő citotoxikus CD8+ T-sejtek elé kerüljenek, amelyek feladata a fertőzött célsejt apoptózisának és lízisének kiváltása. (Az ábrák a Murphy et al. (2008) 3.12., 3.25., 5.5., & 5.11. ábra alapján készültek.)
Az MHC II. osztályú lokuszok konstitutív expressziója az immunrendszer antigénprezentáló sejtjeire (APC-k, pl. makrofágok, dendritikus sejtek és B-limfociták) korlátozódik. Az MHCII molekulákat stabilizálják és megakadályozzák az antigén megkötését, amíg az ER-ben rezidensek, a II. osztályú invariáns lánccal (Ii, vagy CD74) való társulás révén, majd az alapértelmezett szekréciós útvonalról átirányítják őket az endocitikus útvonalra. Ott találkoznak az intracelluláris vezikulákban szaporodó kórokozókból származó peptidekkel vagy a sejtbe szállított extracelluláris kórokozókból és fehérjékből származó peptidekkel. A stabil peptidkötést a nem klasszikus MHCII DMα/β dimer katalizálja, és lehetővé teszi, hogy az MHCII-peptid komplexek kikerüljenek az endocitikus útvonalból a sejtfelszínen történő prezentáció céljából. A CD4+ T-sejtek általi felismerés aktiválja a célzott gazdasejtet az antibakteriális mechanizmusok stimulálása (makrofágokban) vagy az antitesttermelés és a humorális immunválasz kiváltása érdekében.
Az MHCI és MHCII molekulák szerkezeti hasonlóságai valószínűleg egy közös őstől való származásukat tükrözik. Az érett MHC-molekulák I. típusú integrális membránglikoproteinek, amelyek egy peptidkötő barázdából és immunglobulinszerű, transzmembrán és citoplazmatikus doménekből állnak. Az MHC-molekulák extracelluláris részei két membrándistális doménből állnak, amelyek együttesen egy peptidkötő üreget alkotnak, amelyet két megszakított α hélix határol, amelyek egy antiparallel β lap tetején nyugszanak, valamint két membránproximális immunglobulinszerű (Ig-szerű) doménből, amelyek részt vesznek a CD4 és CD8 coreceptorok kötésében.
A szerkezeti hasonlóságok ellenére a fehérje alegységek kódolása az I. és II. osztályú molekulák esetében eltérő. Az MHCI-molekulák heterodimerek, amelyek az MHCIα nehézlánc és a β2-mikroglobulin (β2m) közötti nemkovalens asszociáció révén jönnek létre, amelyet egy, az MHC genomiális régióján kívül elhelyezkedő, nagyrészt invariáns lókusz kódol. A nehézlánc hozzájárul a peptidkötő hasadékhoz és az egyik Ig-szerű doménhez, míg a β2m csak egy második Ig-szerű régiót szolgáltat, amelyből hiányzik a transzmembrán horgony. Az MHC II. osztályú molekulák heterodimerek, amelyek egy α és β lánc nemkovalens asszociációjával jönnek létre, mindkettő egyetlen peptidkötő és membránhorgonyzott Ig-szerű doménnel járul hozzá, és mindegyikük egy külön lókuszból íródik át, amely jellemzően az MHC régióban található.
A MHC géncsalád tagjai tovább oszthatók klasszikus vagy nem klasszikus lókuszokra, a nem funkcionális pszeudogének mellett. A klasszikus MHC Ia lókuszok széles körben expresszálódnak, és jellemzően nagy szekvencia-variabilitással és a peptidkötő régió (PBR) maradékaiban bekövetkező szubsztitúciókra ható pozitív szelekcióval járnak együtt. A nem klasszikus MHC Ib lókuszok ehelyett csökkent expresszióval vagy korlátozott szöveti eloszlással, alacsonyabb polimorfizmussal és korlátozott vagy módosított funkcióval rendelkezhetnek. A II. osztályú gének esetében a “klasszikus” kifejezés általában az összes antigénprezentáló lókuszra vonatkozik, míg a “nem klasszikus” kifejezést olyan génekre tartjuk fenn, mint a DMα/β, amelyek kiegészítő szerepet töltenek be az antigénprezentációs útvonalban. Bár a géncsalád tagjainak ez a funkcionális kategorizálása hasznos munkaszótárat biztosít, a klasszikus és nem klasszikus lókuszok közötti határvonal a gyakorlatban nem mindig egyértelmű, és néhány nem klasszikus MHCI-lókusz polimorf, széles körben kifejeződik, vagy a klasszikus gének hagyományos módján köt peptid ligandumokat.
A populációs szintű extrém polimorfizmus és a kiegyensúlyozó szelekció bizonyítékai azt jelzik, hogy az MHC-gének jelentős allélvariációjára valószínűleg szükség van a kórokozók sokféle csoportjának felismeréséhez és az arra való reagáláshoz. Ugyanakkor néhány fajban a kiterjedt génduplikáció ellenére az egyedek jellemzően csak mérsékelt számú klasszikus MHC-lokuszt fejeznek ki, és néhány poliploid Xenopus fajban is megfigyelhető a disomikus öröklődésre való visszafordulás. Az egyedeken belüli MHC-variációra vonatkozó korlátozások (legalábbis a magasan kifejezett klasszikus lókuszok esetében) feltehetően egy funkcionális kompromisszumot tükröznek a patogén peptidek nagyobb választékának bemutatásához szükséges allélrepertoár növelése és a T-sejt-repertoár ezzel járó csökkenése között, amely az öntolerancia fenntartásához szükséges lenne. Az egyes MHC-molekuláknak ezért képesnek kell lenniük a megengedő peptidkötésre, hogy megfelelően felismerjék az idegen antigének széles skáláját. Ugyanakkor olyan stabil MHC-peptidkomplexek létrehozására is szükség van, amelyek elegendő ideig fennmaradnak a T-sejtek felismeréséhez, és amelyek nem cserélnek peptideket a sejtfelszínen, ami a nem fertőzött sejtek pusztulásához vezethet. Az ilyen stabilitás általában nagy affinitású, és ezért korlátozó intermolekuláris kölcsönhatásokkal jár.
A MHC-molekulák ezeket az egymással versengő kötődési követelményeket egy elegáns szerkezeti megoldással egyeztetik össze: az MHC-molekula erősen konzervált peptidkötő régió (PBR) maradékai és a peptid főlánc atomjai közötti kapcsolatok stabilizálják a legtöbb peptid ligandumok promiszkuláris kötődését, míg a peptidkötő barázdát bélelő polimorf maradékok különböző sztereokémiájú szabálytalan zsebeket hoznak létre, amelyek szekvenciafüggő módon fogadják a peptidmaradékokat. Az oldallánc-kötő zsebek által előírt korlátozások mind az allélok között, mind az egy MHC-molekulán belüli zsebek között változnak. A szigorúbb kötési követelményeket támasztó zsebeket “elsődleges horgonyzó” peptidmaradványok befogadására alkalmasnak nevezzük, míg a “másodlagos horgonyzók” kötési preferenciái rugalmasabbak. Ezek a specifitások együttesen határozzák meg egy adott MHC-allél peptidkötő motívumát, hogy szelektivitást biztosítsanak az antigénprezentáció során.