ATP, NAD ÉS FAD
ATP
A sejtek az adenozin-trifoszfát (vagy ATP) molekulát használják energiaforrásként (lásd a 2. ábrát). Az ebben a molekulában lévő foszfátok képesek energiát szolgáltatni a sejtjeinkben lévő szubsztrátoknak. A sejtjeinkben léteznek olyan enzimek, amelyek képesek egy foszfátot eltávolítani az ATP-ből, és egy másik molekulához – általában egy fehérjéhez – kötni (lásd a 3. ábrát). Amikor ez megtörténik, azt mondjuk, hogy a fehérje foszforilálódott. Gondoljunk úgy a harmadik foszfátra, mint egy kis energiazsákra. Amikor átkerül egy fehérjéhez, ez az energia felhasználható valamire. A 3. ábrán például a fehérje megváltoztatja az alakját, amikor foszforilálódik. Amikor a fehérjék megváltoztatják alakjukat, ezt gyakran a fehérjeszerkezet konformációs változásának nevezzük. Sok olyan fehérje van a szervezetben, amely az ATP foszfátját használja fel a konformációs változás előidézésére. A fehérje alakjának ez a változása végül olyan dolgokat tesz lehetővé, mint az izomösszehúzódás, a sejtmozgás, a membránszállítás és az enzimek működése. A sejtek és az élet csak akkor létezik, ha az ATP folyamatos és állandó ellátása biztosított.
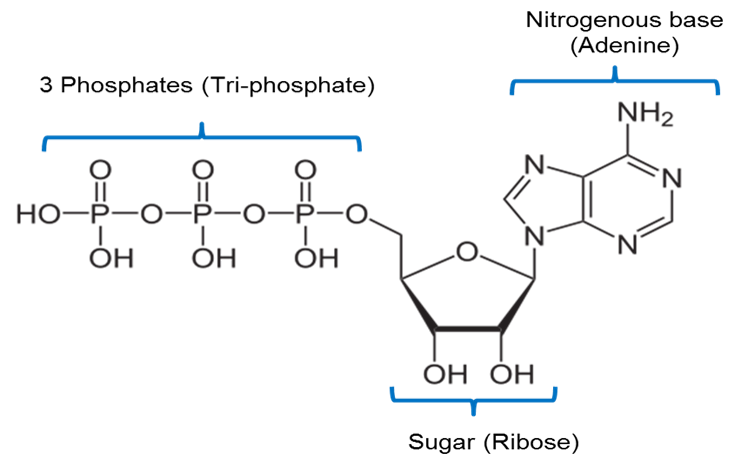
A képet JS készítette a BYU Idaho F2013-ban.
A fenti kép az ATP kémiai szerkezetét ábrázolja. Az ATP egy adenin nevű nitrogénbázist tartalmaz, amely egy ribóz nevű 5 szénatomos cukorhoz és 3 foszfátcsoporthoz kapcsolódik.
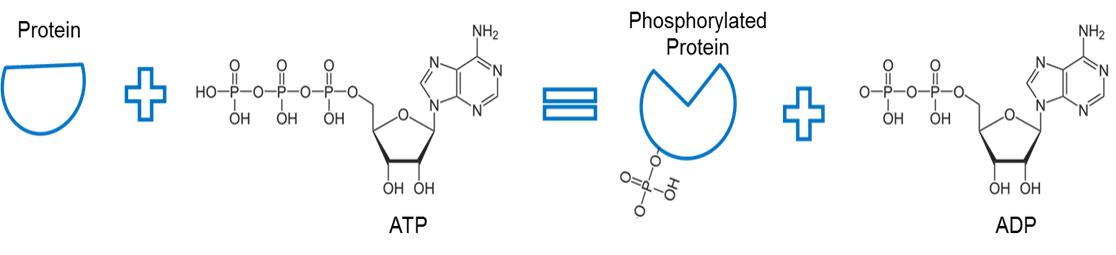
Image created by JS at BYU Idaho F2013.
Az ATP-t egy fehérje foszforilálására használják. Egy kináznak nevezett enzim (nem látható) eltávolít egy foszfátot az ATP-ből, és elősegíti a foszfát és egy másik fehérje közötti kötést. A foszfát ilyen módon történő kötését egy fehérjéhez foszforilációnak nevezzük. A foszfátcsont a fehérjével magasabb energiájú. Vegyük észre, hogy a foszforiláció ezt az energiát a fehérje alakjának konformációs változására használja fel.
NAD és FAD
A nikotinamid-adenin-dinukleotid (NAD) és a flavin-adenin-dinukleotid (FAD) koenzimek, amelyek reverzibilis oxidációs és redukciós reakciókban vesznek részt. Gyakran mondják, hogy ezek a vegyületek elektronhordozók, mivel elektronokat vesznek fel (redukálódnak) a szerves molekulák, például a szénhidrátok és a lipidek lebontásának katabolikus lépései során. Ezután ezek a redukált koenzimek ezeket az elektronokat átadhatják valamilyen más biokémiai reakcióhoz, amely általában egy anabolikus folyamatban (például az ATP szintézisében) vesz részt.
NAD+ / NADH
A nikotinamid-adenin-dinukleotidot oxidált állapotában NAD+-nak, redukció (vagy elektronfelvétel) után NADH-nak nevezik. A molekuláris illusztrációt lásd a 4. ábrán. A niacin (más néven B3) vitaminból származik ez a vegyület. A niacin biztosítja a szerves gyűrűszerkezetet, amely közvetlenül részt vesz egy hidrogénatom és 2 elektron átadásában. A NAD+ gyakran egy “dehidrogenáz” enzimmel együtt található. A dehidrogenáz reakció két hidrogénatomot távolít el; egyet hidridként (:H-) (a hidrid egy hidrogénatom 2 elektronnal) és egyet hidrogén-kationként (H+) (és természetesen a hidrogén-kationnak nincsenek elektronjai). A hidrid kötődik a NAD+-hoz, és a Nictinamid-Adenin-Dinukleotid (NADH) redukált vegyületét hozza létre. A második hidrogénatom (H+) felszabadul az oldatba, lásd a 4. ábrát.
Amint az anyagcsere reakcióit vizsgálja, keressen olyan reakciókat, amelyek NADH-t eredményeznek. A NADH fontos lesz, mivel az általa felvett hidrogéneket és elektronokat olyan biokémiai folyamatokhoz juttatja el, amelyek az elektronokat és hidrogéneket ATP előállítására tudják felhasználni.
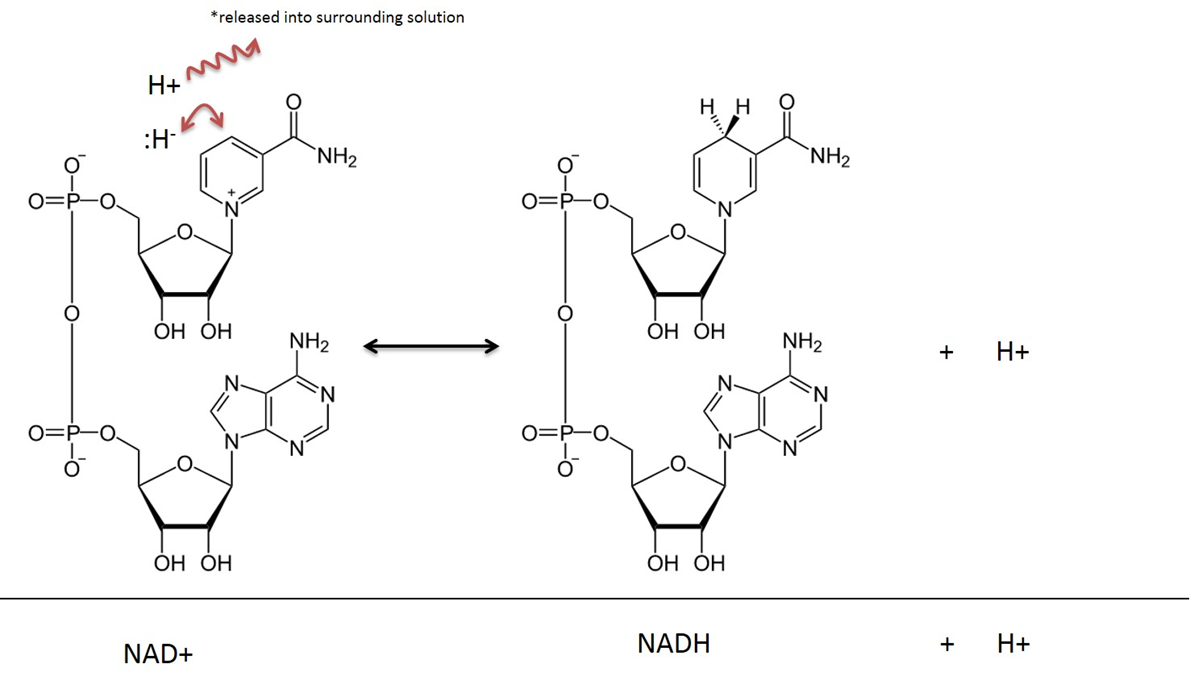
A képet JS készítette a BYU Idaho F2013-ban.
A NAD-ot érintő anyagcsere-reakciókban két hidrogénatom és két elektron távozik egy szubsztrátból, és átkerül a NAD+-ra. A NAD+ befogad egy hidridiont (egy hidrogén 2 elektronnal), és redukált formában (NADH) nikotinamid-adenin-dinukleotiddá alakul. A reakció során szintén befogott hidrogén-kation a környező oldatba kerül. Ne feledjük, hogy ez a reakció reverzibilis.
A metabolizmusban lejátszódó reakciók magyarázatakor általában figyelmen kívül hagyják az oldatba kerülő H+ -t, és ez a szöveg a NAD redukció eredményét egyszerűen NADH-ként, nem pedig NADH + H+-ként ábrázolja.
FAD / FADH2
A flavin adenin-dinukleotidot oxidált állapotában FAD-nak nevezzük. Redukált állapotában FADH2-nek nevezzük. A molekuláris illusztrációt lásd az 5. ábrán. A riboflavin (vagy B2) vitaminból származik ez a vegyület. A riboflavin biztosítja azokat a gyűrűszerkezeteket, amelyek közvetlenül részt vesznek a két hidrogénatom (ezúttal egy-egy elektronnal) átadásában. A NAD-hoz hasonlóan a FAD is egy “dehidrogenáz” enzimmel együttműködve működik. A reakció során két hidrogénatomot távolít el; egy-egy proton egy elektronnal. Mindkét hidrogénatom a FAD-hoz kötődik. Ez a reakció nem bocsát ki H+-t az oldatba, mint a NAD redukciója.
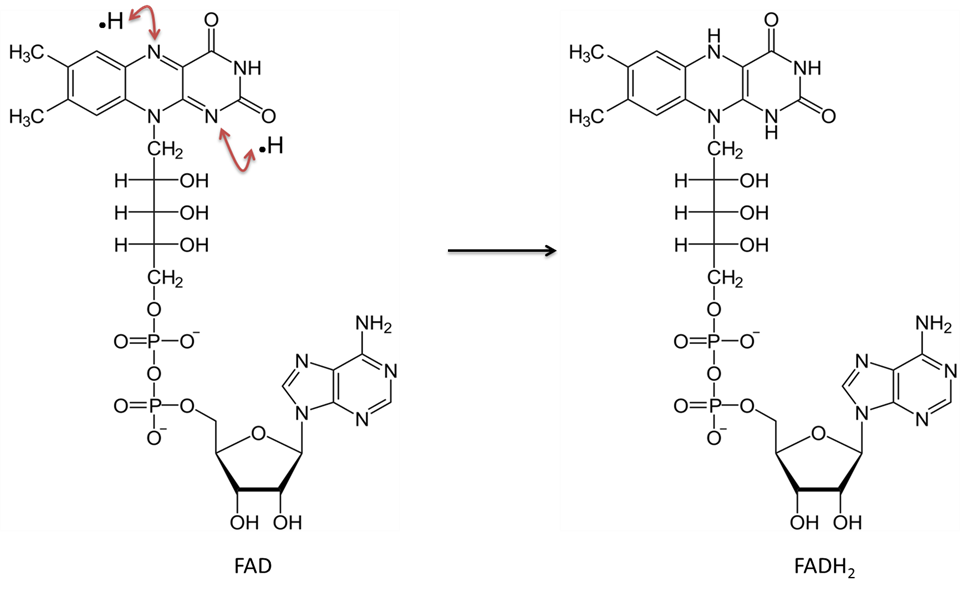
A képet JS készítette a BYU Idaho F2013-ban.
A flavin-adenin-dinukleotid oxidált formában (FAD) két hidrogénatomot (egy-egy elektronnal) vesz fel, és FADH2-vé alakul.
Az anyagcsere reakcióit vizsgálva keressünk olyan reakciót, amelyben FADH2 keletkezik. A NADH-hoz hasonlóan a FADH2 is fontos lesz, mivel hidrogéneket és elektronokat szállít a biokémiai folyamatoknak, amelyek az elektronokat és hidrogéneket ATP előállítására tudják felhasználni.
**Az alábbi gombok segítségével a modul következő vagy előző olvasmányához léphet**

