Generikus név: naftifin-hidroklorid
Adagolási forma: gél
A Drugs.com által orvosilag felülvizsgált. Utolsó frissítés: 2020. április 1.
- Áttekintés
- Mellékhatások
- Adagolás
- Szakorvosi
- Terhesség
- Tovább
- Indikációk és A Naftin gél alkalmazása
- Naftin gél Adagolás és alkalmazás
- Adagolási formák és hatáserősségek
- Ellenejavallatok
- Figyelmeztetések és óvintézkedések
- Lokális mellékhatások
- Mellékhatások
- Klinikai vizsgálatok tapasztalatai
- Marketing utáni tapasztalatok
- Especifikus népességcsoportokban történő alkalmazás
- Terhesség
- Laktáció
- GYermekeknél történő alkalmazás
- Geriátriai alkalmazás
- Naftin gél leírása
- Naftin gél – Klinikai farmakológia
- Hatásmechanizmus
- Farmakodinamika
- Farmakokinetika
- Mikrobiológia
- Non-klinikai toxikológia
- Karcinogenezis, mutagenezis, A termékenység károsodása
- Klinikai vizsgálatok
- Hogyan kapható/tárolható? és kezelés
- Betegtájékoztatás
- FÜGGŐLEGES TÁBLA – 45g tubusos kartondoboz
- FŐTÁBLA – 60 g-os tubusos doboz
- Több információ a Naftinról (naftifine topical)
- Fogyasztói források
- Szakmai források
- Más készítmények
- Kapcsolódó kezelési útmutatók
Indikációk és A Naftin gél alkalmazása
A NAFTIN ® gél egy alilamin gombaellenes szer, amely a Trichophyton rubrum szervezet által okozott interdigitális tinea pedis kezelésére javallt, Trichophyton mentagrophytes és Epidermophyton floccosum által okozott fertőzések.
Naftin gél Adagolás és alkalmazás
Naponta egyszer egy vékony réteg NAFTIN ® gélt alkalmazzon az érintett területekre és a környező egészséges bőr kb. ½ hüvelykes peremére 2 héten keresztül.
Kizárólag helyi alkalmazásra. A NAFTIN ® gél nem alkalmazható szemészeti, orális vagy intravaginális alkalmazásra.
Adagolási formák és hatáserősségek
Gél, 2%. Minden gramm 20 mg naftifin-hidrokloridot tartalmaz színtelen vagy sárga gélben.
Ellenejavallatok
Nincs.
Figyelmeztetések és óvintézkedések
Lokális mellékhatások
Ha a NAFTIN ® gél alkalmazása során irritáció vagy érzékenység alakul ki, a kezelést abba kell hagyni.
Mellékhatások
Klinikai vizsgálatok tapasztalatai
Mivel a klinikai vizsgálatokat igen eltérő körülmények között végzik, egy gyógyszer klinikai vizsgálataiban megfigyelt mellékhatások aránya nem hasonlítható össze közvetlenül egy másik gyógyszer klinikai vizsgálataiban megfigyelt arányokkal, és nem feltétlenül tükrözi a klinikai gyakorlatban megfigyelt arányokat.
Két randomizált, hatóanyag-kontrollált vizsgálatban 1143 alany kapott NAFTIN ® gélt, szemben a hatóanyaggal kezelt 571 alannyal. A vizsgálati alanyok 12 és 92 év közöttiek voltak, elsősorban férfiak (76%), és 59%-uk kaukázusi, 38%-uk fekete vagy afroamerikai és 23%-uk spanyolajkú vagy latinó volt. A vizsgálati alanyok naponta egyszer, helyileg, 2 héten keresztül kapták az érintett bőrfelületeket és a környező egészséges bőr ½ hüvelyknyi margóját fedő adagokat. A leggyakoribb mellékhatás az alkalmazás helyén jelentkező reakció volt, amely a Naftin gél karban 2%-os arányban fordult elő, míg a hordozóanyag karban 1%-os arányban. A legtöbb mellékhatás enyhe súlyosságú volt.
Egy nyílt gyermekgyógyászati farmakokinetikai és biztonságossági vizsgálatban 22, 12-17 éves, interdigitális tinea pedisben szenvedő gyermek részesült NAFTIN ® gélben. A gyermekpopulációban a mellékhatások előfordulása hasonló volt a felnőtt populációban megfigyelthez.
A kumulatív irritációs vizsgálat kimutatta, hogy a NAFTIN ® gél irritációt okozhat. Nem volt bizonyíték arra, hogy a NAFTIN ® gél egészséges bőrön kontakt szenzibilizációt, fototoxicitást vagy fotoallergén hatást okozna.
Marketing utáni tapasztalatok
Mivel ezeket a reakciókat önként jelentették egy bizonytalan méretű populációból, nem mindig lehet megbízhatóan megbecsülni a gyakoriságukat vagy megállapítani az okozati összefüggést a gyógyszer expozícióval. A naftifin-hidroklorid forgalomba hozatalt követő alkalmazása során a következő mellékhatásokat azonosították: hólyagok, égő érzés, kérgesedés, szárazság, erythema/vörösség, gyulladás, irritáció, maceráció, fájdalom, pruritus/viszketés, kiütés és duzzanat.
Especifikus népességcsoportokban történő alkalmazás
Terhesség
Rizikóösszefoglaló
A NAFTIN® Gel terhes nőknél történő alkalmazásáról nem állnak rendelkezésre olyan adatok, amelyek a súlyos születési rendellenességek, vetélés vagy az anyai vagy magzati károsodások gyógyszerrel összefüggő kockázatát értékelnék.
Az állatokon végzett reprodukciós vizsgálatokban nem észleltek káros hatást az embrió magzati fejlődésére az organogenezis időszakában orálisan beadott dózisoknál, vemhes patkányoknál a maximálisan ajánlott humán dózis (MRHD) 37-szereséig, vagy az organogenezis időszakában szubkután beadott dózisoknál, vemhes patkányoknál az MRHD 4-szereséig, vagy vemhes nyulaknál az MRHD 7-szereséig ( lásd az adatokat).
Minden terhességnél fennáll a születési rendellenesség, veszteség vagy egyéb káros kimenetelek háttérkockázata. A súlyos születési rendellenességek és vetélés becsült háttérkockázata a jelzett populációra vonatkozóan nem ismert. Az Egyesült Államok általános populációjában a klinikailag felismert terhességekben a súlyos születési rendellenességek és a vetélés becsült háttérkockázata 2-4%, illetve 15-20%.
Adatok
Adatok állatokon
Szisztémás embrió- és magzati fejlődési vizsgálatokat végeztek patkányokon és nyulakon. Az állati és emberi dózisok összehasonlítása érdekében az MRHD-t napi 4 g 2%-os gélben határozták meg (1,33 mg/kg/nap egy 60 kg-os egyén esetében).
Naftifin-hidroklorid 30, 100 és 300 mg/kg/nap orális dózisát adták vemhes nőstény patkányoknak az organogenezis időszakában. A 300 mg/kg/nap dózisig (a mg/m 2 összehasonlításon alapuló MRHD 37-szerese) nem észleltek kezeléssel összefüggő hatásokat az embriofetális toxicitásra. A naftifin-hidroklorid 10 és 30 mg/kg/nap szubkután dózisát adták be vemhes nőstény patkányoknak az organogenezis időszakában. Nem észleltek a kezeléssel összefüggő hatásokat az embrió-magzati toxicitásra 30 mg/kg/nap adagban (a mg/m 2 összehasonlításon alapuló MRHD 4-szerese). A naftifin-hidroklorid 3, 10 és 30 mg/kg/nap szubkután dózisát adták be vemhes nőstény nyulaknak az organogenezis időszakában. Nem észleltek kezeléssel összefüggő hatásokat az embriofetális toxicitásra 30 mg/kg/nap adagban (az MRHD 7-szerese mg/m 2 összehasonlítás alapján).
Patkányokon peri- és posztnatális fejlődési vizsgálatot végeztek. Naftifin-hidroklorid 30, 100 és 300 mg/kg/nap orális dózisát adták nőstény patkányoknak a 14. terhességi naptól a 21. laktációs napig. A nőstényeknél a vemhesség alatt és az utódoknál a laktáció alatt 300 mg/kg/nap (az MRHD 37-szerese mg/m 2 összehasonlítás alapján) csökkent testtömeggyarapodást észleltek. Nem észleltek fejlődési toxicitást 100 mg/kg/nap (az MRHD 12-szerese mg/m 2 összehasonlítás alapján) mellett.
Laktáció
Kockázati összefoglaló
Nem áll rendelkezésre információ a naftifin-hidroklorid jelenlétéről az emberi tejben, a hatóanyagnak a szoptatott csecsemőre gyakorolt hatásairól, vagy a Naftin gél szoptató nőknél történő helyi alkalmazását követően a hatóanyagnak a tejtermelésre gyakorolt hatásairól. Nem ismert, hogy a naftifin-hidroklorid kiválasztódik-e az emberi tejbe. Mivel számos gyógyszer kiválasztódik az emberi tejbe, óvatosságra int, ha a naftifin-hidrokloridot szoptató nőnek adják.
A szoptatás alatti klinikai adatok hiánya kizárja a Naftin Gel csecsemőre gyakorolt kockázatának egyértelmű meghatározását a szoptatás alatt. Ezért figyelembe kell venni a szoptatás fejlődési és egészségügyi előnyeit, valamint az anya Naftin Gel iránti klinikai szükségletét és a szoptatott csecsemőre a Naftin Gel vagy az anya alapbetegségéből eredő esetleges káros hatásokat.
GYermekeknél történő alkalmazás
A NAFTIN® Gel biztonságosságát és hatékonyságát a 12-18 éves korcsoportban, interdigitális tinea pedis esetén állapították meg.
A NAFTIN® gél alkalmazását ebben a korcsoportban a felnőtteken végzett megfelelő és jól kontrollált vizsgálatokból származó bizonyítékok támasztják alá, kiegészítve egy 22 ≥12 éves serdülőn végzett, nyílt címkével ellátott vizsgálat biztonságossági és PK-adataival, akik a NAFTIN® gélt körülbelül 4 g/nap adagban kapták .
A biztonságosságot és a hatékonyságot <12 éves korú gyermekbetegeknél nem állapították meg.
Geriátriai alkalmazás
A klinikai vizsgálatok során 99 (9%) 65 éves vagy idősebb alanyon alkalmazták a NAFTIN ® gélt. A biztonságosság és a hatékonyság hasonló volt, mint a fiatalabb alanyoknál tapasztaltak.
Naftin gél leírása
A NAFTIN ® gél átlátszó vagy sárga színű gél, kizárólag helyi alkalmazásra. A NAFTIN ® gél minden grammja 20 mg naftifin-hidrokloridot, szintetikus alilamin gombaellenes vegyületet tartalmaz.
Kémiailag a naftifin-hidroklorid (E)-N-cinnamil-N-metil-1-naftalen-metilamin-hidroklorid.
A molekuláris képlete C 21H 21N∙HCl, molekulatömege 323,86-os.
A naftifin-hidroklorid szerkezeti képlete :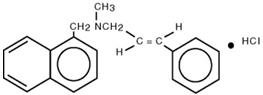
A NAFTIN ® gél a következő inaktív összetevőket tartalmazza: alkohol, benzil-alkohol, edetát-dinátrium, hidroxietil-cellulóz, tisztított víz, propilénglikol, poliszorbát 20 és trolamin.
Naftin gél – Klinikai farmakológia
Hatásmechanizmus
A NAFTIN ® gél egy helyi gombaellenes gyógyszer .
Farmakodinamika
A NAFTIN ® gél farmakodinamikáját nem állapították meg .
Farmakokinetika
In vitro és in vivo biológiai hozzáférhetőségi vizsgálatok kimutatták, hogy a naftifin elegendő koncentrációban hatol be a szarurétegbe a dermatofiták növekedésének gátlásához.
32, tinea pedisben szenvedő, 14 napon keresztül naponta egyszer mindkét lábra alkalmazott 3,9 gramm NAFTIN ® gél átlagos adagjával kezelt személy plazmamintáinak farmakokinetikai elemzése a kezelési időszak alatt megnövekedett expozíciót mutatott, amelynek geometriai átlaga (CV%) AUC 0-24 (a plazma koncentráció-idő görbe alatti terület a 0. időponttól 24 óráig) 10,5 (118) ng∙hr/ml volt az 1. napon és 70 (59) ng∙hr/ml volt az AUC 0-24 a 14. napon. Az AUC alapján számított felhalmozódási arány körülbelül 6 volt.
A maximális koncentráció (C max) szintén nőtt a kezelési időszak alatt; a C max mértani átlag (CV%) az egyszeri adagot követően 0,9 (92) ng/ml volt az 1. napon; a C max a 14. napon 3,7 (64) ng/ml volt. A T max medián 20,0 óra (tartomány: 8, 20 óra) volt az egyszeri alkalmazás után az 1. napon és 8,0 óra (tartomány: 0, 24 óra) a 14. napon. A plazma átlagkoncentrációja a vizsgálati időszak alatt emelkedett, és 11 nap után érte el az állandósult állapotot. Ugyanebben a farmakokinetikai vizsgálatban a kezelési időszak alatt a vizelettel ürülő adag frakciója az alkalmazott adag 0,01%-ánál kisebb vagy azzal egyenlő volt.
Egy második vizsgálatban a NAFTIN ® gél farmakokinetikáját 22, 12-17 éves, tinea pedisben szenvedő gyermekgyógyászati alanyon értékelték. A vizsgálati alanyokat átlagosan 4,1 gramm NAFTIN ® gél adaggal kezelték, amelyet naponta egyszer, 14 napon keresztül alkalmaztak az érintett területre. Az eredmények azt mutatták, hogy a szisztémás expozíció nőtt a kezelési időszak alatt. A geometriai átlag (CV%) AUC0-24 15,9 (212) ng∙hr/ml volt az 1. napon és 60,0 (131) ng∙hr/ml a 14. napon. Az egyszeri adagot követő Cmax geometriai átlag (CV%) 1,40 (154) ng/ml volt az 1. napon és 3,81 (154) ng/ml a 14. napon. A kezelési időszak alatt a vizelettel ürített dózis hányada az alkalmazott dózis legfeljebb 0,003%-a volt.
Mikrobiológia
Hatásmechanizmus
A naftifin egy gombaellenes szer, amely az allilaminok osztályába tartozik. Bár a gombák elleni pontos hatásmechanizmusa nem ismert, úgy tűnik, hogy a naftifin-hidroklorid a szkvalén 2,3-epoxidáz enzim gátlásával beavatkozik a szterol bioszintézisbe. Az enzimaktivitás ezen allilamin általi gátlása a szterolok, különösen az ergoszterol mennyiségének csökkenését és ennek megfelelően a szkvalén felhalmozódását eredményezi a sejtekben.
A rezisztencia mechanizmusa
A mai napig nem azonosították a naftifinnel szembeni rezisztencia mechanizmusát.
A naftifin a következő gombák legtöbb izolátumával szemben bizonyult aktívnak, mind in vitro, mind klinikai fertőzésekben, az INDIKÁCIÓK ÉS HASZNÁLATOK részben leírtak szerint:
- Trichophyton rubrum
- Trichophyton mentagrophytes
- Epidermophyton floccosum
Non-klinikai toxikológia
Karcinogenezis, mutagenezis, A termékenység károsodása
Egy 2 éves bőrkarcinogenitási vizsgálatban a naftifin-hidroklorid krémet 1%, 2% és 3%-os helyi dózisban (10, 20 és 30 mg/kg/nap naftifin-hidroklorid) adták Sprague-Dawley patkányoknak. Ebben a vizsgálatban nem észleltek gyógyszerrel összefüggő daganatokat a vizsgálatban vizsgált legmagasabb, 30 mg/kg/nap dózisig (az AUC összehasonlítás alapján az MRHD 36-szorosa).
A naftifin-hidroklorid nem mutatott mutagén vagy klasztogén potenciálra utaló jeleket két in vitro genotoxicitási vizsgálat (Ames-teszt és kínai hörcsög petefészeksejt kromoszóma-aberrációs vizsgálat) és egy in vivo genotoxicitási vizsgálat (egér csontvelő mikronukleusz vizsgálat) eredményei alapján.
A naftifin-hidroklorid orális adagolása patkányoknak a párzás, a vemhesség, a szülés és a laktáció során nem mutatott hatást a növekedésre, a termékenységre vagy a szaporodásra, 100 mg/kg/nap dózisig (az MRHD 12-szerese mg/m 2 összehasonlítás alapján).
Klinikai vizsgálatok
A NAFTIN ® gél hatékonyságát két randomizált, kettős vak, hordozószerrel kontrollált, multicentrikus vizsgálatban értékelték, amelyekben 1175, tüneteket mutató és dermatofita kultúrában pozitív interdigitális tinea pedisben szenvedő személy vett részt. Az alanyokat randomizálták, hogy NAFTIN ® gélt vagy hordozót kapjanak. Az alanyok 2 héten keresztül naponta egyszer alkalmazták a 2%-os naftifin-hidroklorid gélt vagy a hordozóanyagot a láb érintett területére. Az interdigitális tinea pedis jeleit és tüneteit (erythema, viszketés és hámlás jelenléte vagy hiánya) értékelték, és 6 héttel az első kezelés után kálium-hidroxid (KOH) vizsgálatot és dermatofita tenyésztést végeztek.
A vizsgált populáció átlagéletkora 45 év volt; 77% volt férfi; és 60% volt kaukázusi, 35% fekete vagy afroamerikai és 26% spanyol vagy latin-amerikai. A vizsgálat kezdetén az alanyoknál igazolták, hogy az interdigitális tinea pedis jelei és tünetei, pozitív KOH-vizsgálat és megerősített dermatofita tenyésztés volt. Az elsődleges hatékonysági végpont a kezelés megkezdése után 6 héttel (4 héttel az utolsó kezelés után) teljes gyógyulást mutató alanyok aránya volt. A teljes gyógyulást klinikai gyógyulásként (erythema, viszketés és hámlás hiánya) és mikológiai gyógyulásként (negatív KOH és dermatofita tenyésztés) egyaránt definiálták.
A 6. héten, négy héttel a kezelés befejezése után elért hatékonysági eredményeket az alábbi 1. táblázat tartalmazza.
| Kísérlet 1 | Kísérlet 2 | |||
|---|---|---|---|---|
| Végpont | NAFTIN ® gél, 2% N=382 n (%) |
Hordozó N=179 n (%) |
NAFTIN ® gél, 2% N=400 n (%) |
Vehicle N=213 n (%) |
| * A teljes gyógyulás a mikológiai gyógyulás és a klinikai gyógyulás összetett végpontja. A klinikai gyógyulás az erythema, a pruritus és a hámlás hiánya (0 fokozat). † A hatékony kezelés negatív KOH preparátum és negatív dermatofita tenyésztés, 0 vagy 1 fokozatú (nincs vagy csaknem nincs) erythema, hámlás és pruritus. ‡ A mikológiai gyógyulást negatív KOH-készítmény és dermatofita tenyésztés jelenti. | ||||
| Teljes gyógyulás * | 64 (17%) | 3 (2%) | 104 (26%) | 7 (3%) |
| A kezelés hatékonysága † | 207 (54%) | 11 (6%) | 203 (51%) | 15 (7%) |
| Mikológiai Gyógyítás ‡ | 250 (65%) | 25 (14%) | 235 (59%) | 22 (10%) |
Hogyan kapható/tárolható? és kezelés
Hogyan szállítjuk
A NAFTIN ® gél színtelen vagy sárga színű gél, amelyet a következő méretű, összecsukható tubusokban szállítanak:
45g – NDC 54766-772-45
60g – NDC 54766-772-60
Tárolás
Tárolja a NAFTIN ® gélt 25°C-on (77°F); 15-30°C-ig (59-86°F) megengedett.
Betegtájékoztatás
- Tájékoztassa a betegeket, hogy a NAFTIN ® gél kizárólag helyi alkalmazásra szolgál. A NAFTIN ® gél nem szemészeti, orális vagy intravaginális alkalmazásra szolgál.
- A betegeket arra kell utasítani, hogy forduljanak orvosukhoz, ha a NAFTIN ® gél alkalmazása során irritáció alakul ki.
A Sebela Pharmaceuticals Inc. forgalmazza.
645 Hembree Parkway, Suite I, Roswell, GA 30076
www.sebelapharma.com
Toll Free 1-844-732-3521
©2020 Sebela Pharmaceuticals Inc. Minden jog fenntartva.
FÜGGŐLEGES TÁBLA – 45g tubusos kartondoboz

NDC 54766-772-45
NAFTIN ®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Kizárólag helyi alkalmazásra
Nem szemészeti célra, Orális vagy intravaginális felhasználásra
45g
Kizárólag orvosi rendelésre
FŐTÁBLA – 60 g-os tubusos doboz

NDC 54766-772-60
NAFTIN®
(Naftifine Hydrochloride) gél, 2%
Sebela Pharmaceuticals Inc.
Kizárólag helyi alkalmazásra
Nem szemészeti célra, Orális vagy intravaginális felhasználásra
60g
Kizárólag orvosi rendelésre
| NAFTIN naftifin-hidroklorid gél |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
| Marketing információk | |||
| Marketing kategória | Pályázati szám vagy monográfia hivatkozási száma | Marketing kezdete | Marketing vége |
| NDA | NDA204286 | 03/01/2018 | |
Labeler – Sebela Pharmaceuticals Inc. (079104574)
| Létesítmény | |||
| Név | Adress | ID/FEI | Működés |
| DPT Laboratóriumok Kft. | 832224526 | gyártás(54766-772), elemzés(54766-772), címkézés(54766-772) | |
Több információ a Naftinról (naftifine topical)
- Mellékhatások
- Terhesség vagy szoptatás alatt
- Adagolás. Információk
- Árképzés & Kuponok
- En Español
- 3 Vélemények
- Generikus elérhetőség
- Gyógyszercsoport:
Fogyasztói források
- Betegtájékoztatás
- Naftin topikális (Korszerű olvasmány)
Szakmai források
- Receptköteles információk
- Naftifin (AHFS monográfia)
Más készítmények
- Naftin-MP topikális
Kapcsolódó kezelési útmutatók
- Tinea pedis
- Tinea corporis
- Tinea cruris
Egészségügyi záradék
Kezelési útmutató