Gli spasmi delle palpebre e del viso possono avere un impatto significativo sulla qualità della vita di un paziente, ma arrivare alla causa principale dello spasmo – può essere miochimia, blefarospasmo essenziale benigno o spasmo emifacciale – può essere una sfida per il medico. In questo articolo, forniremo consigli che possono aiutare a diagnosticare e gestire queste condizioni a volte difficili.
Una panoramica
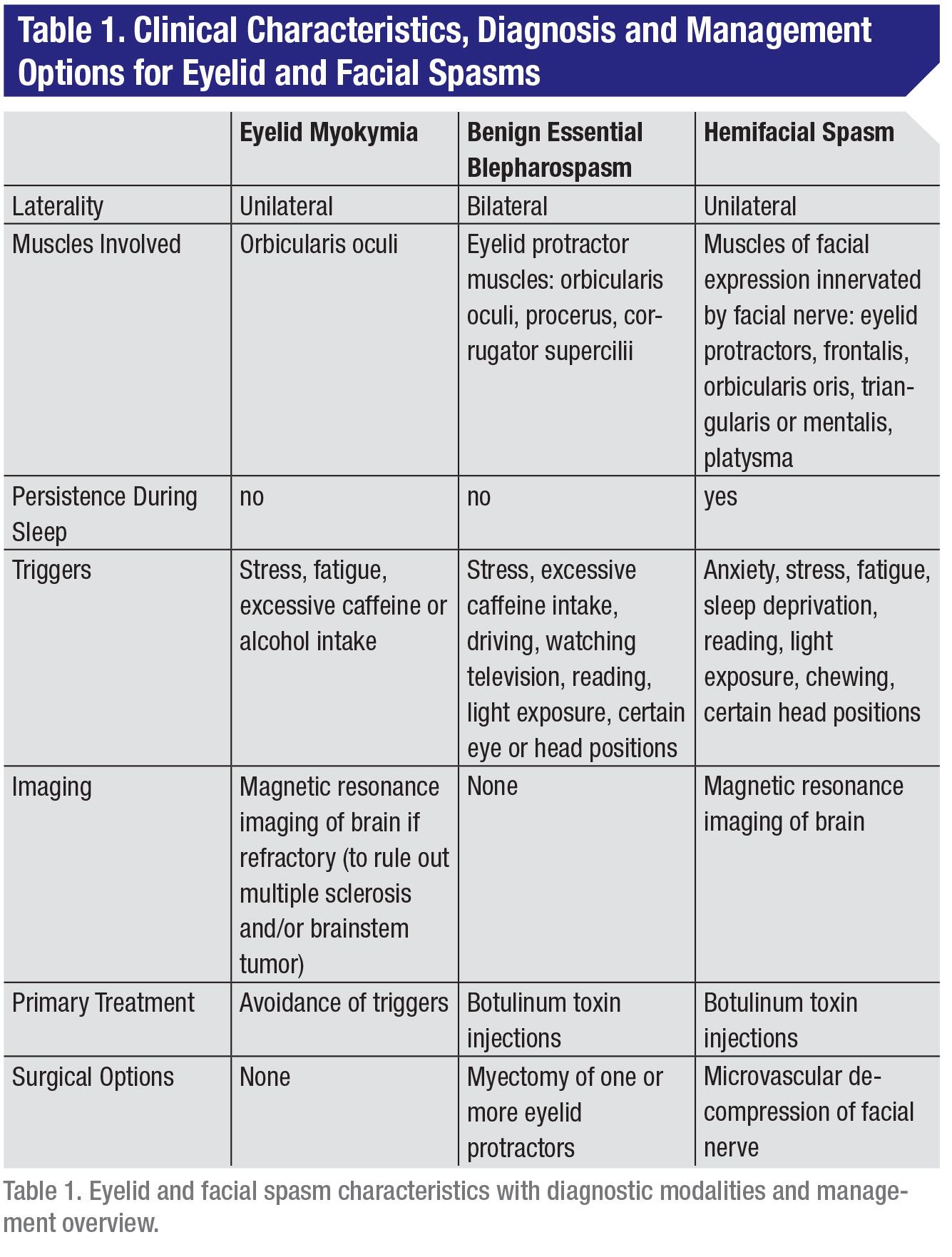
Nella pratica neurologica e oftalmica, classificati dal meno al più grave, lo spettro degli spasmi palpebrali e facciali include la miochimia palpebrale (piccole contrazioni involontarie della palpebra), il blefarospasmo essenziale benigno (spasmi involontari che causano la chiusura parziale o totale dell’occhio) e lo spasmo emifacciale (spasmi nei muscoli che controllano le espressioni del viso) (Tabella 1). Questi disturbi consistono tutti in movimenti facciali involontari che possono essere difficili da gestire per i pazienti nella vita quotidiana.
Miochimia palpebrale
Il disturbo più comune dei movimenti involontari del viso è la miochimia palpebrale. La miochimia palpebrale consiste in contrazioni involontarie, fini, continue, ondulate e non sincrone delle fibre muscolari striate dei protrattori palpebrali. In elettrofisiologia, è caratterizzata dalla scarica asincrona spontanea di unità motorie adiacenti in doppie o triple ad una frequenza di 30-70 Hertz con intervalli di 100-200 ms che separano le singole scariche.2,3 La miochimia palpebrale è considerata un processo benigno, autolimitante, unilaterale e intermittente, con la palpebra inferiore interessata più della palpebra superiore. Gli episodi sono transitori, durano da pochi giorni a poche settimane o mesi, con spasmi che si verificano a intermittenza durante il giorno fino a diverse ore alla volta.4
I fattori scatenanti includono stress, esaurimento, eccessiva assunzione di caffeina o uso di alcol, e sforzo fisico.5 L’eliminazione di questi fattori scatenanti è raccomandata come parte della gestione. La miochimia palpebrale è più comunemente isolata al muscolo orbicolare oculare, ma può diffondersi ad altri muscoli di uno o entrambi i lati del viso, nel qual caso si parla di miochimia facciale.2
La miochimia facciale è causata da danni al nucleo del nervo facciale nel ponte da malattie demielinizzanti come la sclerosi multipla o la compressione da tumori del tronco encefalico. Raramente, la miochimia palpebrale persistente è stata segnalata come un segno di presentazione della sclerosi multipla o di un tumore del tronco encefalico.3 Se la condizione è cronica, refrattaria all’eliminazione dei fattori scatenanti e colpisce la qualità della vita del paziente, le iniezioni di tossina botulinica possono avere successo nel trattamento. Il meccanismo e l’efficacia delle iniezioni di tossina botulinica sono ampiamente discussi nella sezione seguente. La persistente miochimia palpebrale refrattaria ai trattamenti di cui sopra dovrebbe far sospettare una lesione del tronco encefalico come descritto sopra e garantisce un’analisi con risonanza magnetica.
Benign Essential Blepharospasm
BEB è stato descritto per la prima volta nel 1857 come un disordine di spasmi involontari dei muscoli protrattori palpebrali che si traduce nella chiusura parziale o completa della palpebra. BEB ha un’incidenza di 1,4 a 13,3 casi per 100.000, colpisce le femmine tre volte più spesso degli uomini, e più spesso si verifica nella quinta alla settima decade di vita.7,8 BEB è più comunemente un disturbo sporadico, ma 27 per cento dei pazienti sono stati segnalati per avere un membro della famiglia con distonia, suggerendo una possibile componente genetica.1
La fisiopatologia di BEB non è ben compreso. Studi di tomografia a emissione di positroni e di risonanza magnetica funzionale hanno mostrato l’attivazione di regioni cerebrali coinvolte nel controllo e nella regolazione dei muscoli responsabili dell’ammiccamento, tra cui il talamo, lo striato, la corteccia visiva anteriore, la corteccia motoria primaria e il cervelletto superiore.7,9Gli studi sugli animali hanno dimostrato che la deplezione di dopamina nella substantia nigra diminuisce l’inibizione del riflesso trigemino dell’ammiccamento, portando a un’ipersensibilità di questo riflesso in risposta alla luce e alla secchezza.10 I fattori scatenanti della BEB includono lo stress, l’eccessiva assunzione di caffeina, guidare, guardare la televisione, leggere, luci forti, aria inquinata, vento, rumore, e certi movimenti degli occhi e della testa.11,12
La presentazione clinica della BEB consiste in spasmi involontari bilaterali di uno o più dei muscoli protrattori palpebrali tra cui i muscoli orbicolare oculi, procerus e corrugatore, con sintomi che vanno da un lieve aumento del tasso di ammiccamento alla chiusura forzata della palpebra che può portare alla cecità funzionale.1 I sintomi BEB non persistono durante il sonno ed è una condizione progressiva in cui i muscoli aggiuntivi vengono coinvolti nel tempo.7 Un sottogruppo di pazienti può sperimentare spasmi medi o inferiori del viso, una condizione denominata sindrome di Meige.1 Un ulteriore sottogruppo di pazienti può sviluppare l’aprassia dell’apertura palpebrale in cui vi è una perdita di co-inibizione tra i protrattori e i retrattori palpebrali con conseguente incapacità non paralitica di aprire le palpebre in assenza di spasmo muscolare.1
I pazienti spesso lamentano anche il sintomo sensoriale della fotofobia. I meccanismi proposti per la fotofobia includono un disturbo del dolore simpateticamente mantenuto, per il quale i blocchi dei gangli cervicali superiori hanno fornito sollievo nei rapporti precedenti.11 Ulteriori opzioni di gestione per controllare la fotofobia includono la modulazione fotocromatica con FL-41 lenti colorate o lenti a contatto sclerali con fluoresceina nel serbatoio del liquido, entrambi i quali aumentano l’intensità della luce tollerata dai pazienti BEB.13
Il trattamento di scelta per BEB è iniezioni di tossina botulinica nei muscoli protrattori palpebrali interessati. La tossina botulinica inibisce il rilascio di acetilcolina dal terminale presinaptico della giunzione neuromuscolare, bloccando la capacità del muscolo iniettato di contrarsi. Ci sono sette sierotipi di tossina botulinica (da A a G). I tipi A e B sono approvati dalla U.S. Food and Drug Administration per l’uso clinico negli Stati Uniti. OnabotulinumtoxinA (Botox) è stato approvato dalla FDA per il trattamento BEB nel 1989 ed è la formulazione più comunemente usata, anche se incobotulinumtoxinA, abobotulinumtoxinA, e rimabotulinumtoxinB sono anche autorizzati per l’uso.14 Iniezioni sono necessari circa ogni tre a quattro mesi.11 La FDA raccomanda una dose iniziale di 1.25 a 2.5 unità iniettate in ogni sito interessato con una dose massima di 15 unità e tre siti di iniezione per lato.14 Tuttavia, le indagini hanno dimostrato che i chirurghi oculoplastici tendono a trattare la BEB con una dose media iniziale di 22,5 ±9,5 unità.14
In genere, vengono iniettati da cinque a otto siti intorno a ciascun occhio, con non più di 0,1 ml di tossina botulinica iniettata in ogni sito per evitare la diffusione del farmaco nei muscoli adiacenti.12 I medici devono fare attenzione a iniettare medialmente e lateralmente quando trattano la porzione pretarso del muscolo orbicolare oculare nelle palpebre superiori, al fine di evitare l’iniezione nel muscolo levator palpebrae superioris, che può provocare ptosi. Allo stesso modo, nella palpebra inferiore, le iniezioni vengono effettuate centralmente e lateralmente per evitare l’iniezione nell’obliquo inferiore, che provocherebbe diplopia. L’incidenza degli effetti avversi delle iniezioni di tossina botulinica per i pazienti BEB è stata riportata intorno al 20%, tra cui ecchimosi nel sito di iniezione, occhio secco, lacrimazione, sensazione di corpo estraneo, lagoftalmo, diplopia e ptosi.7
Altri farmaci che sono stati utilizzati nel trattamento di BEB includono antipsicotici, antiepilettici, ansiolitici, antidepressivi, antistaminici, sedativi e stimolanti, anche se nessuno ha dimostrato di avere efficacia a lungo termine.15 In particolare, gli agonisti della dopamina e gli inibitori della captazione della dopamina hanno dimostrato di essere efficaci nel ridurre gli spasmi palpebrali, dato che la carenza di dopamina è stata implicata nella patogenesi della BEB.11 Il metilfenidato, che blocca la ricaptazione presinaptica di dopamina e norepinefrina, ha dimostrato di ridurre gli spasmi palpebrali e il punteggio di disabilità.11 I pazienti BEB hanno mostrato una risposta parziale agli agonisti dell’acido gamma-aminobutirrico come le benzodiazepine, ma il loro uso è limitato dall’effetto collaterale della sonnolenza.11
Quando BEB è refrattaria alla gestione medica o un paziente non può tollerare le iniezioni di tossina botulinica, l’intervento chirurgico con miectomia può essere considerato. Gli obiettivi primari di questa procedura sono di ridurre la gravità dello spasmo e di aumentare l’intervallo di tempo necessario tra le iniezioni di botulino.11 Nella miectomia chirurgica, uno o più dei muscoli protrattori vengono resecati. Una miectomia limitata comporta la resezione solo di una parte del muscolo orbicolare oculare nella palpebra superiore, rispetto a una miectomia estesa in cui vengono rimossi anche il corrugatore supercilii e il protrattore.15
Gli effetti avversi della chirurgia comprendono una scarsa cosmesi e la necessità di ulteriori interventi. La ricomparsa dei sintomi dopo la miectomia chirurgica è stata riportata dal 30 al 50% dei casi dopo sei mesi.12 Una procedura alternativa prevede la sezionatura del nervo facciale, che denerva efficacemente i protrattori palpebrali, ma secondariamente provoca una paralisi del nervo facciale e quindi è usata raramente.15

Spasmo emifacciale
Infine, la HFS è un disturbo unilaterale del movimento involontario del viso che comporta spasmi dei muscoli di espressione del viso innervati dal nervo facciale. L’incidenza stimata è di circa 10 casi su 100.000, sulla base di studi in Minnesota e Norvegia.16,17 La HFS tende a verificarsi nella quarta o quinta decade di vita, con le femmine colpite da due a tre volte più spesso degli uomini, e le popolazioni asiatiche più comunemente colpite rispetto ai caucasici.18 Fino a un terzo dei pazienti riferisce fattori aggravanti per la HFS, tra cui ansia, stress, fatica, privazione del sonno, lettura, esposizione alla luce, masticazione o posizioni particolari della testa.18 HFS è spesso erroneamente diagnosticata come funzionale o psicogena (nel 38 per cento dei casi), tic (nel 29 per cento) e paralisi del nervo facciale (nel 9 per cento).19 La presentazione clinica comporta spasmi iniziali dell’orbicolare oculi che gradualmente progrediscono o si diffondono nel tempo per coinvolgere altri muscoli su una metà del viso, come il frontale, orbicolare oris, triangolare o mentale, e anche il muscolo platisma.7,18 I sintomi di HFS possono persistere durante il sonno, mentre quelli di BEB non lo fanno.
La fisiopatologia della HFS comporta la compressione del nervo facciale nella sua zona di uscita delle radici (REZ) dal tronco cerebrale, che è stato descritto per la prima volta nel 1947.20 La compressione può essere causata da vasi aberranti, tra cui l’arteria cerebellare inferiore anteriore, arteria cerebellare inferiore posteriore, arteria basilare, arteria vertebrale; malformazioni arterovenose; e molto raramente da tumori come schwannomi acustici, meningiomi, tumori della ghiandola parotide e astrocitomi pilocitici.7 Mentre la diagnosi di HFS è principalmente clinica, la risonanza magnetica dovrebbe sempre essere ottenuta per escludere la compressione del nervo facciale come descritto sopra. Il test elettromiografico può anche essere effettuato per dimostrare una patognomonica risposta di diffusione laterale degli impulsi tra le fibre vicine del nervo facciale (“trasmissione ephaptic”).20
Il pilastro del trattamento per HFS sono iniezioni di tossina botulinica come descritto sopra per BEB. Per HFS, da cinque a 10 siti sono iniettati sul lato interessato del viso con dosi totali di onabotulinumtoxinA che vanno da 10 a 34 unità per trattamento.20 Il trattamento definitivo per HFS è decompressione microvascolare neurochirurgica (MVD) per alleviare la compressione del nervo facciale al suo REZ. In studi precedenti, circa il 95% dei pazienti sottoposti a MVD per la HFS ha ottenuto risultati buoni o addirittura eccellenti, con effetti avversi tra cui paralisi del nervo facciale nel 19%, deficit dell’udito nel 7% e paralisi dei nervi cranici inferiori nel 2,8%.21 Data l’invasività e i rischi associati all’intervento neurochirurgico, è della massima importanza avere una discussione franca con i pazienti riguardo ai rischi e ai benefici della MVD rispetto alle iniezioni di tossina botulinica, o una combinazione dei due, per la gestione della HFS.
Il trattamento definitivo per lo spasmo emifacciale è la decompressione microvascolare neurochirurgica (MVD) per alleviare la compressione del nervo facciale nella sua zona di uscita delle radici.
In conclusione, gli spasmi palpebrali e facciali rappresentano uno spettro di disturbi involontari del movimento facciale che possono avere un grave impatto sulla qualità della vita e sul benessere psicologico dei pazienti. Mentre nella gestione si raccomanda di evitare i fattori scatenanti, le iniezioni di tossina botulinica sono emerse come trattamento di prima linea, in particolare per BEB e HFS. La terapia chirurgica per BEB e HFS, tuttavia, può essere perseguita nei casi refrattari o nei pazienti intolleranti alle iniezioni di tossina botulinica. Data la frequente diagnosi errata di questi disturbi, è importante che i medici abbiano familiarità con i segni e i sintomi più comuni che si presentano al fine di collegare questi pazienti con neurologi o oftalmologi per ulteriori valutazioni e gestione. REVIEW
Il dottor Gervasio è uno specializzando in oftalmologia al Wills Eye Hospital. Il dottor Moster è un medico frequentatore del servizio di neuro-oftalmologia al Wills e professore di neurologia e oftalmologia alla Thomas Jefferson University di Philadelphia. È presidente di neuro-oftalmologia all’Einstein Medical Center di Philadelphia.
1. Hwang CJ, Eftekhari K. Blefarospasmo essenziale benigno: Quello che sappiamo e quello che non sappiamo. Int Ophthalmol Clin 2018;58:1:11-24.
2. Miller NR. Miochimia palpebrale. Surv Ophthalmol 2011;56:3:277-8.
3. Barmettler A, Dinkin MJ, Lelli GJ. Miochimia palpebrale: Non sempre benigna. Orbit 2011;30:6:289-90.
4. Jordan DR, Anderson RL, Thiese SM. Miochimia orbicolare intrattabile: Alternative di trattamento. Ophthalmic Surg 1989;20:4:280-3.
5. Horowitz SH. Spasmo emifacciale e miochimia facciale: Risultati elettrofisiologici. Muscle Nerve 1987;10:422-427.
6. Mackenzie W. Caso di intensa e prolungata fotofobia e blefarospasmo, alleviato dall’inalazione di cloroformio. Med Chir Trans 1857;40:175-178.
7. Ozzello DJ, Giacometti JN. Tossine botuliniche per il trattamento del blefarospasmo essenziale e dello spasmo emifacciale. Int Ophthalmol Clin 2018;58:1:49-61.
8. Bradley EA, Hodge DO, Bartley GB. Blefarospasmo essenziale benigno tra i residenti della contea di Olmsted, Minnesota, 1976-1995: Uno studio epidemiologico. Ophthal Plast Reconstr Surg 2003;19:177-181.
9. Baker RS, Andersen AH, Morecraft RJ, et al. Uno studio funzionale di risonanza magnetica in pazienti con blefarospasmo essenziale benigno. J Neuroophthalmol 2003;23:11-15.
10. Schicatano EJ, Basso MA, Evinger C. Modello animale spiega le origini della distonia cranica blefarospasmo essenziale benigna. J Neurophysiol 1997;77:2842-2846.
11. Yen MT. Sviluppi nel trattamento del blefarospasmo essenziale benigno. Curr Opin Ophthalmol 2018;29:440-44.
12. Coscarelli JM. Blefarospasmo essenziale. Semin Ophthalmol 2010;25:3:104-8.
13. Herz NL, Yen MT. Modulazione della fotofobia sensoriale nel blefarospasmo essenziale con lenti cromatiche. Oftalmologia 2005;112:2208-2211.
14. Broadbent TJ, Wesley RE, Mawn LA. Un sondaggio sugli attuali modelli di trattamento del blefarospasmo tra i chirurghi oculoplastici. Ophthalmic Plast Reconstr Surg 2016;32:1:24-7.
15. Ben Simon GJ, McCann JD. Blefarospasmo essenziale benigno. Int Ophthalmol Clin 2005;45:49-75.
16. Auger RG, Whisnant JP. Spasmo emifacciale in Rochester e Olmsted County, Minnesota, 1960 al 1984. Arch Neurol 1990;47:1233-34.
17. Nilsen B, Le KD, Dietrichs E. Prevalenza di spasmo emifacciale a Oslo, Norvegia. Neurology 2004;63:1532-33.
18. Lefaucheur JP, Daamer NB, Sangla S, Guerinel CL. Diagnosi dello spasmo emifacciale primario. Neurochiurgie 2018;64:2:82-86.
19. Martinez AR, Nunes MD, Immich ND, et al. La diagnosi errata di spasmo emifacciale è un evento frequente nel setting di cura primaria. Arq Neuropsiquiatr 2014;72:119-22.
20. Campbell E, Keedy C. Spasmo emifacciale: Una nota sull’eziologia in due casi. J Neurosurg 1947;4:342-47.
21. Huh R, Han IB, Moon JY, et al. Decompressione microvascolare per lo spasmo emifacciale: Analisi delle complicazioni operative in 1582 pazienti consecutivi. Surg Neurol 2008;69:153-57.