Review Article
Enterocutaneous Fistula: エビデンスに基づく管理
Ryan P Dumas1*, Sarah A Moore1 and Carrie A Sims2
1Department of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
2Department of Surgery, Division of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at University of Pennsylvania, Philadelphia, USA
*Corresponding authors: Ryan P Dumas, Department ofTraumatology, Surgical Critical Care& Emergency Surgery, PerelmanSchool of Medicine at the University of Pennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstract
Enterocutaneous fistula (ECF) の管理はすべての一般外科医の武装具になるべき臨床スキルである. 最終的な治療は外科的閉鎖に頼ることが多いが,術後の経過を良好にするためには術前のケアと注意が最も重要である。 これらの患者のケアは、4つの重要なフェーズに焦点を当てる必要がある。 第一段階は、適切な認識と蘇生によって特徴づけられる。 第2段階では、完全な栄養評価と計画が実施される。 第3段階では、X線写真評価によりECFの解剖学的構造を明らかにする。 このレビューでは、各段階を定義する重要な側面に焦点を当て、一般外科医が肯定的な結果を得るための機会を最大化するのに役立ちます。
Introduction
腸管瘻(ECF)の発症は、腸管と外皮間の異常接続と定義されていますが、手術と医療の両方の進歩にかかわらず、病的状態と死亡率が大幅に上昇する原因となっています。 しかし、ECFの全体的な発生率は不明であり、ECFに関するデータの大半は、大規模な施設のレトロスペクティブシリーズまたは外科医固有のシリーズという形で提供されている。 驚くべきことに、ECF全体のうち炎症性腸疾患、憩室病理、外傷、放射線、悪性腫瘍に続発するものは25%に過ぎない。 一方、ECFの75%近くは腹腔鏡もしくは開腹手術の直接的な結果であり、内視鏡手術後の瘻孔漏れはこれらの瘻孔の50%以上に関与している。 残りの瘻孔は、開腹手術や手術中の熱傷など、不慮の事故によるものである。 ECFは最も一般的には外科医が作り出した問題であるため、予防、適切な管理、計画、および最終的な治療の責任は、当然外科医にある。 さらに、ECFに起因する死亡率は5~20%であり、基礎感染や瘻孔の位置など多くの要因に左右されます。 ECF患者の主な死因は敗血症であるため、感染源のコントロールが治療の基本であることに変わりはない。 レトロスペクティブシリーズでは、死亡率は敗血症の場合で16倍、感染症がコントロールされていない場合で22倍に増加することが指摘されている。 そのため、短期間の抗菌薬投与と併せ、未排水コレクションを早期かつ確実に治療することは、転帰を著しく改善する可能性がある。 ほとんどのシリーズにおいて、死亡率は瘻孔の出力および位置と相関しているようである。 ECF管理に伴う体液、電解質、および栄養の課題を考えると、死亡率は低出力瘻孔の26%から高出力瘻孔の50%に増加する。 死亡率はまた、瘻孔の位置と相関し、より遠位にある瘻孔ほど低下する。 空腸瘻の死亡率は29%と最も高く、管理もかなり困難であるが、結腸瘻の死亡率は6%と最も低い。
生理的および心理的な範囲に及ぶ患者への影響に加え、ECFmanagementは医療資源に多大な負担をかけている。 ECF管理のコストは50万ドル以上と推定され、良好な結果を得るためには、栄養士、創傷ケア看護師、外科医からなる多職種チームが必要である。 高度の専門知識を有する治療センターの重要性は過小評価されるべきではなく、死亡率を42%から20%に著しく減少させることが示されている。
Table 1

| Anatomic | Proximal or distal | Gastric, duodenal, jejunal, Iileal, colonic |
| 生理学的 | 高出力、中出力、低出力 | 高出力>500cc/日 中出力200-500cc/日 低出力<200cc/日 |
| 病因 | Iatrogenic vs. Co. spontaneous Traumatic |
Malignant Radiation Inflammatory Bowel Disease Diverticular |
Table 1: Classification.
テーブル1
Classification.の分類は次の通りです。
表2

| FAVORABLE | UNFAVORABLE |
|---|---|
| 栄養豊富 | 栄養不足 |
| – アルブミン>3.0 | -低アルブミン、低トランスフェリン |
| 長い瘻管(>2cm) | 短い瘻管、複数、複合瘻管 |
| 二股瘻管 | 大きな腸管欠損(>1cm), 可視粘膜 |
| 低出力 | 高出力(9362>500cc/日) |
| 単体瘻孔 | 放射線照射前 |
| 腸の連続性 | 複数回の手術歴 |
| 同一施設でのインデックス手術 | 外部からの高水準手術への紹介。ボリュームセンター |
表2: ECFの予後変数
表2
ECF Prognostic Variables.
Classification
ECFの普遍的あるいは確立した分類スキームは存在しない。 瘻孔は一般的に解剖学的、生理学的、または疾患プロセスによって分類される。 瘻孔はさらに、1日の排液量によって分類することができる。 瘻孔からの滲出量を正確に記録することは、その量によって管理の変更を指示することができるため、必須である。 表1には、3つの異なる分類パラダイムが詳述されている。
Prognostic Factors for ECF
ECFの予後因子は非常によく説明されており、標準的な外科的ドグマと一致するものである。 近位で高出力の瘻孔を有する患者は、低アルブミン[ ]を伴う。 逆に、合併症がなく、外科的処置の結果であり低出力の瘻孔を有する患者は、高い自然閉鎖率でより良好な経過をたどる。 表2には、成功した転帰を予測しうる多くの変数が詳述されている。
予後を改善する要因として、施設の支援と複数の領域の専門知識の重要性は強調しすぎることはない。複数の研究により、施設の経験と量が、病的状態の低下と死亡率の改善における重要な要因であることが確認されている。 最近、カナダ腸管疾患治療学会は、「ECFベストプラクティス」勧告において9人の必須チームメンバーを特定し、多職種ケアの重要性を成文化した。
Diagnosis
イレウスと術後創感染症のthedevelopmentによって複雑にくすぶる術後経過は、ECFの前触れである。 瘻孔が疑われるか、身体検査で同定されると、放射線検査が必要な補助手段となり、全患者の97%が何らかの形で放射線評価を受ける。 造影CTスキャンは、関連する膿瘍や未排水の貯留物の存在を評価するため、不可欠である。 ソースコントロールが最適化されたら、瘻孔の解剖学的構造を定義するために、透視瘻孔造影が重要な役割を果たす。 瘻孔造影は、起始部の位置、長さの決定、遠位閉塞の有無の評価、および瘻孔が腸の他の部分と連続性を持っているかどうかの決定に役立つ。 ECFの診断が確認されたら、管理に焦点を移すべきである。
図1
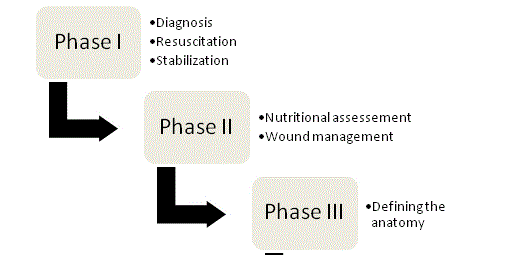
図1
ECFマネジメントの4つのフェーズ。
マネジメント
ECFマネジメントの考え方は、1964年にChapmanらによって初めて提唱され、現在でも治療の礎となっているものである。 その最初の論文で、Chapmanらは4つの重要な要素、すなわち輸液蘇生、感染源管理、排液管理、皮膚の保護を挙げている。 最近、5つ目の重要な要素として、栄養の重要性が浮上している。 ECF と新たに診断された患者の蘇生には、敗血症患者の蘇生と同じ原則が適用され、「Surviving Sepsis Campaign」の原則が枠組みとして機能します。 初期治療では、積極的な水分補給、電解質不均衡の迅速な評価と是正、および乳酸アシドーシスの正常化に重点を置く必要がある。 高出力瘻孔の患者は、初期安定化期間中の脱水と深刻な代謝不安定を避けるため、輸液、電解質および重炭酸塩の損失を静脈内補充する必要がある。
Source Control
患者が蘇生したら、ソース・コントロールを確立することに注意を向けるべきである。 前述したように、造影CTスキャンは未排水コレクションや膿瘍を特定するのに有効である。 術後の患者の場合、放射線治療によってソース・コントロールが達成される可能性が高い。 しかし、アクセスできない収集物や制御できない腹腔内膿瘍に直面した場合、手術が避けられないことがある。 腹腔内貯留物または蜂巣炎を伴う創傷感染の証拠がない限り、ECFの治療に広域スペクトル、経験的静脈内抗生物質をルーチンに使用すべきではない。 可能な限り、抗生物質は特定の培養データに的を絞って、2週間以上に制限すべきである。
Effluent Management
成功した流出水の管理は、体積状態、電解質バランス、栄養、皮膚の完全性に大きな影響を与えることがある。プロトンポンプ阻害薬の使用は、両方の目標を達成することができ、投与量は、廃液のpHが6以上になり、吐出量が1L/日未満になるまで漸増する必要がある。 サイリウムは流出液の増量と通過時間の延長に極めて有効であるが、ロペラミド、アトロピンジフェノキシレート、コデイン、アヘンチンキ、さらにはメタドンを含む抗動脈および抗分泌剤が減量の主要な手段である。 普遍的な消化管ホルモン阻害剤としてのソマトスタチンの役割を考慮し、ECF患者に対する外因性ソマトスタチンの効果を研究する多くの研究が行われてきた。 多くの無作為化比較試験があるが、サンプル数が少なく、試験デザインに一貫性がないため、重要な結論を明らかにすることは困難である。 より長持ちするソマトスタチンアナログであるオクトレオチドもまた、ECF補助薬として研究され、有望な結果を得ている。 Octreotide 100 mcgを1日3回投与すると、流出液量が減少し、いくつかの研究では自然閉鎖までの時間が短縮されることが示されている。 そのため、特に他の治療法で流出量を減少させることができなかった症例では、72時間にわたるオクトレオチド治療の試用と綿密な瘻孔出力モニタリングが正当化されるかもしれない。 一般的な副作用には、高血糖、頭痛、および胆石症がある。
低出力瘻孔は自然閉鎖の割合が高いというデータは明確であるが、出力量を減少させることで瘻孔閉鎖が改善されるというデータはあまり明確ではない。 それでも、吐出量を減らすことは、瘻孔管理の負担を大幅に軽減し、患者のウェルビーイングにプラスの影響を与える可能性があります。 腸内環境が悪化すると、皮膚が急速に破壊され、治療が困難な炎症を引き起こす可能性があります。 そのため、バリアクリーム、水分バリア、パウチング器具、吸引装置による適切な皮膚管理が最も重要である。 特に高出力瘻孔では、排水を適切に管理するために、排水管、パウチ、吸引の複雑なネットワークが必要になることが多い。 高度に専門化された創傷ケアチームと腸瘻セラピストは、創傷管理と患者の快適性の両方において非常に貴重である。
創傷と開腹の管理には陰圧療法(NPT)が広く用いられており、NPTがECFに対処する外科的手段の一部となったことは驚くにはあたらない。 これまでで最大のシリーズとして、Wainsteinらは、-350~-600mmHgの範囲の陰圧で治療した高出力瘻孔の患者91人の経験を報告している。 平均1400cc/日から138cc/日に有意に流出量を減少させたことに加え、46%の患者で自然閉鎖が達成された。2016年、MiskyらはECFにおけるNPTの使用を調査するメタ分析を発表した。 合計151人の患者を対象とした10のレトロスペクティブ研究を使用して、これらの著者らは、自然閉鎖の中央値65%(7%〜100%の範囲)、閉鎖までの中央値58日であることを発見した。 この研究者らはまた、4.4%の新しい瘻孔の発生率も報告しており、この合併症は一部の臨床医を躊躇させている。NPTがECF閉鎖率を決定的に向上させ、自然閉鎖までの時間を短縮できるかどうかを判断するには、さらなる調査が必要であることは明らかであるが、これらのドレッシングのポジティブな利点は見逃してはならないものである。 少なくとも、この技術は、流出液の制御、皮膚の保護、およびドレッシングの交換頻度の減少により、ECFの管理を容易にする可能性がある。
表3

| 研究者 機関実施 | |
|---|---|
| ホリントン | 8ヶ月 |
| エベンソン | 4ヶ月 |
| ラーボー | 12ヶ月 |
| ダッタ | 6ヶ月 |
| リンチ | 6ヶ月 |
| リ | 6 ヶ月 |
| マッキンタイア | 6 ヶ月 |
表3.リノベーションの概要 確定的な管理までのタイミング
表3
Timing to Definitive Management.
Nutrition
AssessmentECF患者の栄養状態は最も重要なことである。 ペプチドベースの経腸栄養剤および完全非経口栄養法(TPN)が登場する前は、レトロスペクティブな過去のシリーズにより、ECF患者における栄養不良の負担が強調されている。 1950年代および1960年代の患者157人のシリーズでは、近位端瘻孔を有する患者のほぼ75%が栄養不良であった。 同様の結果は、最適な栄養状態にある患者はごく少数であり、栄養状態が改善されると、ECF関連死亡率は55%から12~16%に急落することを発見したChapmanらによって報告された。 Harris-Benedict式は栄養要求量の計算の出発点として適しているが、ECF患者は異化および高代謝性であることが広く認められている。一般に、これらの患者は炭水化物および脂肪で少なくとも25~30kcal/kg/日および1.5~2gのタンパク質/kg/日のカロリーサポートを増やすことが必要である。 特に術前アルブミンは、一般外科手術後の死亡率および病的状態の最も強力な予測因子であることが示されており、低アルブミン血症は依然としてECF患者における不良転帰の重要な予測因子である 。 しかし、おそらくECFで最も研究されているタンパク質はトランスフェリンであり、140を超える値は自然閉鎖率の上昇および死亡率の低下と関連している。 窒素バランスは有用なツールであるが、高出力瘻孔を有する患者ではこの標準的な測定が困難な場合がある。 標準的なケアに反応しないより複雑な症例では、間接熱量測定などの追加検査が検討される場合がある。
非経口栄養 vs 経腸栄養
非経口栄養は、1969年にDudrickによってその使用が確立されたECFの管理で重要な役割を担っている。 「非経口栄養補給の独占的使用により、体重増加、正の窒素バランス、成長および発達が規則的に達成される」。 それ以来、TPNは「腸の安静」を促進し、廃液管理を簡略化しながら栄養を供給する手段として普遍的に採用されている。TPNはGI分泌物を30~50%減少させ、それによって脱水および電解質不均衡の発生率を低下させるが、同化転換、自然閉鎖率、死亡に対するTPNの影響について述べた無作為化試験は存在しない。 それにもかかわらず、TPNは、感染症や肝機能障害などの重大な合併症にもかかわらず、依然として人気のある長期治療法である。
しかし、最近になって、ECFにおける経腸栄養の使用は、牽引力を増してきている。 経腸栄養の使用は、TPNと比較して、コストの削減、感染の減少、および免疫機能の改善など、多くの利点がある。 さらに、カロリーの20%程度を経腸的に供給するだけでも、腸内細菌叢の維持および細菌の転座を減少させるのに役立つ。 Liらによるレトロスペクティブシリーズでは、1168人の患者の86.4%が経腸栄養で効果的に管理されている。経腸栄養は、高出力瘻孔の設定において、成分配合飼料、運動制限薬および繊維増量薬と併用することで成功することもある。 高出力瘻孔を有する335人の患者のシリーズで、Levyらは、経腸栄養を使用してコホートの85%でTPN自立を成功させることができた。 興味深いことに、経腸栄養と「腸の安静」の欠如にもかかわらず、死亡率と自然閉鎖の割合は先行シリーズと同様であった。
遠位粘膜皮膚縁を有する高出力ECFの設定において、瘻孔溶解は標準経腸栄養の重要な補助手段となり得る。 瘻孔破砕は、新生児の灌流液の再供給に由来し、成功した場合の再供給、またはECFの遠位端に留置したカテーテルによる経腸栄養の追加補給のいずれかを指すことがある。 Teubnerらは2004年、近位瘻孔を有する12人のケースシリーズで、ECFに対する治療法として瘻孔破砕を初めて報告した。 それ以来、多くの症例報告や小規模シリーズが、この手法の栄養学的有効性を実証している。 瘻孔洗浄を行わないTEN患者のマッチングコホートと比較すると、瘻孔洗浄で治療した高出力瘻孔患者は、肝機能および栄養パラメータが有意に改善されていた。 瘻孔破砕は、感染症、静脈アクセス問題、肝不全などのTPN関連合併症を発症した患者において特に有用である可能性がある。 しかし、合併症が発生する可能性があり、小腸の蠕動運動が瘻孔カテーテルを遠位thesmall bowelに進めると閉塞を含む場合があります。
ビタミンとミネラルは、ECF患者ではしばしば枯渇している。 さらに、ビタミンB12は回腸の末端50~60cmでしか吸収されないため、多くのECF患者ではビタミンB12の注射が必要かもしれない。 マグネシウムは高出力瘻孔で頻繁に浪費されるため、硫酸マグネシウムの静脈内投与または経口塩化マグネシウムで補給し、腸管吸収を改善する必要がある。 最後に、亜鉛とビタミンCの両方を大量に補充することが推奨されている。 オメガ3および魚油は集中治療環境で研究され、いくらかの効果を上げているが、これらのサプリメントはECF患者で評価されたことがなく、日常的に使用されていない。 この閉鎖率の幅は、患者集団や施設の診療パターンの違いを反映していると思われる。 瘻孔が4週間を超えて自然に閉鎖する可能性は著しく低く、2ヶ月後に閉鎖する瘻孔はわずか10%である。 ECFの自然閉鎖率は低いので、外科的介入はしばしば唯一の決定的な管理戦略である。
ECFを手術するという決定は、しかし、ECF切除後の再発率が13~34%であることから、軽々しく行うべきでない。 ECFに対する外科的介入の原則には、一般外科の中核となる考え方が多く含まれるが、おそらく考慮すべき最も重要な要因は手術に要する時間である。 Fazioらは、ECF患者をケアする際の予期管理の重要性を示した。 ECF形成後6週間未満に手術を行った場合、死亡率は20%を超えていた。 さらに、早期の手術は再発の危険性を高める可能性がある。 Lynchらのシリーズでは、ECF形成後2週間から12週間の間に手術された患者の再発率は28%であったが、12週間以上遅らせるとこの率は15%に減少した。 表3は、専門家がECFが治癒しない場合に外科的介入を検討する前に待つべき期間を示している。
外科的管理は、患者と外科医の両方が十分に投資し理解した場合にのみ行うべきである。 ECFclosureは長期の技術的に困難な症例であり、重大な合併症のリスクもある。 瘻孔の再発の36%はECF閉鎖術中に生じた損傷の結果であることを考えると、癒着剥離を通して健康な腸に不用意な損傷を与えないよう細心の注意を払う必要がある。 瘻孔のある腸の管理は、常に腸の切除と一次的な吻合を行う必要があります。 瘻孔のオーバーソーイングorwedge切除は常に高い再発率(36%対16%)をもたらす.
Conclusion
腸皮膚瘻は一般外科医が直面する最も困難なcomplicationsの一つです。 慎重かつ体系的で患者中心のアプローチを活用することで、臨床成果を最大化することができます。 ECF管理の原則は患者間で一貫しているが、瘻孔はそれぞれ独特であり、その管理は出力だけでなく、その場所や患者の併存疾患によって大きく定義される。 外科医と患者は同様に外科的閉鎖を強く望むかもしれないが、患者は少なくとも6ヶ月の非手術的管理によって最も恩恵を受けることができる。 最終的には、ECF患者の長期的なケアには、外科医によって調整されることが多い集学的治療が必要である」
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ.著『ECF患者の長期的なケア』(PHP研究所)。 腸管瘻の11年間の経験。 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Management of Enterocutaneous fistulas.腸管瘻の管理。 30年間の臨床経験。 Chin Med J (Engl)。 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE.の項参照。 腸管瘻の管理。 132例のレビュー。 1984;71:293-6.
- Soeters、PB、Ebeid、AM、Fischer、JE. 消化管瘻を有する404例のレビュー。 非経口栄養の影響。 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. 7-year experience of enterocutaneous fistula with univariate and multivariate analysis of factors associated with healing: development of a validated scoring system.The Journal of Applied Physics, 1979.9.30->Soeters PB. Colorectal Dis. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. 上部消化管瘻孔の治療の最適化。 Gut. 2001;49 Suppl 4:iv22-31.
- ロイドDA、Gabe SM、ウィンザーAC。 腸管瘻の栄養と管理. 2006;93:1045-55.
- Berry SM, Fischer JE. 腸管皮膚瘻の分類と病態生理. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. 腸管皮膚瘻の病態生理. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM.腸管皮膚瘻の病態とその治療法。 腸管瘻:治療は進歩しているか? Surgery. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Systematic management of postoperative enterocutaneous fistulas: factors related to outcomes.術後腸瘻の系統的管理:転帰に関連する要因について. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. A systematic literature review on the use of vacuum assisted closure for enterocutaneous fistula.腸瘻の真空閉鎖術の使用に関する系統的な文献調査。 Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. 消化管瘻の予後因子を決定するための多変量モデル。 J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. High-output External fistulae of the small bowel: management with continuous enteral nutrition. 1989;76:676-9.
- Lundy JB, Fischer JE. 腸管瘻患者のケアにおける歴史的展望。 また、このような患者さんへの対応として、「腸管瘻の患者さんに対する代謝的支援」についても検討しました。
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. トラウマ開腹術に合併した腸管皮膚瘻。 大きな資源的負担。 2009;75:30-2.
- Irving M, White R, Tresadern J. 3 years’ experience with an intestinal failure unit.腸瘻の3年間の経験。 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. 腸瘻: 管理の原理. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. 腸管皮膚瘻:実績のある戦略と最新情報. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al.Summary of best practice recommendations for management of enterocutaneous fistulae from the Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel.カナダの腸瘻療法の推奨事例(4018). J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. 腸管皮膚瘻の現在の管理。 消化管手術のジャーナル:消化管の手術のための社会の公式ジャーナル。 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. 腸瘻の管理。 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012.敗血症を生き抜くキャンペーン:重症敗血症と敗血症性ショックの管理に関する国際ガイドライン。 Crit Care Med。 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Role of somatostatin-14 and its analogues in the management of gastrointestinal fistulae: clinical data.消化管瘻孔の管理におけるソマトスタチン14とその類似体の役割:臨床データ。 Gut. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Treatment of high output enterocutaneous fistulas with a vacuum-compaction device.Therapeutic of the high-output enterocutaneous fistulas with a vacuum-compaction device.Therapeutic of the high-output enterocutaneous fistulas with a vacuum-compaction device. 10年間の経験。 World J Surg. 2008;32:430-5.
- Edmunds LH, Jr., Williams GM, Welch CE.(エドマンズLHジュニア、ウィリアムズGM、ウェルシュCE)。 胃腸管から発生した外瘻。 1960;152:445-71.
- ポークTM、シュワブCW.アンサージ。 腸管瘻患者の代謝・栄養サポート:3段階のアプローチ。 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF.腸瘻患者の代謝と栄養サポート:3段階のアプローチ. 術前血清アルブミン値は手術死亡率および病的状態の予測因子として:National VA Surgical Risk Studyからの結果。 Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Factors predictive of recurrence and mortality after surgical repair of enterocutaneous fistula. 消化器外科のジャーナル:消化管の手術のための社会の公式ジャーナル。 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. 栄養補給の唯一の手段としての静脈栄養は、小児の成長を支え、成人の体重減少を回復させることができるか? 肯定的な答え。 4019>
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. 重症患者における経腸栄養と非経口栄養:無作為対照試験の最新の系統的レビューとメタアナリシス. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL.を参照。 腸瘻患者の栄養補給において、瘻孔破砕は非経口栄養にうまく置き換えることができる。 手術の英国ジャーナル。 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloclysis: Case Report and literature review.邦訳は「瘻孔破裂:症例報告および文献調査」。 Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. Fistuloclysis improve liver function and nutritional status in patients with highoutput upper enteric fistula. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. 腸管瘻の管理. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. 高出力腸管皮膚瘻の外科的管理:24年間の経験。 Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Operative Surgery for Enterocutaneous Fistula.腸管瘻の外科的治療について. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW.(邦訳なし)。 腸瘻手術後の臨床的転帰と再発の予測因子。 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Outcome of 132 consecutive reconstructive operations for intestinal fistula–staged operation without primary anastomosis improved outcome in retrospective analysis.An Surg, 2004;240:825-31.All Rights Reserved. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. 外腸管瘻の管理。 Ann Surg. 1978;188:460-7.
.