最も単純な電気化学セルは、イオン伝導体によって分離され、電子伝導体によって連結された2つの電子伝導体で構成される。
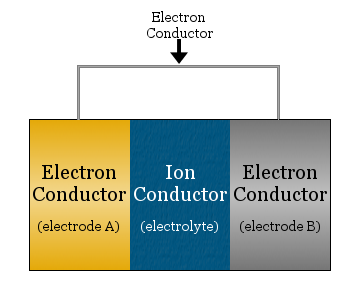
- イオン伝導体は電解質と呼ばれ、
- 電解質で隔てられた電子伝導体は電極と呼ばれる
- 電極をつなぐ電子伝導体は銅線などの金属線が多い
2種類の電池
電気化学電池にはガルバニックと電解という二つの基本型があります。
ガルバニ電池は化学的な位置エネルギーを電気エネルギーに変換する。
エネルギー変換は、電子の流れを生み出す自発的な(ΔG < 0)酸化還元反応によって達成される。
電解槽は外部の電気エネルギー源によって駆動される。
電子の流れは非自発的(ΔG ≥ 0)酸化還元反応を駆動する。
例
- 何かを動かすバッテリーはガルバニック電池の例である。
- 充電式電池は、両方のタイプの電池の例です。デバイスに電力を供給しているときはガルバニ電池として動作し、充電しているときは電解電池として動作します。
- 電解電池の例としては、水を水素と酸素に分けるために使用するものと、アルミニウム鉱石をアルミニウム金属に変換するものもあります。
- 電気を供給したり、
- 金属鉱石を金属に変換したり、
- 熱力学的データを提供したり、
酸化還元反応が別々に起こるので、
例. 電気化学セルでは、反応は別々の電極で行われ、実際、電極そのものが別の容器に入れられることもあります。
ダニールセルのエネルギー源は、金属亜鉛と硫酸銅の自然反応による硫酸亜鉛と金属銅の生成である。
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
ΔG° = -212.3.6 kJ mol-1物質を一緒にすると:
- 一つの容器で直接接触させると、化学的位置エネルギーが熱エネルギーに変換されて反応容器が温まる
- 電気化学セルでは化学的位置エネルギーが電気エネルギーに変換される
The Daniell Cell
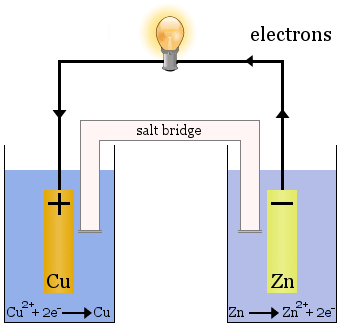
Daniell Cellは二つのハーフセルから構成されています。 一方では銅イオンが還元され、他方では亜鉛が酸化される。
セルが動作すると、一方のセルからCu2+が除去され、もう一方のセルでZn2+が生成されます。銅電極は析出したばかりの銅金属でめっきされて成長し始め、亜鉛電極は溶液中にイオンとして失われるため減少し始めるのです。両端にはフリットがあり、各半セルの溶液が混ざらないようになっているが、イオンを通して電気回路を完成させ、各半セルを電気的に中性に保つ。
駆動力は同じΔG° = -212.6 kJ mol-1です。2つの半反応を分離することで、電子は電線を通らなければならず、電気エネルギーを利用することができます。

