一般名:Phendimetrazine tartrate
Dosage Form: tablet
Medical reviewed by Drugs.com. 最終更新日:2020年6月22日
- 概要
- 副作用
- 用法用量
- プロフェッショナル
- 相互作用
- その他
Rx only
Bontril Slow Releaseは米国でブランド名が廃止されています。本剤の後発品がFDAにより承認された場合、後発品の同等品が存在する可能性があります。
Bontril Description
Phendimetrazine tartrateは、デキストロ異性体として、化学名(2S、3S)-3、4-Dimethyl-2-phenylmorpholine L-(+)-tartrate (1:1) を持っている。
構造式は:
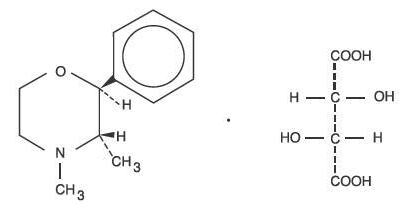
C12H17NO-C4H6O6 M.W. 341.36
Phendimetrazine tartrate は白色の無臭結晶性の粉末である。 水に自由に溶け、温アルコールにわずかに溶け、クロロホルム、アセトン、エーテル、ベンゼンに溶けない。
さらに、以下の不活性成分が存在する。 圧縮糖、製菓用糖類、D&C Yellow #10、FD&C Blue #1、FD&C Yellow #6、イソプロピルアルコール、無水乳糖、ステアリン酸マグネシウム、微結晶セルロース、Povidone、純水、Sodium Starch Glycolate(グリコール酸ナトリウム)。
Bontril – Clinical Pharmacology
Phendimetrazine tartrateは交感神経刺激アミンで、このクラスの薬剤で肥満に使われる原型、アンフェタミンに似た薬理活性を持つ。 作用としては、中枢神経刺激作用、血圧上昇作用がある。
肥満症に用いられるこのクラスの薬剤は、一般に「アノレクティック」または「アノレキシジェニック」と呼ばれる。 しかし、このような薬物の肥満治療における作用が、主として食欲抑制の作用であることは確立されていない。
食事管理を指導され、食欲抑制剤で治療された成人肥満の被験者は、比較的短期の臨床試験で決定されたように、プラセボと食事で治療された患者よりも平均して多くの体重を失う。
薬剤治療患者の体重損失の増加の大きさは、1週間にわずか1ポンドの割合で、プラセボ治療患者より大きい。 体重減少の割合は、薬物およびプラセボの被験者ともに、治療開始の最初の数週間で最大となり、その後の数週間では減少する傾向がある。 様々な薬物効果による体重減少の増加の原因については、確立されていない。 食欲不振薬の使用に伴う体重減少の量は試験ごとに異なり、体重減少の増加は、処方された薬物以外の変数、例えば治験責任医師、治療対象者、処方された食事などに一部関係していると思われる。 肥満の自然史は年単位で測定されるが、引用された研究は数週間の期間に限定されている。したがって、食事療法単独の場合に対する薬物誘発性体重減少の総影響は、臨床的に限られていると考えなければならない
排出の主要経路は腎臓で、薬物と代謝物の大部分が排泄される。 本剤の一部はフェンメトラジンに代謝され、またフェンディメトラジン-N-オキシドに代謝される。 管理された条件下で調査した場合の平均排泄半減期は、徐放型および速放型ともに約3.7時間である。 即時放出型35mgフェンディメトラジン錠剤からの薬物の吸収半減期は、延長放出型製剤からの薬物の吸収速度より、かなり速い。
ボントリールの効能・効果
Bontril®PDM (phendimetrazine tartrate) は、初期のBMIが30kg/㎡以上で、適切な体重減少療法(食事および/または運動)単独では反応しない患者のカロリー制限による体重減少レジメンにおける短期的(数週間)補助として、外因性肥満の管理に使用することが適応となっています。 以下は、様々な身長と体重に基づくボディマス指数(BMI)の表です。 BMIは、患者さんの体重(キログラム)を患者さんの身長(メートル)の2乗で割って算出されます。 メートル法による換算は、ポンド÷2.2=kg、インチ×0.0254=mです。
| BODY MASS INDEX (BMI), kg/m2 Height (feet, インチ) |
||||||
|---|---|---|---|---|---|---|
| 体重 (ポンド) |
5’0″ | 5’3″ | 5’6″5’9″ | 6’0″ | 6’3″ | |
| 140 | 27 | 25 | 23 | 21 | 19 | 18 |
| 150 | 29 | 27 | 24 | 22 | 20 | 19 |
| 160 | 31 | 28 | 26 | 24 | 22 | 20 |
| 170 | 33 | 30 | 28 | 25 | 23 | 21 |
| 180 | 35 | 32 | 29 | 27 | 25 | 23 |
| 190 | 37 | 34 | 31 | 28 | 26 | 24 |
| 200 | 39 | 36 | 32 | 30 | 27 | 25 |
| 210 | 41 | 37 | 34 | 31 | 29 | 26 |
| 220 | 43 | 39 | 36 | 33 | 30 | 28 |
| 230 | 45 | 41 | 37 | 34 | 31 | 29 |
| 240 | 47 | 43 | 39 | 36 | 33 | 30 |
| 250 | 49 | 44 | 40 | 37 | 34 | 31 |
Phendimetrazine tartrateは単独療法のみに適応されます。
禁忌
交感神経刺激薬に対する既知の過敏症または特発性反応
高度の動脈硬化症、症候性心血管系疾患、中等度および高度高血圧、甲状腺機能亢進症および緑内障
禁忌
交感神経刺激薬に対する既知の過敏症または特発性反応交感神経刺激薬に対する既知の過敏症または特発性反応禁忌
高度に神経質又は激越の患者
薬物乱用の既往のある患者
モノアミン酸化酵素阻害剤を含む他の中枢神経刺激剤を服用している患者
薬物乱用の既往のある患者。
警告
フェンジメトラジン酒石酸塩は、処方薬、市販の製剤、生薬を含む他の食欲不振剤と併用してはならない。
あるケースコントロール疫学研究において、フェンジメトラジン酒石酸塩などの食欲不振剤の使用は肺高血圧の発症リスク上昇と関連しており、まれだがしばしば致命的な疾患であることがわかった。 また、3ヶ月を超える食欲不振剤の使用は、肺高血圧症の発症リスクを23倍に増加させることが明らかになりました。
労作性呼吸困難の発現または増悪、あるいは狭心症、失神、下肢浮腫の原因不明の症状は、肺高血圧症発生の可能性を示唆しています。
フェンフルラミン、デクスフェンフルラミン等の一部の抗精神病薬の使用に関連した心臓弁膜症が報告されている。 その要因としては、長期間の使用、推奨用量以上の使用、他の拮抗薬との併用などが考えられています。
心臓弁膜症や肺高血圧症などの重篤な有害事象の潜在的リスクは、体重減少の潜在的利益に対して慎重に評価する必要があります。 フェンディメトラジン治療開始前に、既存の心臓弁膜症または肺高血圧症を検出するために、ベースラインの心臓評価を検討する必要があります。 フェンディメトラジン酒石酸塩は、既知の心雑音または心臓弁膜症がある患者には推奨されない。 治療中および治療後の心エコー図は、発生する可能性のある弁膜症の検出に有用である。 不当な露出やリスクを制限するため、酒石酸フェンディメトラジンによる治療は、患者が治療開始後4週間以内に満足のいく体重減少(すなわち、少なくとも4ポンドの体重減少、または医師と患者の判断による)を示した場合にのみ継続されるべきである<8631><690>フェンディメトラジンの食欲不振作用に対する耐性は数週間以内に発現する。
モノアミン酸化酵素阻害剤投与後14日以内にフェンディメトラジン酒石酸塩を使用すると、高血圧クリーゼを起こすことがある。
長期大量投与後の急激な投与停止により、極度の疲労と抑うつが起こる。 中枢神経系に作用するため、フェンディメトラジン酒石酸塩は機械の操作や自動車の運転などの潜在的に危険な活動に従事する患者の能力を損なうことがあるので、患者には適宜注意する。
過去1年間に何らかの食欲不振薬を使用した患者にはフェンディメトラジン酒石酸塩は推奨されない。
注意事項
軽度の高血圧患者に対してもフェンディメトラジンを処方する場合は注意すること。
糖尿病におけるインスリン必要量はフェンディメトラジン酒石酸塩および併用する食事療法に関連して変化する可能性があること。
薬物相互作用
フェンディメトラジン酒石酸塩と他の抗不安薬との併用は検討されておらず、併用により重篤な心疾患を引き起こす可能性がある。
発がん性、変異原性、生殖能力への影響
Phendimetrazine Tartrateによる発がん性、変異原性、生殖能力への影響を評価する研究は行われていない。
妊娠
妊娠カテゴリーC
Phendimetrazine tartrateによる動物の生殖研究は実施されていない。 また、酒石酸フェンディメトラジンが妊婦に投与された場合に胎児に害を及ぼすか、生殖能力に影響を及ぼすかについても不明である。
妊娠中の使用
妊娠中の安全な使用は確立されていない。 より多くの情報が得られるまで、医師の意見で潜在的な利益が潜在的な危険性を上回らない限り、フェンディメトラジン酒石酸塩は妊娠中または妊娠する可能性のある女性が服用してはならない
授乳婦
この薬が母乳中に排泄されるかどうかはわかっていない。 多くの薬剤が母乳中に排泄されるため、医師の意見により、潜在的な有益性が潜在的な危険性を上回らない限り、フェンジメトラジン酒石酸塩は授乳中の女性が服用してはならない。
小児用
小児患者における安全性および有効性は確立していない。
有害反応
循環器。 動悸、頻脈、血圧上昇、虚血性事象
フェンフルラミン、デクスフェンフルラミンなど一部の食欲不振薬の使用に伴う心臓弁膜症が、単独でも特に他の食欲不振薬と併用した場合でも報告されています。 しかし、フェンディメトラジン酒石酸塩を単独で使用した場合、この弁膜症の症例は報告されていない。
中枢神経系。 過刺激、落ち着きのなさ、不眠、激越、潮紅、振戦、発汗、眩暈、頭痛、精神状態、目のかすみ
消化器。 口の渇き、吐き気、下痢、便秘、胃痛
生殖器。
薬物の乱用と依存
規制薬物
Bontril® PDM (phendimetrazine tartrate) はスケジュールLL規制薬物です。
依存
Phendimetrazine tartrate は化学的にも薬学的にもアンフェタミンに関連します。 アンフェタミンおよび関連する覚せい剤は広範囲に乱用されており、減量プログラムの一部として薬物を含めることの望ましさを評価する際には、フェンディメトラジンの乱用の可能性を念頭に置く必要がある。 アンフェタミンおよび関連薬物の乱用は、強い心理的依存および厳しい社会的機能不全を伴うことがある。 推奨される用量の何倍にも増量した患者の報告もある。 長期大量投与後の突然の中止は、極度の疲労と精神的な落ち込みをもたらし、睡眠脳波の変化も認められる。 食欲不振薬の慢性中毒では、重度の皮膚症状、顕著な不眠、過敏性、多動性、人格変化などが現れる。
過量投与
酒石酸フェンディメトラジンの急性過量投与は、次の徴候および症状によって現れることがある:異常な落ち着きのなさ、混乱、好戦的、幻覚、およびパニック状態。 疲労と抑うつは通常、中枢神経刺激に続いて起こる。 心血管系への影響としては、不整脈、高血圧、または低血圧および循環虚脱がある。 消化器症状には、吐き気、嘔吐、下痢、および腹部痙攣が含まれます。 中毒は痙攣、昏睡、死に至ることもある。
過剰摂取の管理は、主に対症療法である。 バルビツール酸塩による鎮静も含まれる。 高血圧が顕著な場合は、硝酸塩または速効性α受容体遮断薬の使用を検討する必要がある。 血液透析または腹膜透析の経験は、その使用を推奨するには不十分である。
ボントリルの用法・用量
成人の用法・用量
1錠(35mg)を1日2回又は1日3回食前1時間前に投与する。
用量は、最小有効量で十分な効果が得られるように個人差をつける必要があります。 場合によっては、1回につき1/2錠(17.5mg)で十分なことがある。 用法・用量は1日3回、2錠を超えないこと。
ボントリールの供給方法
緑、白、黄色の3層錠で得点面に「B 35」、もう1面に「V」の文字がある。 フェンジメトラジン酒石酸塩35mgを含むボントリル®PDM錠は、100錠(NDC 0187-0497-01)および1000錠(NDC 0187-0497-02)のボトルがあります。
25℃(77°F)で保管し、15℃~30℃(59°F~86°F)まで例外的に認められています DEAオーダーフォームが必要です。
販売元:
Valeant Pharmaceuticals North America
One Enterprise
Aliso Viejo, CA 92656 USA
製造元:
Mallinckrodt,Inc.
Hobart, NY 13788
食品用インクを使用
MG #20886
Rev. 10/07
Part No. L2BB01
PRINCIPAL DISPLAY PANEL – 35 mg Tablet Bottle Label
NDC 0187-0497-02
RX Only
CIII
Bontril® PDM
(phendimetrazine tartrate tablet, USP)
35 mg
Each three layers
GREEN.LABY.LAVELPRISPAL DISPLAY PANEL – 35 mg Album Bottle Label
NDC 0287-0497-02
DISPLAY TRACKS
DISPLAY TRACKS の錠剤は35mg
のフェンディメトラジン
酒石酸塩
を含んでいる
1000
Tablets
VALEANT™
| Bontril PDM フェンディメトラジン Philips |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
ラベラー-。 ヴァリアント・ファーマスーティカルズ・インターナショナル(042230623)
| 設立 | |||
| 名前。 | 住所 | ID/FEI | 業務内容 |
| MALLINCKRODT INC | 957414238 | MANUFACTURE(0187->)0497) | |
Bontril Slow Release(フェンジメトラジン)について
- Side 効果
- 妊娠中
- 用法用量情報
- 薬剤画像
- 薬剤相互作用
- 35 レビュー
- 薬効分類: アノレキシアント
Consumer resources
- 患者情報
- ボントリル(上級リーディング)
- Bontril Slow->
- ボントリル(上級リーディング)4670リリース(上級リーディング)
専門家向けリソース
- 処方情報
- フェンジメタジン(AHFSモノグラフ)
その他のブランド フェンディークER
関連治療ガイド
- 肥満
Medical Disclaimer