Learning Objectives
- ガルバニックセルを記述するためにセル表記を使用する
- ガルバニックセルの基本コンポーネントを記述する
ボルタ電池としても知られるガルバニックセルは、自然酸化還元反応によって電気エネルギーを生成する電気化学セルです。 方程式を書く際、全体の方程式のバランスを取りやすくするため、また実際の化学変化を強調するために、酸化還元反応を半反応に分けるのが便利なことが多い。
硝酸銀の溶液にきれいな銅の金属片を入れるとどうなるか考えてみましょう(図1)。 銅の金属を加えるとすぐに銀の金属ができ始め、銅イオンが溶液の中を通過していきます。 右端の溶液が青く見えるのは、銅イオンが存在することを示す。 この反応は、2つの半反応に分けることができる。 半反応は酸化と還元に分かれるので、それぞれを個別に考えることができます。
還元半反応の式は、還元半反応で「得た」電子数と酸化半反応で「失った」電子数が等しくなるように2倍にしなければならない。

ガルバニックセルまたはボルタイックセルは、自発的な電気化学反応によって半反応が分離し(図2)、外部ワイヤに電流が流れるようにするものです。 図の左側のビーカーはハーフセルと呼ばれ、1Mの硝酸銅(II)溶液が入っていて、銅の金属片が溶液に一部浸かっています。 この銅の金属片が電極です。 銅は酸化されているので、銅の電極は陽極となります。 陽極は電圧計に針金で接続され、電圧計のもう一方の端子は銀電極に針金で接続されています。 銀は還元されているので、銀電極が陰極となります。 図の右側のハーフセルは、硝酸銀(AgNO3)の1M溶液に銀電極を入れたものです。 この時点では、回路が開いているため、電流は流れない、つまり、電線を通しての電子の大きな移動は起こりません。 回路を閉じるには、イオンを動かしながら電流を流すソルトブリッジを使う。 ソルトブリッジは、この例で使用した硝酸ナトリウム(NaNO3)溶液のような、濃厚で非反応性の電解質溶液で構成されています。 電子が電極と電線を通って左から右に流れるとき、硝酸イオン(陰イオン)は左側の多孔質プラグを通って硝酸銅(II)溶液に流れ込みます。 これにより、銅金属が酸化されて溶液中に生成した銅(II)イオンの電荷が中和され、左側のビーカー内は電気的に中性に保たれます。 同時に、硝酸イオンが左側に移動すると、ナトリウムイオン(陽イオン)は右側に移動し、多孔質の栓を通って右側の硝酸銀溶液に入ります。 この陽イオンは、銀が金属に還元される際に溶液から取り除かれる銀イオンを「置換」し、右側のビーカーを電気的に中性に保つ。 塩橋をかけなければ、電気的に中性に保たれず、大きな電流は流れない。 しかし、2つの容器が直接接触していれば、塩橋は必要ない。 回路が完成した瞬間、電圧計は+0.46 Vを示し、これは細胞電位と呼ばれます。 セル電位は、2つの異種金属を接続したときに生じるもので、酸化還元反応によって得られる単位電荷あたりのエネルギーを示す指標です。 ボルトは電位を表すSI単位です
この式で、Aは電流(アンペア)、Cは電荷(クーロム)です。 ジュール(J)単位のエネルギーを得るには、ボルトにクーロン(C)単位の電荷を掛けなければならないことに注意。 この標準的なガルバニックセルでは、半セルは分離されている。電子は外部のワイヤーを通して流れ、電気的な仕事をすることができる。
電気化学セルがこのように構築されると、正のセル電位は自然反応を示し、電子が左から右へ流れていることを意味する。
- 電子は陽極から陰極へ流れる。図の標準的なガルバニックセルでは左から右へ。
- ここで酸化が起こるので、左のハーフセルの電極は陽極である。
- 右側の半セルの電極は、ここで還元が起こるので、陰極となる。
- 陽極(図中の左側の半セル)で酸化が起こり、陰極(図中の右側の半セル)で還元が起こる。この場合、2つの半電池を作るために使用される材料の性質の違いから、+0.46Vというセル電位が生じる。
- 塩橋は回路を閉じるために存在しなければならず、電流が流れるためには酸化と還元が起こる必要がある。
考えられるガルバニック電池はたくさんあるので、通常は省略表記が使用されます。 セル表記法(セル図と呼ばれることもある)では、反応に関与するさまざまな化学種に関する情報を得ることができる。 この表記法は他の種類のセルにも使えます。 縦線│は相境界を、二重線‖はソルトブリッジを表す。 陽極の情報は左側に、陽極溶液、塩橋(存在する場合)、陰極溶液、そして最後に陰極の情報が右側に書かれています。 図2のガルバニックセルのセル表記は、
なお、スペクタクルイオンは含まず、各半反応の最も単純な形を使用した。
最も単純なセルの一つにダニエルのセルがある。 瓶の底に銅の電極を置き、硫酸銅溶液で金属を覆えば、この電池を作ることができる。 硫酸銅溶液の上に硫酸亜鉛溶液を浮かべ、硫酸亜鉛溶液の中に亜鉛の電極を置きます。 銅の電極と亜鉛の電極をつなぐと電流が流れます。
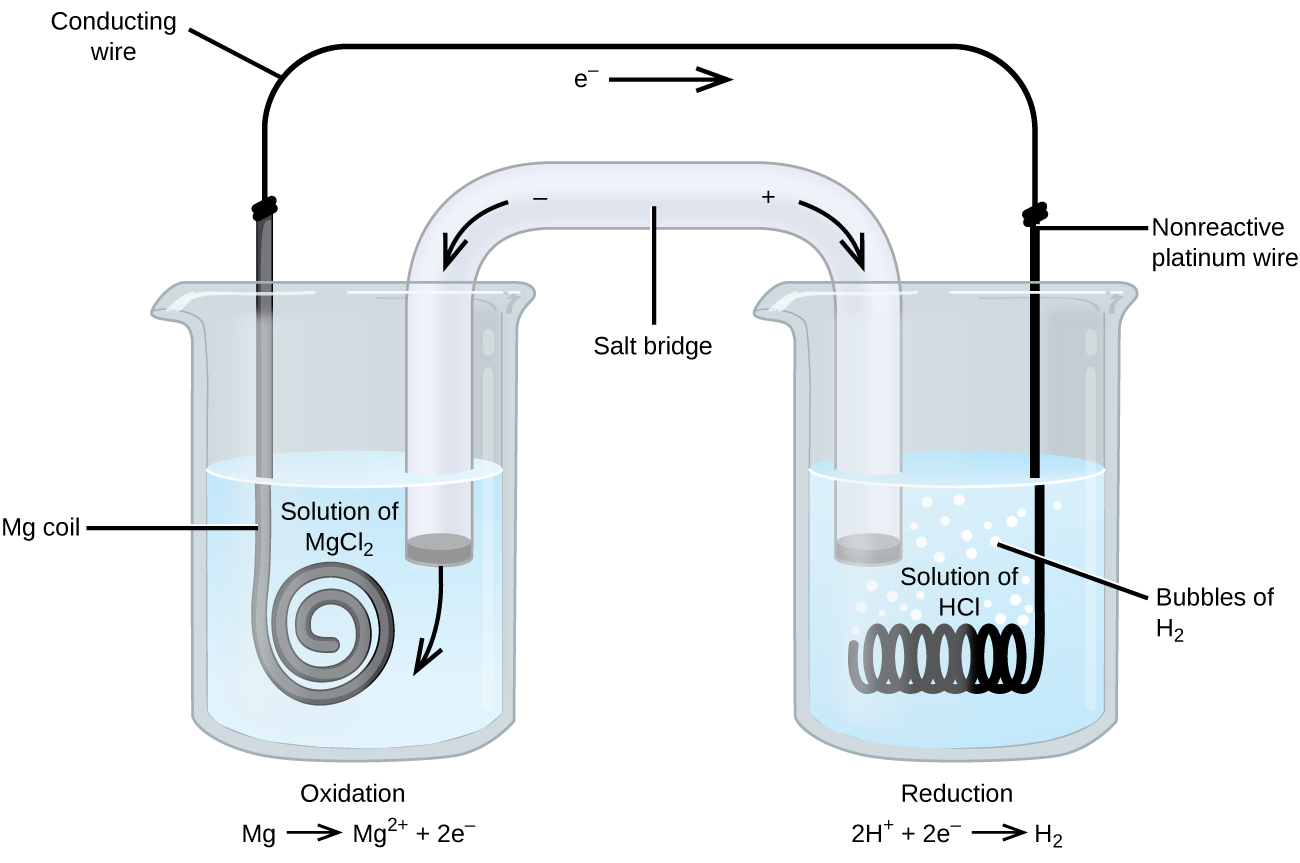
酸化還元反応には電気をよく通さない種があるので、反応に関与しない電極が使われます。 電極は白金、金、グラファイトなどが多く、これらは多くの化学反応に不活性である。 図3は、そのようなシステムの一つである。 左側の陽極ではマグネシウムが酸化され、右側の陰極では水素イオンが還元される。 この反応をまとめると
このセルでは陰極に不活性な白金線を使っていました。 となるので、セルの表記は
マグネシウム電極は酸化還元反応に加わるので活性電極と呼ばれ、マグネシウム電極は酸化還元反応に加わる。 図3の白金電極のような不活性電極は、酸化還元反応に参加せず、電流がセルに流れるように存在します。 白金や金は化学的に反応しないので、一般に不活性電極に適しています。
例題1
セルの表記法
酸化・還元半反応を書き、セル表記で反応を書きましょう。 陽極ではどの反応が起こるか? カソード?
解答
調べると、Crは3個の電子が失われてCr3+になると酸化され、Cu2+は2個の電子を得てCuになると還元されることがわかります。 電荷を平衡させると
セル表記は各式の最も単純な形式を使って、陽極での反応から始めます。 濃度は指定されなかったので \text{Cr}(s){\mid}\text{Cr}^{3+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s). 陽極では酸化が、陰極では還元が起こる。
セルの表記法
5個のtext{Fe}^{2+}(aq) \;+;\text{MnO}_4^{;-}(aq)\;+;8 text{H}^{+}(aq)\;{longrightarrow} からなるガルバニックセルを考えてみる。5text{Fe}^{3+}(aq)\;+;\text{Mn}^{2+}(aq)\;+;4thext{H}_2thext{O}(l)
酸化・還元半反応を書いて、セル表記で反応を書きなさい。 陽極ではどの反応が起こるか? カソード?
解答
調べると、Fe2+は1個の電子が失われてFe3+になると酸化され、MnO4-は5個の電子を得てMn2+になると還元されることがわかります。 電荷を平衡させると
Cell表記は各式の最も簡単な形を用い、陽極での反応から始めます。 陽極から陰極へ電子を伝導する金属が存在しないので、白金などの不活性電極を使う必要がある。 濃度は指定されていないので \text{Pt}(s){\mid}\text{Fe}^{2+}(aq)\text{,}\;\text{Fe}^{3+}(aq){\parallel}\text{MnO}_4^{\;\;-}(aq)\text{,}\;\text{H}^{+}(aq)\text{,}\;\text{Mn}^{2+}(aq){\mid}\text{Pt}(s). 陽極で酸化、陰極で還元が起こる。
Check Your Learning
銅(II)イオンが銅金属に還元され、亜鉛金属が亜鉛イオンに酸化されるガルバニ電池をセル表記で説明しなさい。
回答:
問題で与えられた情報から:
begin{array}{lr @{}longrightarrow{} l}を実行します。 \text{anode};(oxidation):}. & \text{Zn}(s) & \text{Zn}^{2+}(aq){;+;2} text{e}^{-} (酸化) \text{cathode;(reduction):}. & \text{Cu}^{2+}(aq)\;+\;2\text{e}^{-} & \text{Cu}(s) \line & \text{Zn}(s)\;+;\text{Cu}^{2+}(aq) & \text{Zn}^{2+}(aq)\;+;\text{Cu}(s) \end{array}
Using Cell Notation:
\text{Zn}(s){\mid}\text{Zn}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s).
電気化学セルは通常、2つのハーフセルから構成されています。 ハーフセルによって酸化半合成と還元半合成が分離され、外部配線に電流を流すことが可能になる。 通常、図の左側に描かれている1つの半セルは、陽極を含んでいる。 陽極で酸化が起こる。 陽極は、もう一方の半セルの陰極に接続されています(図では右側に描かれていることが多い)。 陰極では還元が起こる。 塩橋をかけると回路が完成し、電流が流れます。 塩橋の陰イオンは陽極へ、塩橋の陽イオンは陰極へ流れます。 これらのイオンの移動により回路が完成し、各半セルは電気的に中性に保たれます。 電気化学セルは、セル表記法を用いて記述することができる。 この表記法では、左側に陽極での反応に関する情報、右側に陰極での反応に関する情報が表示される。 塩橋は二重線「‖」で表される。 半セル内の固相、液相、水相は一本の線│で区切られています。 各種化学種の相と濃度は、化学種名の後に記載されています。 酸化還元反応に関与する電極を活性電極と呼びます。 酸化還元反応には関与しないが、電流を流すために存在する電極を不活性電極という。 不活性電極は、多くの化学反応で変化しない白金や金で作られていることが多い。
化学章末演習
- 次の平衡反応をセル表記で書きなさい。 必要に応じて不活性電極として白金を使用する。
(a) \text{Mg}(s)\;+\;\text{Ni}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Ni}(s)
(b) 2\text{Ag}^{+}(aq)\;+\;\text{Cu}(s)\;{\longrightarrow}\;\text{Cu}^{2+}(aq)\;+\;2\text{Ag}(s)
(c) \text{Mn}(s)\;+\;\text{Sn(NO}_3)_2(aq)\;{\longrightarrow}\;\text{Mn(NO}_3)_2(aq)\;+\;\text{Au}(s)
(d) 3\text{CuNO}_3(aq)\;+\;\text{Au(NO}_3)_3(aq)\;{\longrightarrow}\;3\text{Cu(NO}_3)_2(aq)\;+\;\text{Au}(s)
- 次のセル表記が与えられたとき、平衡反応を書かずに、酸化種、還元種、酸化剤、還元剤を決定しなさい。
(a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s)
(b) \Ίταμμα (s){mid}Text{Ni}^{2+}(aq){parallel}Text{Ag}^{+}(aq){mid}Text{Ag}(s)
- 前の問題のセルの表記についてです。 は、対応する平衡反応を書きなさい。
- 次の反応を平衡させ、その反応をセルの表記法で書きなさい。 不活性電極は半反応に含まれないので無視しなさい。
(a) \text{Al}(s)\;+\;\text{Zr}^{4+}(aq)\;{\longrightarrow}\;\text{Al}^{3+}(aq)\;+\;\text{Zr}(s)
(b) \text{Ag}^{+}(aq)\;+\;\text{NO}(g)\;{\longrightarrow}\;\text{Ag}(s)\;+\;\text{NO}_3^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(acidic\;solution)}
(c) \text{SiO}_3^{\;\;2-}(aq)\;+\;\text{Mg}(s)\;{\longrightarrow}\;\text{Si}(s)\;+\;\text{Mg(OH)}_2(s)\;\;\;\;\;\;\;\text{(basic\;solution)}
(d) \text{ClO}_3^{\;\;-}(aq)\;+\;\text{MnO}_2(s)\;{\longrightarrow}\;\text{Cl}^{\;\;-}(aq)\;+\;\text{MnO}_4^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(basic);solution)}
- 前の問題のすべての反応について、酸化種、還元種、酸化剤と還元剤を特定せよ。
- 提供された情報から、セル表記を用いて以下の系を記述せよ:
(a) 一方の半セルでは、Pt(NO3)2の溶液がPt金属を形成し、他方の半セルでは、Cu金属がすべての溶質濃度1MのCu(NO3)2溶液に入る。
(b) カソードが金電極で、0.55M Au(NO3)3 solution、アノードがマグネシウム電極で0.
(c) 半セルは1M AgNO3溶液中の銀電極からなり、もう半セルは1M Cu(NO3)2 中の銅電極を酸化する。
- 図2のようなガルバニックセルではなぜ塩橋が必要ですか。
- 酸化還元反応が進むと活性(金属)電極が質量減少していることが分かったのです。 この電極は陽極と陰極のどちらに属していたのでしょうか? 説明せよ。
- 活性電極は酸化還元反応に関与する。 金属は陽イオンを形成するので、電極の金属原子が酸化して溶液になると、電極は質量を失うことになる。 酸化は陽極で起こる。
- それぞれ異なるガルバニックセルの3種類の金属電極の質量を、それぞれのセルで酸化還元反応によって発生する電流を数分間流した前後で測定した。 Aと書かれた最初の金属電極は質量が増加し、Bと書かれた2番目の金属電極は質量が変化せず、Cと書かれた3番目の金属電極は質量が減少していることがわかった。 どの電極が活性でどの電極が不活性か、また、どの電極が陽極でどの電極が陰極か、推測してください。
Glossary
活性電極 電気化学セルの酸化還元反応に参加する電極。活性電極の質量は酸化還元反応の間に変化する 電気化学セルの陽極電極で、酸化が発生するところです。 アノードに関する情報は、セル表記の塩橋の左側に記録される カソードに関する情報は、セル表記の塩橋の右側に記録される 電気化学セルでの反応を表すセル表記の略記法 異種金属を接続したときに生じる電位差。 酸化還元反応における電荷(電流)の流れの原動力 ガルバニ電池 自発的な酸化還元反応を伴う電気化学電池。正のセル電位を持つ電気化学電池。ボルタ電池とも呼ばれる 不活性電極 電流は流すが、それ以外は電気化学電池の酸化還元反応に関与しない電極。 voltaic cell ガルバニ電池の別名
Solutions
Answers to Chemistry End of Chapter Exercises
1. (a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Ni}^{2+}(aq){\mid}\text{Ni}(s); (b) \text{Cu}(s){\mid}\text{Cu}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s); (c) \text{Mn}(s){\mid}\text{Mn}^{2+}(aq){\parallel}\text{Sn}^{2+}(aq){\mid}\text{Sn}(s); (d) \text{Pt}(s){\mid}\text{Cu}^{+}(aq)\text{,\;Cu}^{2+}(aq){\parallel}\text{Au}^{3+}(aq){\mid}\text{Au}(s)
3. (a) \text{Mg}(s)\;+\;\text{Cu}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Cu}(s); (b) 2\text{Ag}^{+}(aq)\;+\;\text{Ni}(s)\;{\longrightarrow}\;\text{Ni}^{2+}(aq)\;+\;2\text{Ag}(s)
5. 酸化される種=還元剤。 (a) Al(s); (b) NO(g); (c) Mg(s); and (d) MnO2(s); Species reduced = oxidizing agent.酸化される種は、還元剤である。 (a) Zr4+(aq); (b) Ag+(aq); (c) \text{SiO}_3^{;\;2-}(aq); (d) \text{ClO}_3^{;-}(aq)
7. 塩橋がなければ回路は開いていて(または切れて)電流が流れない。 塩橋をかけると、それぞれの半セルは電気的に中性のままであり、回路に電流を流すことができる
9. 活性(金属)電極は、酸化還元反応を進行させると質量が増加することがわかった。 その電極は陽極の一部か陰極の一部か?
説明しなさい。