一般名:ナフティフィン塩酸塩
剤形:ゲル
医薬品のレビュー Drugs.com でご覧いただけます。 最終更新日:2020年4月1日。
- 概要
- 副作用
- 用法用量
- 妊娠中
- その他
- 効能・効果 妊娠中 その他 ナフチン®ゲルの使用方法
- ナフチン®ゲルの用法・用量
- 剤形および強さ
- 禁忌
- 警告と注意
- 局所副作用
- 副作用
- 臨床試験の経験
- 市販後の使用経験
- 特定集団における使用
- 妊娠
- 授乳
- 小児使用
- 老人用
- ナフチン®ゲルの概要
- Naftin Gel – Clinical Pharmacology
- Mechanism of Action
- 薬力学
- 薬物動態
- 微生物学
- 非臨床毒性
- 発がん性、変異原性………………………….
- 臨床試験
- 供給/保管方法について
- 患者相談情報
- PRINCIPAL DISPLAY PANEL – 45g Tube Carton
- PRINCIPAL DISPLAY PANEL – 60g Tube Carton
- ナフチン(ナフチフィン外用剤)の詳細
- 消費者リソース
- 専門家向けリソース
- その他の製剤
- 関連治療ガイド
効能・効果
-
- 妊娠中
- その他 ナフチン®ゲルの使用方法
ナフチン®ゲルは、アリルアミン系抗真菌剤で、白癬菌による趾間部白癬の治療に適応を有しています。 白癬菌(Trichophyton mentagrophytes)、表皮菌(Epidermophyton floccosum)。
ナフチン®ゲルの用法・用量
1日1回、患部および周囲の健康な皮膚に約1/2インチのマージンをとって薄く塗布し、2週間使用します。
剤形および強さ
ゲル、2%。 1gあたりナフチフィン塩酸塩20mgを無色~黄色のゲルに含有する。
禁忌
なし
警告と注意
局所副作用
ナフチン®ゲルを使用して刺激または過敏症を発症したら、治療を中止してください。
副作用
臨床試験の経験
臨床試験は大きく異なる条件の下で実施されるため、ある薬剤の臨床試験で認められた副作用率は、他の薬剤の臨床試験での率と直接比較できず、臨床現場で認められた率を反映していないかもしれません。
2つの無作為化車両対照試験において、ナフチン®ゲルが1143人に、車両で571人が治療を受けました。 被験者は12~92歳で、主に男性(76%)、白人59%、黒人またはアフリカ系アメリカ人38%、ヒスパニックまたはラテン系23%でした。 被験者には、1日1回、患部とその周囲の健康な皮膚に1/2インチのマージンをとって、2週間にわたって局所投与されました。 最も一般的な副作用は、塗布部位反応であり、Naftin Gel群では2%、薬剤群では1%の割合で発生しました。 4997>
小児における薬物動態および安全性の非盲検試験において、12~17歳の趾間白癬を有する22人の小児被験者にナフチン®ゲルが投与されました。 小児における副作用の発現率は、成人における副作用の発現率と同様でした。
累積刺激性試験において、ナフチン®ゲルは刺激を引き起こす可能性があることがわかりました。
市販後の使用経験
これらの反応は、不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定することや薬剤曝露との因果関係を確立することは必ずしも可能ではありません。 ナフチフィン塩酸塩の承認後の使用において、以下の副作用が確認されています:水疱、灼熱感、痂皮、乾燥、紅斑/発赤、炎症、刺激、浸軟、疼痛、そう痒、発疹および腫脹。
特定集団における使用
妊娠
リスクの概要
妊婦におけるナフティン®ゲルの使用に関し、重大な出生異常、流産、母体または胎児の有害事象に関する薬剤関連リスクを評価できるデータは存在しない。
動物生殖試験において、妊娠ラットの最大推奨ヒト用量(MRHD)の37倍までの器官形成期に経口投与、妊娠ラットのMRHDの4倍または妊娠ウサギの7倍までの器官形成期に皮下投与しても、胚・胎児の発達に対する悪影響は見られませんでした(データ参照)
すべての妊娠には、出生異常、喪失またはその他の有害事象の背景リスクが存在します。 表示された集団の主要な出生異常および流産の推定バックグラウンドリスクは不明です。 米国の一般集団では、臨床的に認められた妊娠における重大な出生異常と流産の推定バックグラウンドリスクはそれぞれ2~4%と15~20%です。
データ
動物データ
ラットとウサギで全身性胚胎盤発達試験が実施されました。 動物とヒトの用量を比較するため、MRHDは1日4gの2%ゲル(60kgの個体で1.33mg/kg/日)に設定されている。
妊娠雌ラットに30、100、300mg/kg/日のナフチフィン塩酸塩が器官形成期に経口投与された。 300 mg/kg/day(mg/m2比較でMRHDの37倍)までの用量で、胚胎子毒性に関する処置に関連する影響は認められなかった。 妊娠雌ラットの器官形成期に塩酸ナフチフィンを10及び30 mg/kg/dayの皮下投与で投与した。 30 mg/kg/日(mg/m2比較でMRHDの4倍)で胚胎子毒性に関する処置に関連する影響は認められませんでした。 妊娠雌性ウサギに器官形成期に塩酸ナフチフィンを3,10及び30 mg/kg/dayの皮下投与したところ,3,10及び30 mg/kg/dayの皮下投与量では胚・胎児への影響は認められなかった。 30 mg/kg/日(mg/m2比較でMRHDの7倍)で胚胎子毒性に対する処置関連の影響は認められなかった。
ラットを用いた出生前後発達試験が実施された。 妊娠14日目から授乳21日目まで雌ラットに塩酸ナフチフィンを30、100及び300mg/kg/日経口投与した。 300 mg/kg/日(mg/m2換算でMRHDの37倍)で妊娠中の雌および授乳中の子の体重増加の減少が認められた。 100mg/kg/日(mg/m 2比較でMRHDの12倍)では発達毒性は認められなかった。
授乳
リスク概要
ヒト乳汁中の塩酸ナフチフィンの存在、授乳児への影響、授乳中の女性にナフチンゲルを局所適用後の乳汁分泌への影響については情報が得られていない。 ナフティフィン塩酸塩がヒトの母乳中に排泄されるかどうかは不明である。 授乳中の臨床データがないため、授乳中の乳児に対するナフチンゲルのリスクを明確に判断することはできません。 したがって、母乳育児の発達と健康上の利点は、母親のナフチンゲルの臨床的必要性、ナフチンゲルまたは母親の基礎疾患による母乳育児中の乳児への潜在的有害作用とともに考慮されるべきです。
小児使用
12歳から18歳の年齢層の趾間部足白癬で、ナフチンゲルの安全性および有効性が確立されています。
12歳未満の小児における安全性および有効性は確立していません。
老人用
臨床試験において、65歳以上の被験者99人(9%)にNaftin ® Gelが曝露されました。 安全性と有効性は若い被験者と同様でした。
ナフチン®ゲルの概要
ナフチン®ゲルは局所使用のみの透明から黄色のゲルです。 ナフチン®ゲル1gあたり、合成アリルアミン系抗真菌化合物であるナフチン塩酸塩20mgを含有しています。
化学的には、ナフチン塩酸塩は、(E)-N-Cinnamyl-N-methyl-1-napthalenemethylamine hydrochlorideで、C 21H 21N・HCl、分子式は、323.86となります。
ナフチン®ゲルの構造式は: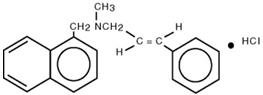
ナフチン®ゲルは次の不活性成分を含む:アルコール、ベンジルアルコール、エデト酸二ナトリウム、ヒドロキシエチルセルロース、精製水、プロピレングリコール、ポリソルベート20とトロラミン。
Naftin Gel – Clinical Pharmacology
Mechanism of Action
NAFTIN ® Gelは外用抗真菌薬です … 続きを読む
薬力学
ナフチン®ゲルの薬力学は確立されていません。
薬物動態
in vitroおよびin vivoバイオアベイラビリティ試験では、皮膚糸状菌の増殖を阻害するのに十分な濃度で角質層へ浸透することが証明されています。
平均用量3.9gのナフチン®ゲルを1日1回両足に14日間投与した足白癬患者32名の血漿サンプルの薬物動態解析では、投与期間中に曝露量が増加し、初日の幾何平均(CV%)AUC 0-24(時間0から24時間までの血漿濃度-逆行曲線下面積)が10.5(118)ng・時間/ml、14日のAUC 0-24 が70(59)ng・時間/mlであることが確認されています。 最大濃度(C max)も投与期間中に増加し,単回投与時の幾何平均(CV%)は,1日目が0.9(92)ng/mL,14日目が3.7(64)ng/mLであった。 Tmaxの中央値は、1日目の単回投与後20.0時間(範囲:8、20時間)、14日目は8.0時間(範囲:0、24時間)であった。 血漿中トラフ濃度は試験期間中に上昇し、11日後に定常状態に達した。 4997>
2番目の試験として、12~17歳の足白癬の小児患者22名を対象にナフチン®ゲルの薬物動態を評価しました。 平均4.1グラムのナフチン®ゲルを1日1回,14日間患部に塗布した。 その結果、治療期間中に全身への曝露量が増加することが確認されました。 幾何平均(CV%)AUC0-24は、初日15.9(212)ng・hr/mL、14日目60.0(131)ng・hr/mLであった。 単回投与時の幾何平均(CV%)Cmaxは、1日目1.40(154)ng/mL、14日目3.81(154)ng/mLであった。 投与期間中に尿中に排泄された割合は、投与量の0.003%以下でした。
微生物学
作用機序
ナフティフィンはアリルアミン系に属する抗真菌剤です。 真菌に対する正確な作用機序は不明ですが、ナフティフィン塩酸塩はスクアレン2、3-エポキシダーゼという酵素を阻害することでステロール生合成を妨害すると考えられています。 このアリルアミンによる酵素活性の阻害により、ステロール、特にエルゴステロールの量が減少し、それに伴い細胞内にスクアレンが蓄積する。
耐性メカニズム
現在までに、ナフティフィンに対する耐性メカニズムは特定されていない。
ナフティフィンは、「効能・効果」の項に記載されているように、in vitroおよび臨床感染症において、以下の真菌のほとんどの分離株に対して有効であることが示されている。
- Trichophyton rubrum
- Trichophyton mentagrophytes
- Epidermophyton floccosum
非臨床毒性
発がん性、変異原性………………………….
2年間の皮膚がん原性試験において、ナフティフィン塩酸塩クリームを1%、2%、3%の局所投与量(ナフティフィン塩酸塩10、20、30mg/kg/日)でSprague-Dawleyラットに投与しました。 本試験で評価した最高用量の30 mg/kg/日(AUC比較でMRHDの36倍)までは薬物関連腫瘍は認められなかった。
ナフチフィン塩酸塩では、2つのin vitro遺伝毒性試験(Ames assayおよびChinese hamster ovary cell chromosome aberration assay)および1つのin vivo遺伝毒性試験(マウス骨髄小核測定)の結果から変異原性およびクラストジェニック潜在性が認められないとされました。
ラットに塩酸ナフチフィンを経口投与し、交配、妊娠、分娩、授乳期を通じて、100mg/kg/日(mg/m 2比較でMRHDの12倍)までの用量で、成長、受胎能力、生殖に影響を及ぼさないことが示されました。
臨床試験
NAFTIN ® Gelは、有症状で皮膚糸状菌培養陽性の趾間部白癬の1175人を対象とした2つの無作為化二重盲検、車両対照、多施設試験で有効性が評価されました。 被験者は、ナフチン®ゲルまたはビヒクルの投与に無作為に割り付けられました。 被験者は1日1回、ナフチン塩酸塩ゲル2%またはビヒクルを2週間にわたって足の患部に塗布しました。 趾間白癬の徴候および症状(紅斑、そう痒、鱗屑の有無)を評価し、最初の治療から6週間後に水酸化カリウム(KOH)検査および皮膚糸状菌の培養を実施しました。 ベースライン時に、被験者は趾間白癬の徴候と症状、KOH検査陽性、皮膚糸状菌の培養が確認されたことが確認された。 有効性の主要評価項目は、治療開始後6週間(最終治療から4週間)時点で、完全治癒した被験者の割合とした。 4997>
投与終了から4週間後の6週目における有効性の結果を以下の表1に示します。 ナフチン®ゲル投与後6週目に完全治癒、有効治療、菌学的治癒を示した被験者数(%)(フル解析セット、欠測値は治療失敗として扱う)
N=382
n (%)
N=179
n (%)
N=400
n (%)
N=213
n (%)
供給/保管方法について
ナフチン®ゲルは、無色から黄色のゲルで、以下のサイズの折りたたみ式チューブに入っています。
45g – NDC 54766-772-45
60g – NDC 54766-772-60
貯蔵
25℃で貯蔵し、15~30℃の範囲で使用可能です。
患者相談情報
- ナフチン®ゲルは外用のみであることを患者さんにお伝えください。
- ナフチン®ゲルの使用により炎症が生じた場合は、医師に連絡するよう患者に指導してください。
販売元:セベラファーマシューティカルズ株式会社
645 Hembree Parkway, Suite I, Roswell, GA 30076
www.sebelapharma.com
Toll Free 1-844-732-3521
©2020 Sebela Pharmaceuticals Inc. All rights reserved.
PRINCIPAL DISPLAY PANEL – 45g Tube Carton

NDC 54766-772-45
NAFTIN ®
(Naftifine Hydrochloride) Gel, 2%
Sebela製薬株式会社Sebela Pharmaceuticals, Inc.
For Topical Use Only
Not for Ophthalmic,
45g
Rx Only
PRINCIPAL DISPLAY PANEL – 60g Tube Carton

NDC 54766-772-60
NAFTIN®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
外用のみ
眼科用ではありません。 経口・膣内用
60g
Rx Only
| ナフティン ナフティフィン塩酸ゲル |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||