Stabiliteit van carbokatie-tussenproducten
We weten dat de snelheidslimiterende stap van een SN1-reactie de eerste stap is – de vorming van dit carbokatie-tussenproduct. De snelheid van deze stap – en dus de snelheid van de totale substitutiereactie – hangt af van de activeringsenergie voor het proces waarbij de binding tussen de koolstof en de vertrekkende groep breekt en een carbokation wordt gevormd. Volgens het postulaat van Hammond (§ 6.2B) zal deze eerste bindingsbrekingsstap sneller verlopen naarmate het carbokation-tussenproduct stabieler is. Met andere woorden, de waarschijnlijkheid dat een nucleofiele substitutiereactie verloopt via een dissociatief (SN1) mechanisme hangt in hoge mate af van de stabiliteit van het carbokation intermediair dat zich vormt.
De kritische vraag wordt nu, wat stabiliseert een carbokation?
Dus als er een elektrononttrekkende groep nodig is om een negatieve lading te stabiliseren, wat stabiliseert dan een positieve lading? Een elektronendonerende groep!
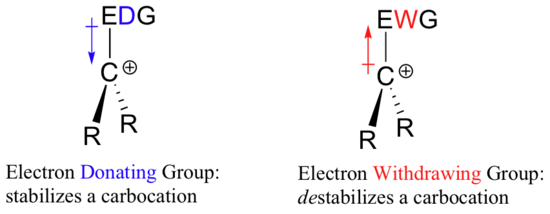
Een positief geladen stof zoals een carbokation is zeer elektronenarm, en dus zal alles wat elektronendichtheid doneert aan het centrum van elektronenarmoede, helpen om het te stabiliseren. Omgekeerd zal een carbokation worden gedestabiliseerd door een elektron-terugtrekkende groep.
Alkylgroepen – methyl, ethyl, en dergelijke – zijn zwakke elektron-donerende groepen, en stabiliseren dus nabijgelegen carbokationen. Dit betekent dat meer gesubstitueerde carbokeringen in het algemeen stabieler zijn: een tert-butylcarbokering is bijvoorbeeld stabieler dan een isopropylcarbokering. Primaire carbokeringen zijn zeer onstabiel en worden niet vaak waargenomen als tussenproducten van reacties; methylcarbokeringen zijn nog minder stabiel.
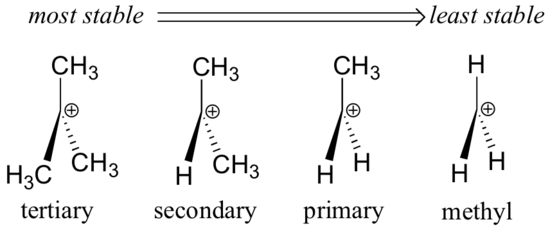
Alkylgroepen zijn elektronendonerend en carbokeringsstabiliserend, omdat de elektronen rond de naburige koolstofatomen naar de nabije positieve lading worden getrokken, waardoor de elektronenarmoede van de positief geladen koolstof enigszins wordt verminderd.
Het is echter niet juist om te zeggen dat carbokaties met meer substitutie altijd stabieler zijn dan die met minder substitutie. Net zoals elektron-donerende groepen een carbokation kunnen stabiliseren, werken elektron-onttrekkende groepen om carbokationen te destabiliseren. Carbonylgroepen zijn elektronenonttrekkend door inductieve effecten, als gevolg van de polariteit van de dubbele binding C=O. Het is mogelijk om in het laboratorium aan te tonen (zie paragraaf 16.1D) dat carbokation A hieronder stabieler is dan carbokation B, ook al is A een primaire carbokation en B een secundaire.
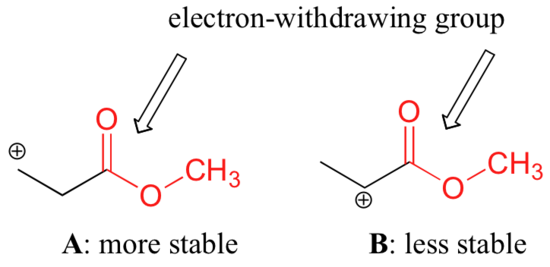
Het verschil in stabiliteit kan worden verklaard door te kijken naar het elektrononttrekkende inductieve effect van het estercarbonyl. Bedenk dat inductieve effecten – ongeacht of ze elektronen onttrekken of afstaan – worden doorgegeven via covalente bindingen en dat de sterkte van het effect snel afneemt naarmate het aantal tussenliggende bindingen toeneemt. Met andere woorden, het effect neemt af met de afstand. In species B is de positieve lading dichter bij de carbonylgroep, zodat het destabiliserende elektron-onttrekkende effect sterker is dan in species A.
In het volgende hoofdstuk zullen we zien hoe het carbokation-destabiliserende effect van elektron-onttrekkende fluorsubstituenten kan worden gebruikt in experimenten die zijn ontworpen om de vraag te beantwoorden of een biochemische nucleofiele substitutiereactie SN1 of SN2 is.
Stabilisatie van een carbokation kan ook plaatsvinden door middel van resonantie-effecten, en zoals wij reeds in het hoofdstuk over zuur-base hebben besproken, zijn resonantie-effecten in het algemeen krachtiger dan inductieve effecten. Beschouw het eenvoudige geval van een benzylisch carbokation:
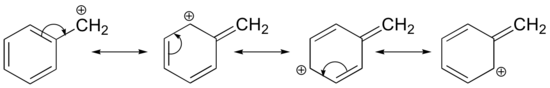
Dit carbokation is relatief stabiel. In dit geval is elektronendonatie een resonantie-effect. Er kunnen drie extra resonantiestructuren worden getekend voor dit carbokation, waarbij de positieve lading zich op een van de drie aromatische carbons bevindt. De positieve lading is niet geïsoleerd op de benzylkoolstof, maar is gedelokaliseerd rond de aromatische structuur: deze delokalisatie van lading resulteert in significante stabilisatie. Als gevolg hiervan zijn benzyl- en allylkoolstofcarbocaties (waarbij de positief geladen koolstof is geconjugeerd met een of meer niet-aromatische dubbele bindingen) aanzienlijk stabieler dan zelfs tertiaire alkylcarbocaties.
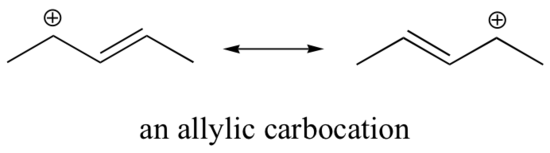
Omdat heteroatomen zoals zuurstof en stikstof elektronegatiever zijn dan koolstof, zou je verwachten dat ze per definitie elektronenonttrekkende groepen zijn die carbocaties destabiliseren. In feite is vaak het tegendeel waar: als het zuurstof- of stikstofatoom zich op de juiste plaats bevindt, is het algemene effect een stabilisatie van de carbokationen. Dit komt doordat deze heteroatomen weliswaar elektron-onttrekkende groepen zijn door inductie, maar elektron-donerende groepen zijn door resonantie, en het is dit resonantie-effect dat krachtiger is. (We zijn ditzelfde idee eerder tegengekomen bij de beschouwing van de relatieve zuurgraad en basischgraad van fenolen en aromatische aminen in paragraaf 7.4). Beschouw de twee paren carbokation-soorten hieronder:
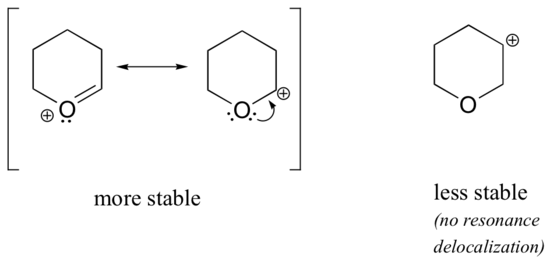
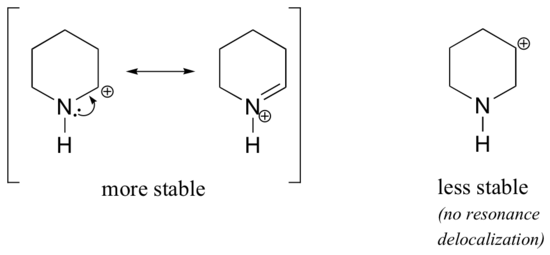
In de stabielere carbokationen fungeert het heteroatoom als een elektron-donerende groep door resonantie: in feite is het lone paar op het heteroatoom beschikbaar om de positieve lading te delokaliseren. In de minder stabiele carbokationen is de positief geladen koolstof meer dan één binding verwijderd van het heteroatoom, en zijn er dus geen resonantie-effecten mogelijk. In feite destabiliseren de heteroatomen in deze carbokation-soorten de positieve lading, omdat zij elektronen onttrekken door inductie.
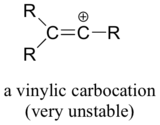
Ten slotte zijn vinylic carbokationen, waarbij de positieve lading zich op een dubbelgebonden koolstof bevindt, zeer onstabiel en het is dus onwaarschijnlijk dat ze zich als tussenproduct in een reactie vormen.
Voorbeeld 7.9.1
In welke van de onderstaande structuren zal het carbokation naar verwachting stabieler zijn? Leg uit.
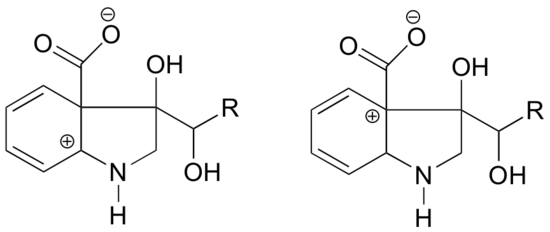
Antwoord
In de linker carbokok bevindt de positieve lading zich op een zodanige plaats ten opzichte van de stikstof dat het eenzame elektronenpaar op de stikstof kan worden gedoneerd om de lege orbitaal te vullen. Dit is niet mogelijk voor de carbokation-soort rechts.
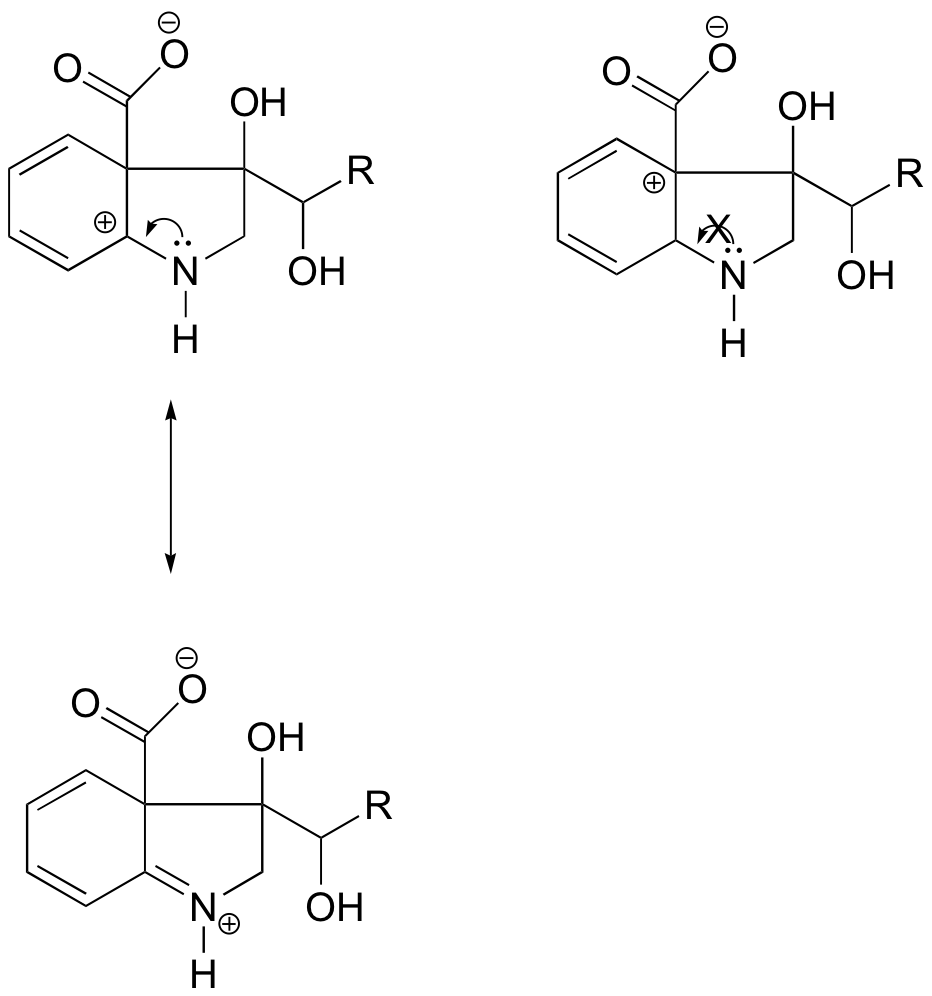
Voor het grootste deel zijn carbokationen zeer hoogenergetische, voorbijgaande tussensoorten in organische reacties. Er zijn echter enkele ongebruikelijke voorbeelden van zeer stabiele carbokationen die de vorm van organische zouten aannemen. Kristalviolet is de gebruikelijke naam voor het chloridezout van het carbokation waarvan de structuur hieronder is weergegeven. Let op de structurele mogelijkheden voor uitgebreide resonantiedelokalisatie van de positieve lading, en de aanwezigheid van drie elektron-donerende aminegroepen.
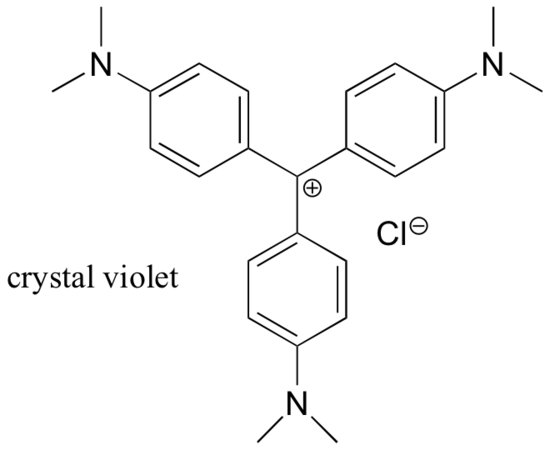
Voorbeeld 7.9.2
Teken een resonantiestructuur van het kristalviolet kation waarin de positieve lading is gedelokaliseerd naar een van de stikstofatomen.
Antwoord 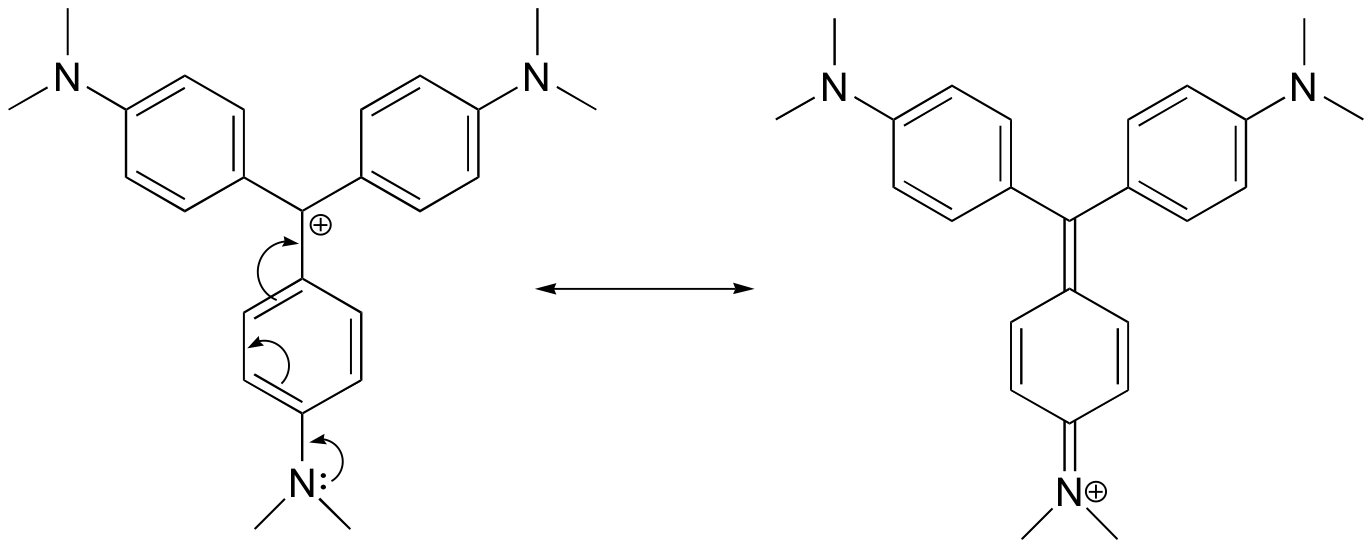
Wanneer men de mogelijkheid overweegt dat een nucleofiele substitutiereactie verloopt via een SN1-route, is het van cruciaal belang om de stabiliteit van het hypothetische carbokation intermediair te evalueren. Als dit tussenproduct niet voldoende stabiel is, moet een SN1-mechanisme als onwaarschijnlijk worden beschouwd, en verloopt de reactie waarschijnlijk via een SN2-mechanisme. In het volgende hoofdstuk zullen we verschillende voorbeelden zien van biologisch belangrijke SN1-reacties waarbij het positief geladen tussenproduct wordt gestabiliseerd door inductieve en resonantie-effecten die inherent zijn aan zijn eigen moleculaire structuur.
Voorbeeld 7.9.3
Stel vast welk carbokation in elk van onderstaande paren stabieler is, of dat verwacht wordt dat ze ongeveer gelijk zijn. Leg uw redenering uit.
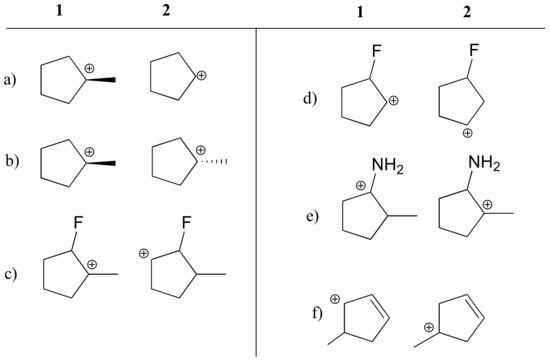
Antwoord
a) 1 (tertiair vs. secundair carbokation)
b) gelijk
c) 1 (tertiair vs. secundair carbokation)
c) 1 (tertiair vs. secundair carbokation)
. secundaire carbokatie)
d) 2 (positieve lading komt verder van elektrononttrekkende fluorine)
e) 1 (eenzame paar op stikstof kan elektronen afstaan door resonantie)
f) 1 (allylische carbokatie – positieve lading kan worden gedelokaliseerd naar een tweede koolstof)