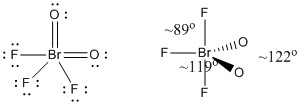Intermediate Inorganic Chemistry
University of Rhode Island
Fall 2013
Exam 1
1. Schrijf de elektronenconfiguratie (met behulp van zeldzame gasnotatie voor gesloten schillen) en het Term-symbool van de grondtoestand voor het volgende: a) Sc; b) Sc+; c) Sc2+; d) Sc3+; e) Sc-.
a) Sc
4s23d1
Alleen het 3d elektron draagt bij aan het termsymbool: L = 2 en S = ½ geeft 2D
b) Sc+
3d2
L = 3 en S = 1 geeft 3F
c) Sc2+
3d1
L = 2 en S = ½ geeft 2D
d) Sc3+
L = 0 en S = 0 waardoor 1S
d) Sc-
4s23d2
L = 3 en S = 1 waardoor 3F
>
2. Schrijf de Lewis-puntstructuur, geef de formele ladingen op alle atomen, voorspel de moleculaire geometrie, maak een schatting van alle bindingshoeken, en geef de waarschijnlijke hybride orbitaal voor het volgende: a) BrO2-; b) BrO3-; c) BrO2F3.
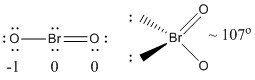
a) BrO2-
Lewisstructuur:
Formale ladingen zijn gegeven op de Lewisstructuur
Structuur: gebogen planair met een bindingshoek van ~107°
Hybride orbitaal op Br: sp3
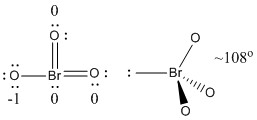
b) BrO3-
Lewisstructuur:
Formale ladingen staan op de Lewisstructuur
Structuur: piramidaal met bindingshoeken O-Br-O ~108°
Hybride orbitaal op Br: sp3
c) BrO2F3
Lewisstructuur:
Formale ladingen zijn gegeven op de Lewisstructuur
Structuur: trigonale bipyramidale met bindingshoeken zoals aangegeven in de figuur
Hybride orbitaal op Br: dsp3
3. De absolute hardheid van een atoom is gedefinieerd als η = ½(IP – EA), waarbij IP de ionisatiepotentiaal is en EA de elektronenaffiniteit. Voorspel de periodieke ontwikkeling van η en geef een redenering voor je voorspelling.
Voor bijna alle atomen geldt dat IP >> EA, dus η zal de periodieke trends van IP volgen: toenemend naarmate men rechts van het periodiek systeem komt (volgens Z*) en licht afnemend naarmate men lager van het periodiek systeem komt naarmate de atoomstraal toeneemt.
4. Cr2 heeft een elektronenconfiguratie van σ2π4δ4δ*2. Wat is de bindingsvolgorde en hoeveel ongepaarde spins worden voorspeld? Zou je verwachten dat Cr2 licht absorbeert in het zichtbare gebied van het spectrum? Waarom wel of niet?
De bindingsvolgorde = ½(2 + 4 + 4 – 2) = 4 met 2 ongepaarde spins (omdat er 2 δ-banen zijn, moeten er ook 2 δ*-banen zijn, die elk één elektron hebben volgens de regels van Hund). De zij-aan-zij overlapping van d-banen om δ-banen te vormen is slecht zodat de splitsing tussen de δ- en δ*-banen klein zal zijn. Dit suggereert dat de energie die nodig is om een elektron van de HOMO naar de LUMO te verplaatsen ook klein is, hetgeen een absorptie in het zichtbare deel van het spectrum voorspelt.