1. Een 65-jarige blanke mannelijke gedetineerde meldde zich bij de oogkliniek van een staatsgevangenis met de klacht dat hij “bugs” in zijn linkeroog zag. Dit was al ongeveer drie weken aan de gang; hij ontkende fotopsie. De systemische voorgeschiedenis van de patiënt was veelzeggend: hypertensie, hartproblemen (hij had twee klepvervangingen ondergaan) en diabetes type 2, die onder controle werd gehouden met orale medicatie.
De ooggeschiedenis van de patiënt vermeldde “langdurige” blindheid van zijn rechteroog.
Bij navraag over deze langdurige blindheid kwamen we te weten dat de patiënt 15 jaar eerder een netvliesspecialist had bezocht, die hem had verteld dat hij een “sproet” in zijn oog had. Hij meldde dat hij ongeveer 10 jaar geleden zijn gezichtsvermogen in het rechteroog had verloren, maar dat hij sinds dat bezoek van 15 jaar geleden geen specialist meer had gezien.
Diagnostische gegevens
Bij onderzoek was de gezichtsscherpte van de patiënt alleen licht waarneming O.D., en 20/25 O.S. De pupillen waren 4 mm O.D. en 3 mm O.S. en waren beide rond en reactief, met een 3+ afferent defect O.D. De evaluatie van het voorste segment was opmerkelijk voor nucleaire sclerotische cataracten. We verrichtten een verwijd fundusonderzoek en stelden vast dat de voornaamste klacht van de patiënt te wijten was aan een achterste glasvochtloslating O.S., die een dichte, centrale glasvochtsynerese veroorzaakte. We vonden geen netvliesbreuken of iets anders van klinisch belang in dat oog.
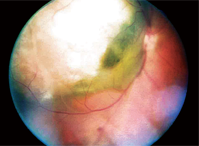
Dilatatiefundusonderzoek van zijn rechteroog onthulde een grote verheven laesie, ongeveer 12 schijfdiameters groot, die zich uitstrekte van – en inclusief – de temporale oogschijf, voorbij de temporale macula en voorbij de superieure arcade. Het was grijswit van kleur met wat vocht in het inferieur-nasale aspect leek te zijn (figuur 1).
Diagnose
We stelden de voorlopige diagnose choroïdaal melanoom met sereuze netvliesloslating, en documenteerden dit met fundusfoto’s.
Behandeling en follow-up
We verwezen de patiënt door naar de oogarts van de instelling voor verdere evaluatie en behandeling. Ongeveer twee weken later zag de oogarts hem en maakte een fluoresceïne-angiogram en een A- en B-scan echografie. De interpretatierapporten van deze procedures waren tamelijk rudimentair; zij vermeldden dat de A- en B-scans een “solide massa” aan het licht brachten, en de fluoresceïne toonde aan dat de massa eerst gevuld was met kleurstof en daarna langzaam verdween. Na deze onderzoeken stelde de oogarts de differentiële diagnose van kwaadaardig melanoom of disciforme maculaire degeneratie. Hij verwees de patiënt naar een netvliesspecialist, die hem enkele dagen na het oogheelkundig consult zag.
De netvliesspecialist diagnosticeerde onmiddellijk een choroïdaal melanoom en stuurde de patiënt die dag door naar een oculoplastisch specialist om de behandeling te bespreken. Diagnostische testresultaten van de netvliesspecialist en de oculoplastisch specialist waren voor ons niet beschikbaar in het dossier van de patiënt. Er werd ook een CT-scan van de buikholte met contrast en een röntgenfoto van de borstkas gemaakt.
De patiënt en de oculoplastisch specialist besloten tot behandeling met enucleatie, en de patiënt werd ingepland voor een operatie de week daarop. De enucleatie was succesvol, maar de patiënt had helaas moeite met de anesthesie en overleed twee dagen na de enucleatie. De abdominale CT en de röntgenfoto’s van de borst waren nog niet klaar.
Discussie
Choroïdale melanomen zijn betrekkelijk zeldzaam, met een incidentie van ongeveer vijf tot zes gevallen per één miljoen mensen, wat neerkomt op ongeveer 1400 gevallen per jaar in de Verenigde Staten.1,2 Ze worden meestal bij volwassenen aangetroffen (met een piek rond de leeftijd van 55 jaar), zijn over het algemeen niet familiair, en vertonen een lichte voorliefde voor mannen in de meeste leeftijdsgroepen.1,3,4 Ze komen meestal voor bij mensen met een lichte huidskleur en blauwe of groene iriden, en zelden bij zwarten of Aziaten.1,4
Patiënten met choroïdale melanomen zijn vaak asymptomatisch, maar kunnen zich presenteren met verminderd gezichtsvermogen, gezichtsvelddefecten, floaters, fotopsieën of, in zeldzame gevallen, pijn.4,5 Als pijn optreedt, is dit meestal een gevolg van secundaire glaucoom of tumornecrose; choroïdale melanomen kunnen ook pijn veroorzaken door inwerking op onderliggende posterieure ciliaire zenuwen, maar dit komt zelden voor.3,5
Deze laesies zijn meestal verheven en kunnen er gevlekt, donkerbruin, dofgrijs, grijsgroen of geel (amelanotisch) uitzien.4-6 Ze kunnen de vorm van een paddestoel of koepel aannemen met verstopte bloedvaten binnen de tumor – deze configuratie vertegenwoordigt de 20% van choroïdale melanomen die door het membraan van Bruch en het retinale pigment epitheel (RPE) uitbarsten.1,4,5
Choroïdale melanomen vertonen vaak een abrupte opheffing uit het vaatvlies, subretinale vloeistof, oranje pigmentatie aan het oppervlak van de laesie en groei in de loop van de tijd.4 Subretinale vloeistof met onderliggende netvliesloslating als gevolg van RPE afbraak. Deze sereuze netvliesloslatingen verschuiven vaak en kunnen bloed lijken te bevatten als de tumor het membraan van Bruch heeft doorkruist.5
De onderliggende oranje pigmentatie is lipofuscine; dit pigment bestaat uit eiwitten, lipiden en kleine chromoforen, en het hoopt zich op in het RPE als gevolg van celdegeneratie en onvolledige vertering van de buitenste segmenten van de fotoreceptor.6,7 Lipofuscine is niet specifiek voor melanomen; het kan ook geassocieerd zijn met choroïdale nevi of andere goedaardige choroïdale tumoren. Lipofuscine wordt echter veel vaker gezien bij melanomen dan bij goedaardige tegenhangers.5
Andere mogelijke verschijnselen die in verband kunnen worden gebracht met choroïdale melanomen zijn glasvochtbloedingen of gepigmenteerde glasvochtcellen, drusen aan het oppervlak van de tumor, choroïdale neovasculaire membranen, of zelfs proptosis als de tumor de oogkas binnendringt.4
Differentiële diagnoses
Er is een overvloed aan differentiële diagnoses voor melanotische en amelanotische choroïdale melanomen, die variëren op het prognostische continuüm van de ernst van de aandoening.
– Choroïdale nevi vormen een belangrijk differentieel. Het zijn veel voorkomende, goedaardige melanocytaire tumoren die bij ongeveer 2% tot 6,5% van de blanke bevolking worden aangetroffen.8-10 Nevi zijn meestal leigrijs en relatief plat (minder dan 2 mm dik), hoewel er een aanzienlijke overlapping in grootte bestaat tussen kleine melanomen en grotere nevi.8,9 Net als choroïdale melanomen kunnen ze ook overliggende drusen of lipofuscine vertonen (figuur 2). Statistisch gezien zal van elke 500 choroïdale nevi er één een kwaadaardige transformatie ondergaan indien deze gedurende 10 jaar wordt gevolgd; het geschatte jaarlijkse percentage van kwaadaardige transformatie is één op 8.845.6,9
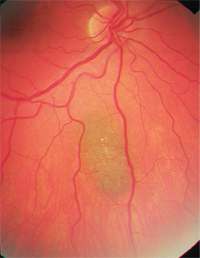
2. Er zijn meerdere risicofactoren voor een dergelijke transformatie bekend (zie “Maligne transformatie”).4,8 De belangrijkste lijkt een initiële nevusdikte van meer dan 2 mm te zijn, maar een grote basisdiameter (meer dan 7 mm) suggereert ook premaligniteit van de nevus.8,9 De afwezigheid van drusen is een goede prognostische indicator.7
Waar choroïdale melanomen de neiging hebben relatief snel te groeien, kunnen choroïdale nevi zich over een periode van enkele jaren langzaam uitbreiden, wat niet noodzakelijk wijst op maligne transformatie. Dergelijke niet-maligne groei komt vaker voor bij jongere patiënten en heeft de neiging zich te stabiliseren met de leeftijd.11 Langzame groei van choroïdale nevi is dus niet altijd een teken van maligniteit, vooral bij jongere patiënten zonder andere risicofactoren.11
Interessant is dat gepigmenteerde choroïdale laesies zonder een van de bovengenoemde risicofactoren een kans van 3% hebben op groei in vijf jaar; dergelijke laesies zijn meestal choroïdale nevi.9 Aanwezigheid van één van de bovengenoemde factoren geeft 38% kans op groei, en meer dan 50% kans op groei bij aanwezigheid van twee of meer risicofactoren.9 Het relatieve risico op groei stijgt van 1,9 maal tot 27,1 maal voor de aanwezigheid van één versus alle vijf risicofactoren.9
– Choroïdale metastase verwijst naar een tumor die zich via hematogene routes naar het vaatvlies heeft verspreid vanuit een primaire maligniteit elders in het lichaam. Het zijn dus geen primaire tumoren zoals choroïdaal melanoom – meestal zijn het uitzaaiingen van borst- of longkanker. Deze letsels zien er gewoonlijk koepelvormig en roomgeel uit, en veroorzaken vaak netvliesloslatingen. Choroïdale metastasen zijn vaak bilateraal of multifocaal en lijken niet paddestoelvormig, in tegenstelling tot amelonatische melanomen.1
– Congenitale hypertrofie van het RPE presenteert zich als enkelvoudige of multifocale, donker gepigmenteerde, vlakke laesies, vaak met gehypopigmenteerde lacunae. Ze zijn goedaardig, veranderen gewoonlijk niet met de tijd en vereisen geen behandeling.1
De resulterende sereuze netvliesloslating en retinale verhoging secundair aan exudatieve leeftijdsgebonden maculaire degeneratie (AMD) vormt een ander differentieel voor choroïdaal melanoom. AMD kan subretinale bloedingen, lipide of troebele exsudatie, vuilgrijs of geel macula-oedeem, choroidale plooien, pigmentepitheliale loslatingen of disciforme littekenvorming vertonen.1 Fluoresceïne-angiografie helpt bij het differentiëren tussen deze aandoeningen.
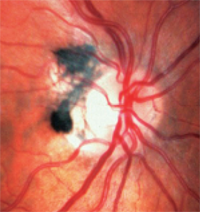
3. Melanocytomen zijn donker gepigmenteerd en worden op of rond de optische schijf aangetroffen.
– Melanocytomen zijn donker gepigmenteerd en worden op of rond de optische schijf aangetroffen (figuur 3). In tegenstelling tot melanomen zijn ze aangeboren en komen ze vaak voor bij personen met donkere pigmenten. Ze zijn meestal inactief, maar kunnen groeien en ontwikkelen zich zelden tot melanomen.1
– Choroïdale hemangiomen zijn goedaardige verwijdingen van choroïdale bloedvaten en worden vaak geassocieerd met het Sturge-Weber-syndroom. Ze zien er verheven uit en zijn rood-oranje van kleur. Net als choroïdale melanomen kunnen ze sereuze netvliesloslatingen veroorzaken.1
– Choroïdale osteomen zijn geeloranje placoïdale massa’s. Interessant is dat ze bestaan uit volgroeid botweefsel. Ze kunnen choroïdale neovascularisatie en subretinale bloedingen tot ontwikkeling brengen. Door hun zeer karakteristieke kenmerken zijn ze gemakkelijk te onderscheiden van choroïdale melanomen met behulp van echografie of CT-scan.1
– Bijkomende differentialen voor amelonotische of melanotische choroïdale melanomen zijn choroïdale loslating, lymfoom, metastatisch carcinoom, subretinaal of sub-RPE hematoom, gelokaliseerd suprachoroïdaal hematoom, nodulaire scleritis posterior, reactieve hyperplasie van RPE of massale gliose van het netvlies.4,5
Aanvullend onderzoek
Verschillende instrumenten kunnen helpen bij de diagnose van choroïdale melanomen.
Echografie met A- en B-scan helpt niet alleen bij de diagnose, maar kan ook nauwkeurigere metingen van de tumor opleveren. Een A-scan toont meestal een lage interne reflectiviteit binnen de tumor; oscillatie in de hoogte van de echo’s binnen de laesie kan overeenkomen met de hartslag van de patiënt, wat wijst op de aanwezigheid van intralesionale vasculariteit.1,5
B-scan toont een solide massa met een akoestisch helder anterieur aspect met interne en basale duisternis; de vorm van de dwarsdoorsnede is meestal bi-convex, maar kan er paddestoelachtig uitzien. Choroidale uitholling en orbitale schaduw kunnen ook worden gezien.1,5
Fluoresceïne-angiografie toont meestal hyperfluorescentie van de bloedvaten van de tumor en diffuse late kleuring.1 Het fluoresceïnepatroon hangt echter af van de grootte, de vorm, de pigmentatie, de integriteit van het RPE en of er een overeenkomstige sereuze netvliesloslating is, naast andere variabelen.5 Fluoresceïne-angiografie levert geen pathognomonische tekenen van choroïdaal melanoom op.3
Bij deze specifieke patiënt werd de diagnose choroïdaal melanoom gesteld op basis van fundoscopisch onderzoek, A- en B-scan echografie en fluoresceïne-angiografie (zonder biopsie).
De klinische presentatie van deze patiënt alleen al was zeer suggestief – in feite ondubbelzinnig – voor choroïdaal melanoom. Hij bezat vier van de vijf eerder genoemde risicofactoren voor maligniteit: dikte > 2mm, subretinale vloeistof, symptomen/zichtverlies, en een lokalisatie < 3mm van de optische schijf. Hoewel de afmetingen van de melanotische laesie op basis van echografie niet beschikbaar zijn, was deze duidelijk dikker dan 2 mm en had een basale diameter groter dan 7 mm (de algemeen aanvaarde bovengrenzen van goedaardige nevi).8,12
Bovendien vertoonde de massa duidelijk invasieve kenmerken, zoals encroachment op de optische schijf.8,12
Behandeling en prognose
Wanneer een verdachte oogmassa wordt gevonden, is het belangrijk de patiënt te vragen of hij/zij een operatie of trauma aan de ogen heeft gehad, of hij/zij in het verleden kanker heeft gehad, of systemische symptomen van kanker heeft gehad, zoals anorexie, gewichtsverlies, algemene vermoeidheid, malaise of ziekte. Hoewel bij 98% van de patiënten met choroïdale melanomen op het moment van de diagnose geen metastatische ziekte kan worden aangetoond, moet metastase worden uitgesloten.5 Dit kan het best worden behandeld door een oogoncoloog, dus moet een dergelijke verwijzing worden gemaakt.
Tests omvatten een volledig bloedbeeld, leverenzymen, abdominale CT, MRI of echografie, en een röntgenfoto van de borst.4,5 Er zijn verschillende behandelingsopties beschikbaar voor choroïdale melanomen, maar aan vele zijn grote risico’s verbonden; daarom moet de behandelend arts zorgvuldig vele variabelen afwegen bij de keuze van de juiste behandelingsmodaliteit voor elke specifieke patiënt. Enkele factoren waarmee rekening moet worden gehouden zijn de grootte en de plaats van de tumor, de status van de metastase, de visuele status van zowel het aangedane als het niet-aangedane oog, en de leeftijd en algemene gezondheidstoestand van de patiënt.5 Afhankelijk van deze factoren kan observatie een haalbaar behandelingsplan zijn als de patiënt ernstige gelijktijdige medische problemen heeft, maar over het algemeen wordt dit niet geadviseerd.
Maligne transformatie
Risicofactoren voor maligne transformatie van choroïdale nevi omvatten:4
– Dikte > 2 mm.
– Subretinale vloeistof.
– Aanwezigheid van symptomen.
– Prominent oranje pigment dat de laesie bedekt.
– Locatie < 3 mm van de oogschijf.
*Als twee of meer factoren aanwezig zijn, is de laesie waarschijnlijk een choroïdaal melanoom.
Een zeer agressieve behandeling is enucleatie, maar deze gaat gepaard met aanzienlijke risico’s. De helft van de patiënten die met enucleatie worden behandeld, sterft uiteindelijk aan uitgezaaid melanoom. Deze invasieve behandelingsoptie wordt vaker besproken als het aangedane oog blind is, pijnlijk, betrokkenheid van de oogschijf vertoont, of als de tumor zeer groot is.5
De meeste kleine choroïdale melanomen worden behandeld met lokaal destructieve therapieën, zoals thermotherapie, radiotherapie of bestraling.12 Verschillende soorten bestraling kunnen als behandeling worden gebruikt.4,5 De meest gebruikelijke is plaque brachytherapie, waarbij gebruik wordt gemaakt van een radioactieve plaque die buiten de tumor op het oppervlak van de oogbol wordt gehecht.
Dit wordt vaker geprobeerd bij kleinere tumoren die 3 schijfdiameters of meer verwijderd zijn van de schijf en de fovea. Bij ongeveer 10% tot 15% van de op deze manier behandelde patiënten treedt na de behandeling een lokaal tumorherval op. Na de behandeling blijft het gezichtsvermogen van de patiënt meestal gelijk aan dat van voor de behandeling, maar er is een kans dat het verbetert. Het gezichtsvermogen kan echter later verminderen als gevolg van secundaire effecten, zoals bestralingsretinopathie, optische papillopathie, cataract of neovasculair glaucoom.
Photocoagulatie kan worden geprobeerd voor kleine tumoren (< 3 mm dikte, < 7 mm basale diameter).4,5 Net als bij fotocoagulatie om welke andere reden dan ook, zal een permanent scotoma ontstaan in de gefotocoaguleerde gebieden. Er kunnen ook andere laserbehandelingen worden toegepast, waaronder transpupillaire thermotherapie, waarbij gebruik wordt gemaakt van een infraroodlaser met een laag vermogen en een lange duur.5,12 Deze techniek kan worden gebruikt in combinatie met plaque-radiotherapie, maar heeft geen significante verbetering van de lokale tumorcontrole aangetoond.13
Andere, minder gebruikelijke behandelingen zijn lokale resectie, fotodynamische therapie of cryotherapie.4,5 Vaak worden meerdere behandelingen gebruikt als onderdeel van een combinatiebenadering.
Helaas is de prognose voor patiënten met choroïdaal melanoom vaak slecht. Ondanks behandeling ontwikkelt 30% tot 50% van de patiënten uiteindelijk metastatische ziekte; dit gebeurt bij voorkeur naar de lever, maar ook naar long, bot, huid, lymfeklieren of centraal zenuwstelsel.3,11,14 Hetzelfde deel van de patiënten overlijdt binnen 10 jaar na de diagnose, meestal ten gevolge van metastatische verspreiding.3,11
Eenmaal gemetastaseerd, is fataliteit vrijwel zeker.11 De hoogste incidentie van metastatische detectie is binnen een jaar na de diagnose choroïdaal melanoom, hoewel dit soms pas jaren later optreedt. Verscheidene factoren correleren met een verhoogd sterftecijfer, waaronder een groter melanoom, anterieure lokalisatie, extrasclerale uitbreiding, groei door het membraan van Bruch, uitbreiding van de oogzenuw, gebrek aan pigmentatie en een agressief celtype en/of mitotische activiteit.3
Het is duidelijk dat deze patiënt bij zijn eerste afspraak met de optometriepolikliniek geen adequate zorg heeft gekregen; ondanks adequate doorverwijzing na zijn tweede afspraak zijn de kansen op een succesvolle afloop echter aanzienlijk verminderd.
Hoewel een vertraging in de doorverwijzing van een paar maanden in dit geval de resultaten misschien niet significant heeft veranderd, benadrukt deze situatie het belang van een grondige anamnese en een effectieve arts-patiënt communicatie. Ook blijkt hieruit het belang van adequate doorverwijzing en aanvullende onderzoeken, ongeacht of een aandoening al “lang bestaat”.
De prognose voor patiënten met choroïdaal melanoom kan somber lijken, maar oogzorgspecialisten moeten een passende behandeling instellen zodra ze een dergelijke laesie ontdekken om de kansen van de patiënt op positieve secundaire resultaten te verbeteren, waaronder het behoud van het gezichtsvermogen.
Dr. Weidmayer werkt samen met een groep optometristen van Eye Center of Lenawee, P.C., in Adrian en Brooklyn, Mich.
1. Spaide RF. Diseases of the Retina and Vitreous. 1e ed. Philadelphia: W.B. Saunders; 1999:262-65.
2. Margo CE. The collaborative ocular melanoma study: an overview. Kankerbestrijding. 2004 Sep-Oct;11(5):304-9.
3. Garcia-Valenzuela E, Pons ME, Puklin JE, Davidson CA. Choroïdaal Melanoom EMedicine Oogheelkunde. Medscape Referentie. June 24, 2009. http://emedicine.medscape.com/article/1190564-overview. Geraadpleegd op 17 augustus 2010.
4. Choroidal nevus and malignant melanoma of the choroid. In: Ehlers JP, Shah CP (eds). Het Wills Eye Manual: Office and Emergency Room Diagnosis and Treatment of Eye Disease. 5e ed. Philadelphia: Lippincott Williams & Wilkins; 2008:330-3.
5. Augsburger JJ, Damato BE, Bornfeld N. Uveal Melanoma. In: Yanoff M, Duker JS, eds. Oogheelkunde. 1e ed. London: Mosby;1999:1052-63.
6. Jones WL. Ophthalmoscopie. In: Terry JE (ed). Oculaire Ziekten: Detection, Diagnosis, and Treatment. 1st ed. Boston: Butterworth Publishers; 1984:155-57.
7. Materin MA, Raducu R, Bianciotto C, Shields CL. Fundus autofluorescentie en optische coherentie tomografie bevindingen in choroidal melanocytic laesies. Midden-Oosten Afr J Ophthalmol. 2010 Jul;17(3): 201-6.
8. Augsburger JJ, Correa ZM, Trichopoulos N, Shaikh A. Size overlap between benign melanocytic choroidal nevi and choroidal malignant melanomas. Invest Ophthalmol Vis Sci. 2008 Jul;49(7):2823-8.
9. Kaiserman I, Kaiserman N, Pe’er J. Long term ultrasonic follow up of choroidal naevi and their transformation to melanomas. Br J Ophthalmol. 2006 Aug;90(8):994-8.
10. Mashayekhi A, Siu S, Shields CL, Shields JA. Slow enlargement of choroidal nevi: a long-term follow-up study. Ophthalmology. 2011 Feb;118(2):382-8.
11. Onken MD, Worley LA, Tuscan MD, Harbour JW. An accurate, clinically feasible multi-gene expression assay for predicting metastasis in uveal melanoma. J Mol Diagn. 2010 July;12(4):461-8.
12. Augsburger JJ, Correa ZM, Schneider S, et al. Diagnostic transvitreal fine-needle aspiration biopsy of small melanocytic choroidal tumors in nevus versus melanoma category. Trans Am Ophthalmol Soc. (2002);100:225-34.
13. Sagoo MS, Shields CL, Mashayekhi A, et al. Plaque radiotherapy for juxtapapillary choroidal melanoma: tumor control in 650 consecutive cases. Ophthalmology 2011 Feb;118(2):402-7.
14. Finger PT, Kurli M, Reddy S, et al. Whole body PET/CT for initial staging of choroidal melanoma. Br J Ophthalmol. 2005 Oct;89(10):1270-74.