De hydrogenering van alkenen tot alkanen is exotherm. De hoeveelheid energie die vrijkomt bij een hydrogeneringsreactie, bekend als de warmte van hydrogenering, is omgekeerd evenredig met de stabiliteit van het uitgangsalkeen: hoe stabieler het alkeen, hoe lager de warmte van hydrogenering. Onderzoek van de hydrogeneringswarmte voor verschillende alkenen toont aan dat de stabiliteit toeneemt met de hoeveelheid substitutie.
| Samenstellingsnaam | Structuur | Molaire warmte van hydrogenering | Graad van substitutie | |
|---|---|---|---|---|
| in kJ/mol | in kcal/mol | |||
| Ethyleen | H 2 C = CH 2 {\displaystyle {{H2C=CH2}}
 |
137 | 32,8 | Ongesubstitueerd |
| 1-Buteen |
|
127 | 30.3 | gemonosubstitueerd |
| trans-2-Buteen |
|
116 | 27.6 | Gesubstitueerd |
| 2-Methyl-2-buteen |
 |
113 | 26.9 | Trisubstitueerd |
| 2,3-Dimethyl-2-buteen |
 |
111 | 26.6 | Tetrasubstitueerd |
De toename in stabiliteit die gepaard gaat met extra substituties is het resultaat van verschillende factoren. Alkylgroepen zijn elektronendonerend door een inductief effect, en verhogen de elektronendichtheid op de sigma binding van het alkeen. Ook zijn alkylgroepen sterisch groot, en zijn ze het meest stabiel als ze ver van elkaar verwijderd zijn. In een alkaan is de maximale afstand die van de tetrahedrale bindingshoek, 109,5°. In een alkeen neemt de bindingshoek toe tot bijna 120°. Als gevolg hiervan is de scheiding tussen alkylgroepen het grootst in het meest gesubstitueerde alkeen.
Hyperconjugatie, die de stabiliserende interactie beschrijft tussen de HOMO van de alkylgroep en de LUMO van de dubbele binding, helpt ook de invloed van alkylsubstituties op de stabiliteit van alkenen te verklaren. Met betrekking tot orbitaal hybridisatie is een binding tussen een sp2-koolstof en een sp3-koolstof sterker dan een binding tussen twee sp3-gehybridiseerde koolstoffen. Berekeningen laten een dominant stabiliserend hyperconjugatie-effect zien van 6 kcal/mol per alkylgroep.
Sterische effectenEdit
In E2 eliminatiereacties onttrekt een base een proton dat bèta is aan een vertrekkende groep, zoals een halogenide. De verwijdering van het proton en het verlies van de vertrekkende groep gebeuren in één enkele, gecoördineerde stap om een nieuwe dubbele binding te vormen. Wanneer een kleine, ongehinderde base – zoals natriumhydroxide, natriummethoxide of natriumethoxide – wordt gebruikt voor een E2-eliminatie, is het Zaitsev-product typisch te verkiezen boven het minst gesubstitueerde alkeen, bekend als het Hofmann-product. Zo levert de behandeling van 2-broom-2-methylbutaan met natriumethoxide in ethanol het Zaitsev-product op met een matige selectiviteit.

Vanwege sterische interacties kan een volumineuze base – zoals kaliumt-butoxide, triethylamine of 2,6-lutidine – niet gemakkelijk het proton abstraheren dat tot het Zaitsev-product zou leiden. In deze situaties wordt bij voorkeur een minder sterisch gehinderd proton geabstraheerd. Het Hofmann-product heeft dus de voorkeur bij gebruik van volumineuze basen. Wanneer 2-broom-2-methylbutaan wordt behandeld met kalium-t-butoxide in plaats van natriumethoxide, wordt het Hofmann-product begunstigd.

Sterische interacties binnen het substraat verhinderen ook de vorming van het Zaitsev-product. Deze intramoleculaire interacties zijn van belang voor de verdeling van producten in de Hofmann eliminatiereactie, die aminen omzet in alkenen. Bij de Hofmann eliminatie wordt bij de behandeling van een quaternair ammoniumjodidezout met zilveroxide een hydroxide-ion gevormd, dat als base fungeert en het tertiaire amine elimineert, waardoor een alkeen ontstaat.
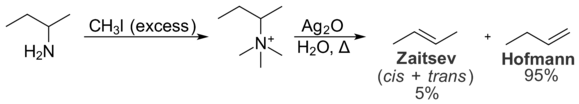
Bij de Hofmann eliminatie is het minst gesubstitueerde alkeen meestal het gunstigst door intramoleculaire sterische interacties. De quaternaire ammoniumgroep is groot, en interacties met alkylgroepen op de rest van het molecuul zijn ongewenst. Dientengevolge is de conformatie die nodig is voor de vorming van het Zaitsev-product energetisch minder gunstig dan de conformatie die nodig is voor de vorming van het Hofmann-product. Als gevolg daarvan wordt het Hofmann-product bij voorkeur gevormd. De Cope-eliminatie lijkt in principe sterk op de Hofmann-eliminatie, maar vindt plaats onder mildere omstandigheden. Ook deze eliminatie bevordert de vorming van het Hofmann-product, en wel om dezelfde redenen.
StereochemieEdit
In sommige gevallen kan de stereochemie van het uitgangsmateriaal de vorming van het Zaitsev-product verhinderen. Wanneer bijvoorbeeld menthylchloride met natriumethoxide wordt behandeld, wordt uitsluitend het Hofmann-product gevormd: maar in zeer lage opbrengst:

Dit resultaat is te wijten aan de stereochemie van het uitgangsmateriaal. E2 eliminaties vereisen een anti-periplanaire geometrie, waarbij het proton en de vertrekkende groep aan weerszijden van de C-C binding liggen, maar wel in hetzelfde vlak. Wanneer menthylchloride in de stoelconformatie wordt getekend, is de ongewone productverdeling gemakkelijk te verklaren.

Vorming van het Zaitsev-product vereist eliminatie op de 2-positie, maar de isopropylgroep – niet het proton – ligt anti-periplanair ten opzichte van de uittredende chloride groep; dit maakt eliminatie op de 2-positie onmogelijk. Om het Hofmann-product te kunnen vormen, moet eliminatie plaatsvinden op de 6-positie. Omdat het proton op deze positie de juiste oriëntatie heeft ten opzichte van de vertrekkende groep, kan eliminatie plaatsvinden en gebeurt dit ook. Het resultaat is dat deze reactie alleen het Hofmann-product oplevert.