In zijn eenvoudigste vorm bestaat een elektrochemische cel uit twee elektrongeleiders, gescheiden door een ionengeleider en verbonden door een elektronengeleider.
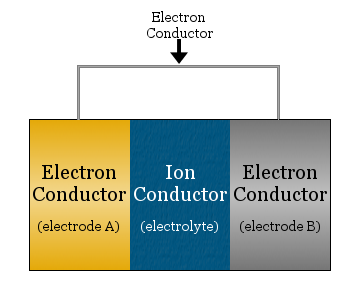
- de ionengeleider wordt de elektrolyt genoemd
- de door de elektrolyt gescheiden elektrongeleiders worden elektroden genoemd
- de elektrongeleider die wordt gebruikt om de elektroden met elkaar te verbinden is vaak een metaaldraad, zoals koperdraad
Twee soorten cellen
Er zijn twee fundamentele soorten elektrochemische cellen: galvanische en elektrolytische.
De energieomzetting wordt bereikt door spontane (ΔG < 0) redoxreacties die een stroom elektronen produceren.
Een stroom elektronen drijft niet-spontane (ΔG ≥ 0) redoxreacties aan.
Voorbeelden
- Een batterij die iets aandrijft, is een voorbeeld van een galvanische cel.
- Oplaadbare batterijen zijn voorbeelden van beide celtypen: ze werken als galvanische cellen wanneer ze een apparaat van stroom voorzien en als elektrolytische cellen wanneer ze worden opgeladen.
- Voorbeelden van elektrolytische cellen zijn ook de cellen die worden gebruikt om water in waterstof en zuurstof te splitsen, en de cellen die aluminiumerts omzetten in aluminiummetaal.
Een bron van thermodynamische gegevens
Naast praktische toepassingen, zoals hierboven beschreven, zijn elektrochemische cellen een uitstekende manier om thermodynamische gegevens te verzamelen.Bijvoorbeeld, ze maken het mogelijk om standaard redox potentialen te bepalen, waaruit standaard enthalpie, standaard entropie en standaard Gibbs vrije energie gegevens voor reacties gemakkelijk kunnen worden verkregen.
Scheidende reacties
Electrochemische cellen kunnen:
- elektriciteit leveren, of
- metaalertsen omzetten in het metaal, of
- thermodynamische gegevens verschaffen,
want de redoxreacties vinden afzonderlijk plaats.
Voorbeeld: De Daniell-cel
In elektrochemische cellen vinden de reacties plaats aan afzonderlijke elektroden – en de elektroden zelf kunnen zelfs in verschillende vaten zijn geplaatst.Beschouw een van de vroege galvanische cellen, de Daniell-cel.
De energiebron van de Daniell-cel is de spontane reactie van zinkmetaal met kopersulfaat, waarbij zinksulfaat en kopermetaal ontstaan.
ΔG° = -212.6 kJ mol-1
Wanneer de materialen worden samengebracht:
- in direct contact in één vat, wordt chemische potentiële energie omgezet in thermische energie en wordt het reactievat warmer
- in een elektrochemische cel wordt chemische potentiële energie omgezet in elektrische energie
De Daniell-cel
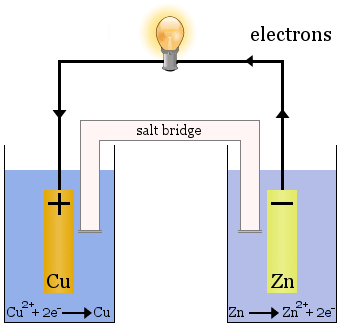
De Daniell-cel bestaat uit twee half-cellen: koperionen worden gereduceerd in de ene en zink wordt geoxideerd in de andere.
Wanneer de cel werkt, wordt Cu2+ verwijderd uit de ene cel en wordt Zn2+ geproduceerd in de andere cel.De koperelektrode begint te groeien naarmate deze wordt geplateerd met vers afgezet kopermetaal, en de zinkelektrode begint te verkleinen door het verlies van zink als ionen in de oplossing.
De zoutbrug in het bovenstaande geval is een glazen buis gevuld met verzadigde KNO3-oplossing.Het heeft fritten aan de uiteinden die het mengen van de oplossingen in elk van de halfcellen verhinderen, maar het laat ionen door om het elektrische circuit te voltooien en elke halfcel elektrisch neutraal te houden.
De drijvende kracht is dezelfde ΔG° = -212.6 kJ mol-1 die wordt verkregen bij het eenvoudig mengen van de reactanten in één vat; door de twee halfreacties te scheiden, moeten de elektronen door de draad en kunnen we de elektrische energie gebruiken.
