Azide-ion: Structure, Properties, and Substitution Reactions
Het azide-ion (N3- ) is een van die chemische entiteiten die er gewoon vreemd uitzien.

- Drie nitrogenen op een rij? check
- Twee negatieve ladingen en een positieve lading, voor een netto lading van -1 ? check
- Stabiel? check (zolang het voorzichtig wordt behandeld).
Zoals blijkt, kan het azide-ion uiterst nuttig zijn voor het vormen van C-N bindingen in nucleofiele substitutiereacties.
Table of Contents
- The Azide Ion Is A Great Nucleophile
- Organic Azides As “Masked” Amines
- Exploding On The Launchpad
- Nucleophilic Acyl Substitution With Azide Salts: Acyl Azides
- Herschikking van Acyl Azides: De Curtius-Rerangschikking
- Meer voorbeelden van Azide-nucleofielen: Epoxide-opening en geconjugeerde additie
- Noten
- (Gevorderd) Referenties en verder lezen
- 1. Het azide-ion is een groot nucleofiel in SN2-reacties
- 2. 2. Organische aziden als “gemaskeerde” aminen
- Exploderend op het lanceerplatform
- 4. Nucleofiele Acyl Substitutie met Azidezouten Maakt Acyl Azides
- 5. Herschikking van acyl-aziden: De Curtius-herrangschikking
- Meer voorbeelden van azide-nucleofielen: Epoxide-opening en conjugaat-additie
- Notities
- (Gevorderd) Referenties en verder lezen
1. Het azide-ion is een groot nucleofiel in SN2-reacties
Het azide-ion is de geconjugeerde base van hydrazoëzuur, HN3. Ondanks het feit dat het slechts zwak basisch is (de pKa van HN3 is slechts 4,6) is N3 een extreem goed nucleofiel – volgens één maatstaf nucleofieler dan enig amine (zie post: Nucleofiliciteit van amines). Het is niet moeilijk te rationaliseren waarom dit zo is, als je er even bij stilstaat. Met vier nucleofiele lone paren in een zeer klein volume is de kans op een botsing met een elektrofiel die tot een reactie leidt veel groter dan bij een amine met volumineuze alkylgroepen, om maar een voorbeeld te noemen.
Je kunt N3- zien als een slanke, gemene raket met een stikstof-tip, die zijn lading snel, efficiënt en zonder noemenswaardige nevenreacties op koolstof aflevert.
In SN2-reacties worden primaire en secundaire alkylhalogeniden en -sulfonaten gemakkelijk verdrongen door N3-, waardoor alkylaziden ontstaan:
De gebruikelijke procedure is het gebruik van een azidezout zoals NaN3 of KN3 met het juiste alkylhalogenide in een polair aprotisch oplosmiddel zoals acetonitril (CH3CN) of dimethylsulfoxide (DMSO).
De organische azideproducten zijn redelijk stabiel, ook al zien ze er een beetje vreemd uit. Sommige zijn zelfs gebruikt als geneesmiddelen (b.v. AZT, rechtsonder) of als nuttige sondes voor het bestuderen van chemische biologie.
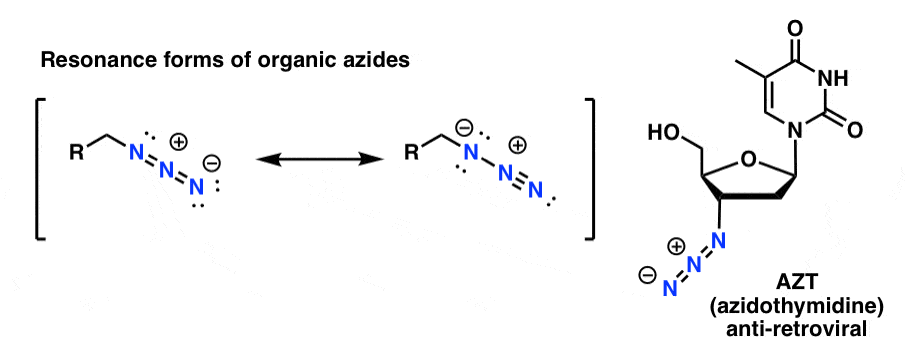
Voor onze doeleinden is de nuttigste eigenschap van organische aziden dat zij dienen als “gemaskeerde” aminen.
2.
2. Organische aziden als “gemaskeerde” aminen
Let op de resonantievorm hierboven met een drievoudige stikstof-stikstofverbinding. Indien behandeld met een reductiemiddel, zoals LiAlH4 of zelfs katalytische hydrogenering (Pd/C , H2) kunnen organische aziden worden gereduceerd tot primaire aminen, waarbij N2 vrijkomt.
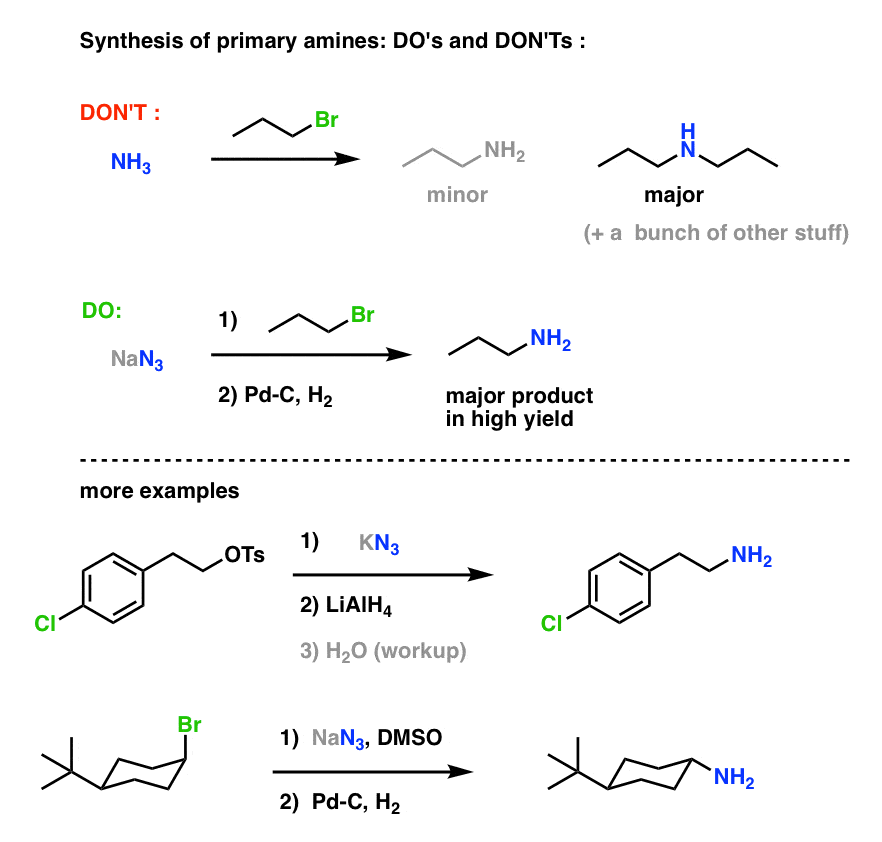
Dit is een zeer nuttige route naar primaire aminen uit alkylhalogeniden!
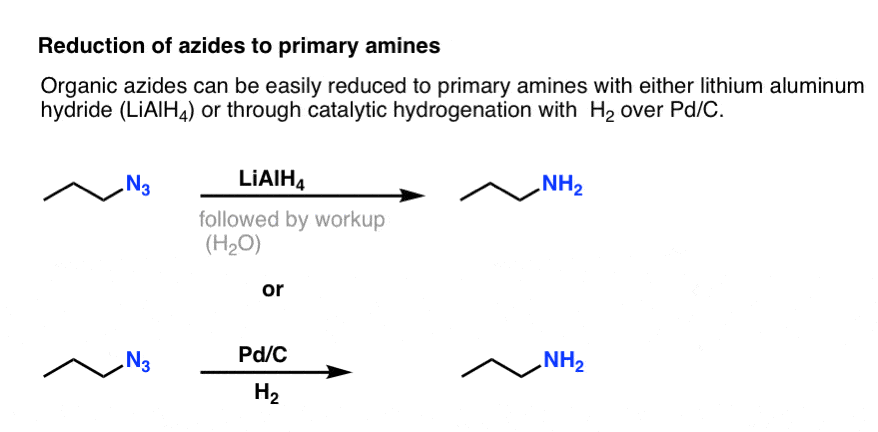
We hebben eerder de Gabriel-synthese onderzocht als een route naar primaire aminen, maar deze route is superieur omdat het azide kan worden gereduceerd tot het amine onder zachte omstandigheden (b.v. hydrogenering).
We hebben ook gezien dat het maken van primaire amines door directe behandeling van alkylhalogeniden met NH3 vaak niet resulteert in het gewenste product, omdat amines een Cookie-Monster-achtige neiging hebben om meerdere keren te reageren met alkylhalogeniden: omdat de amineproducten de neiging hebben om meer nucleofiel te zijn dan de reactanten, is het moeilijk om amines te laten stoppen bij het opeten van slechts één alkylhalogenide.
Exploderend op het lanceerplatform
Als N3 een “raket met een stikstoftip” is, zoals we hierboven opmerkten, is het de moeite waard eraan te herinneren wat er gebeurt als een raket niet voorzichtig wordt behandeld: het is in wezen een bom.
NaN3 en KN3 zijn witte poeders die voor onbepaalde tijd bij kamertemperatuur kunnen worden opgeslagen en zonder problemen op de bank kunnen worden uitgeschept.
Maar wanneer ze worden verhit of aan schokken worden blootgesteld – alle weddenschappen zijn uit. Hetzelfde geldt voor blootstelling van deze azidezouten aan zuur, waarbij potentieel explosief HN3 wordt gevormd.
En NaN3 en KN3 zijn de leuke aziden! Indien vermengd met metaalzouten van lood, kwik, cadmium, zink of zilver, kunnen nog explosievere azideverbindingen ontstaan. Deze metaalaziden zijn contactexplosieven, waarvan sommige zo gevoelig zijn dat ze ontploffen als iemand een paar meter verder in de gang een scheet laat. Sommige gekke chemici maken deze dingen zelfs expres, maar we zullen op dit blog nooit en te nimmer in de buurt van de ontploffingsstraal van dat onderwerp komen.
NaN3 en KN3 moeten in redelijk verdunde concentraties worden gebruikt, achter een explosiescherm op voorbereidende schaal, en overigens nooit worden gebruikt met CH2Cl2 oplosmiddel, dat kan resulteren in zeer explosief diazidomethaan.
Nou, er zijn momenten waarop een plotselinge explosie van stikstofgas nuttig is – en mogelijk levensreddend. U hebt misschien al een deel van uw dag in de nabijheid van natriumazide doorgebracht zonder het zelfs te beseffen. Dat komt omdat NaN3 is een van de verschillende drijfgassen die gebruik vindt in airbags; eenmaal getriggerd door een versnellingsmeter, detonatie van NaN3 stoot N2 gas uit met meer dan 200 mph, het opblazen van de zak in 1/25 van een seconde.
Yay voor azide zouten!
via GIPHY
(Maar wees niet deze man):
via GIPHY
Bottom line: SN2 reacties tussen alkylhalogeniden of sulfonaten met aziden zijn waarschijnlijk de beste manier om primaire aminen te synthetiseren uit alkylhalogeniden. Het verslaat zeker de Gabriel synthese.
4. Nucleofiele Acyl Substitutie met Azidezouten Maakt Acyl Azides
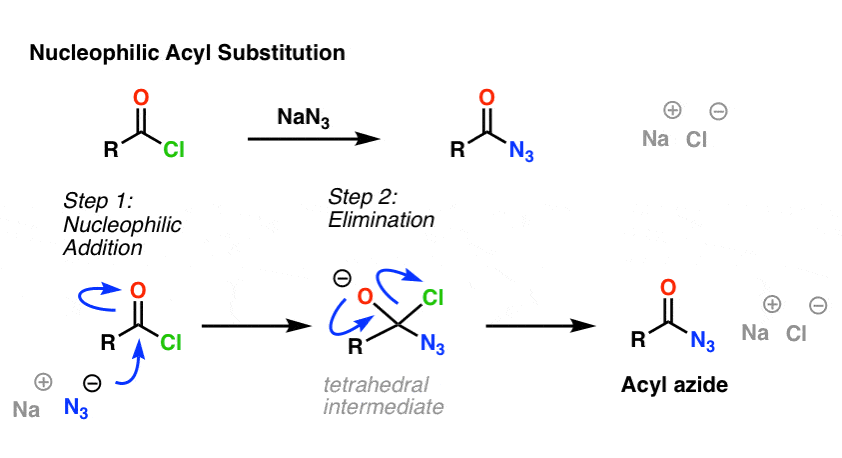
De SN2 reactie is niet de enige soort substitutiereactie die we hebben verkend. Er is ook nucleofiele acylsubstitutie. Een carbonyl gekoppeld aan een goede verlaten groep (zoals een zuurchloride of anhydride) zal substitutie ondergaan wanneer een geschikt nucleofiel wordt toegevoegd.
In de eerste stap van het mechanisme valt het nucleofiel (Nu) de carbonylkoolstof aan, waarbij C-Nu wordt gevormd en C-O (pi) wordt gebroken. Hierdoor ontstaat een tetrahedraal tussenproduct. In de tweede stap wordt de C-O pi binding opnieuw gevormd en wordt de koolstof-(vertrekgroep)binding verbroken, wat resulteert in het nucleofiele acylsubstitutieproduct.
Hier volgt een voorbeeld van een nucleofiele acylsubstitutiereactie tussen een zuurchloride en het N3-ion om een acylazide te geven:
5. Herschikking van acyl-aziden: De Curtius-herrangschikking
De meest voorkomende toepassing van acyl-aziden is dat zij bij verhitting herschikken tot isocyanaten in een reactie die bekend staat als de Curtius-herrangschikking.
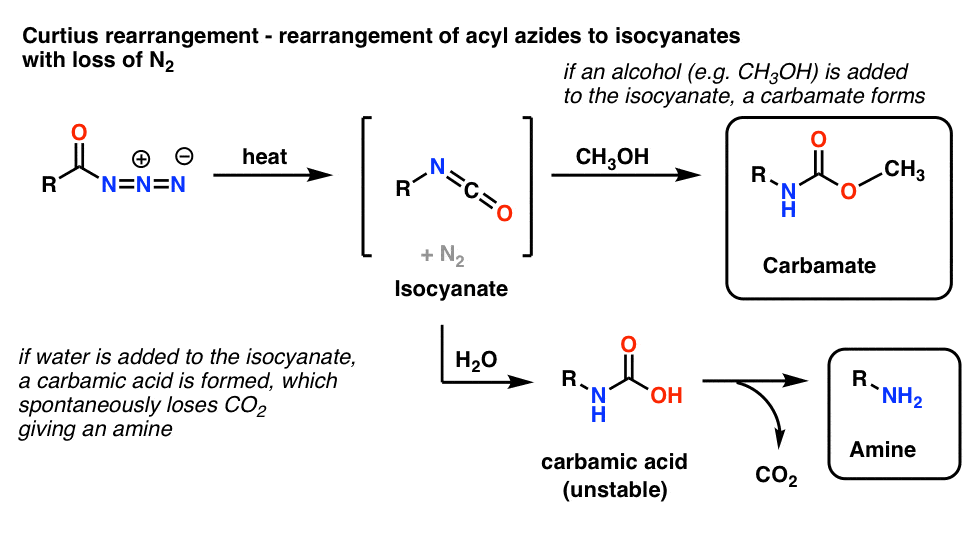
- Als de Curtius wordt uitgevoerd in aanwezigheid van een alcohol zoals methanol, wordt een carbamaat gevormd.
- Als in plaats daarvan water wordt toegevoegd, wordt kortstondig een onstabiel carbamzuur gevormd, dat vervolgens kooldioxide verliest om een primair amine te geven.
Waarom zou dit nuttig kunnen zijn? Hier is een manier.
Er zijn veel methoden om aromatische carbonzuren te maken, maar niet zo veel geweldige manieren om C-N bindingen te vormen op aromatische ringen. Stel, je hebt een benzoëzuur (zoals p-methylbenzoëzuur), maar je moet een (beschermd) aromatisch amine vormen. Het Curtius-protocol is een mooie manier om een nieuwe C-N binding aan de ring te vormen zonder toevlucht te hoeven nemen tot nitratie + reductie.
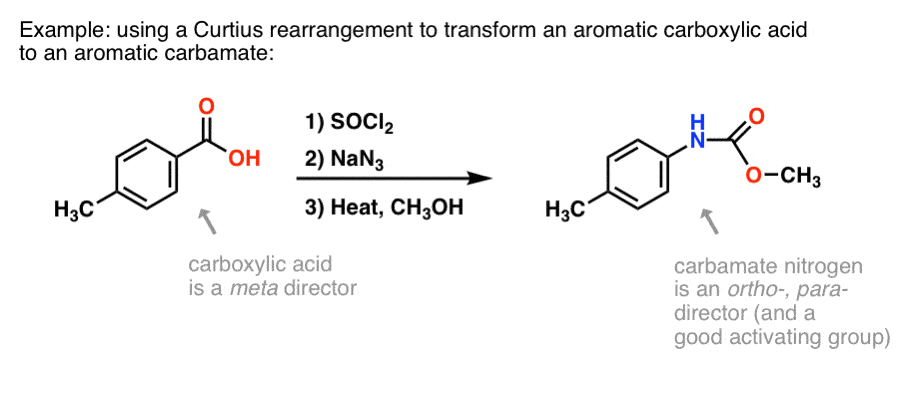
(Op deze manier is het enigszins analoog aan een stikstofequivalent van de Baeyer-Villiger oxidatie. )
Meer voorbeelden van azide-nucleofielen: Epoxide-opening en conjugaat-additie
Twee andere toepassingen van het azide-ion als nucleofiel zijn het openen van epoxiden (in wat in wezen een SN2-proces is – let op de omkering van de configuratie) en ook conjugaat-additie aan alfa,beta onverzadigde ketonen:
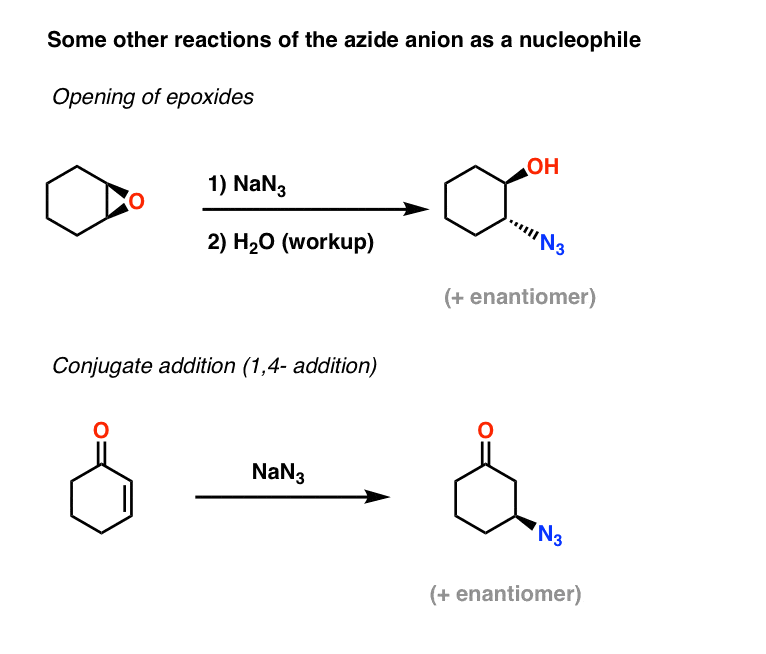
De resulterende alkyl-aziden kunnen dan worden gereduceerd tot primaire aminen met behulp van de methoden die hierboven zijn behandeld.
Notities
Footnote: Azide-Alkyne Cycloadditions, a.k.a. “
Een interessante en nuttige toepassing van organische aziden die nog niet in de leerboeken van de inleidende organische scheikunde is opgenomen (maar dat in de nabije toekomst waarschijnlijk wel zal doen) is een proces dat technisch de “koper-gekatalyseerde azide-alkyne cycloadditie” wordt genoemd, maar dat meer in het algemeen gewoon de “alkyne-azide clickreactie” wordt genoemd.
Wanneer een eindalkyne wordt behandeld met een koperkatalysator in aanwezigheid van een organisch azide, ontstaat snel een cycloadditie, die leidt tot de vorming van een 1,2,3-triazool.
We gaan niet diep in op de details, maar bij deze ringvormende reactie zijn 6 pi elektronen betrokken en het is een neefje van de Diels-Alder reactie (nitpckers zullen terecht opmerken dat de koper-gekatalyseerde versie technisch gezien geen gecoördineerd proces is, maar de niet-gekatalyseerde versie wel)
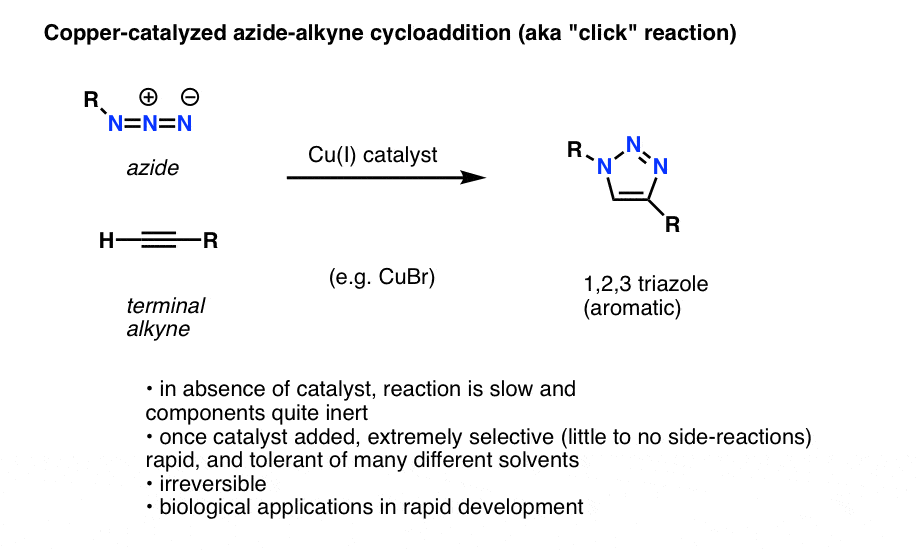
De reactie is om een paar redenen opmerkelijk:
- de reactieve partners (eindalkyne en organisch azide) zijn onder de meeste omstandigheden relatief inert bij afwezigheid van een katalysator.
- zodra koper is toegevoegd, treedt de reactie uiterst snel op onder milde omstandigheden en in een verscheidenheid van oplosmiddelen (met inbegrip van water).
- het is uiterst selectief onder deze omstandigheden, de alkyne en azide partners reageren alleen met elkaar, irreversibel.
- het product, een triazoolring, is aromatisch en stabiel
Het wordt een “klik”-reactie genoemd door een van de bedenkers, Barry Sharpless, omdat het een van de dichtste dingen is die scheikundigen hebben bij een reactie die is als het soepele “in elkaar klikken” van twee complementaire legoblokjes.
Wat heeft deze reactie bijzonder nuttig van de laatste tijd is dat azide en alkyne partners kunnen worden geïnstalleerd in moleculen van biologisch belang, en “geklikt” samen wanneer gewenst.
Bijv.:
- Het plaatsen van een acetyleen op de 5′ positie van een suiker en een azide op de 3′ positie is gebruikt om “geklikt” DNA te maken, waarbij de triazool het organofosfaat vervangt.
- Ongelooflijk genoeg heeft één groep “geklikt” DNA gemaakt, het in menselijke cellen gestopt, en is men erin geslaagd het door boodschapper-RNA te laten transcriberen.
- azide-bevattende AZT (boven) werkt door de transcriptie-machine te verstoppen. Sommige slimme mensen hebben een manier gevonden om de azide-alkyne click-reactie toe te passen voor snelle genoomsequencing, een techniek die bekend staat als ClickSeq.
Takata gebruikte natriumazide in het begin van de jaren 1990, en stapte toen over op tetrazol en vervolgens ammoniumnitraat.
Van “Sixty Million Car Bombs: Inside Takata’s Air Bag Crisis”.
Ammoniumnitraat was ongeveer een tiende goedkoper dan tetrazol, volgens Upham, die ook de patenten in de industrie heeft bekeken. Maar ammoniumnitraat had een kritieke tekortkoming die er volgens hem toe leidde dat andere fabrikanten van airbags ervan afzagen: Ammoniumnitraat heeft vijf fases van verschillende dichtheid die het moeilijk maken om het stabiel te houden in de tijd. Een drijfgas gemaakt met ammoniumnitraat zou opzwellen en krimpen bij temperatuursveranderingen, en uiteindelijk zou het tablet uiteenvallen in poeder. Water en vochtigheid zouden het proces versnellen. Poeder brandt sneller dan een tablet, dus een airbag waarvan het drijfgas is afgebrokkeld, zou waarschijnlijk te agressief worden opgeblazen. De gecontroleerde explosie zou slechts een explosie zijn. “Iedereen is een bepaalde weg ingeslagen, en alleen Takata is een andere weg ingeslagen,” zegt Jochen Siebert, die de airbagindustrie sinds de jaren negentig volgt en nu directeur is van JSC Automotive Consulting. “Als je de conferentiepapers van toen leest, zie je eigenlijk dat mensen zeiden: ‘Nee, dat moet je niet doen. Het is gevaarlijk.’ “
Splinters van de defecte airbags hebben wereldwijd 13 mensen gedood en meer dan 100 mensen verwond.
Op 25 juni 2017, geconfronteerd met aansprakelijkheden van meer dan $ 11 miljard dollar, vroeg Takata faillissement aan.
Primaire aminesynthese “Do’s and Don’ts” :
(Gevorderd) Referenties en verder lezen
Aziden zijn nuttig in de organische synthese, en een hoogtepunt van azide chemie wordt gegeven in de referenties hieronder.
- Nucleofiele reactiviteit van het azide-ion in diverse oplosmiddelen
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI: 10.1002/poc.1063
Prof. Herbert Mayr (LMU, München, Duitsland) heeft gedurende zijn loopbaan bijgedragen aan de fundamentele fysische organische chemie door het kwantificeren van elektrofiliciteit en nucleofiliciteit, en het ontwikkelen van schalen voor het vergelijken van de reactiviteit van verschillende nucleofielen en elektrofielen. - De SN2-verplaatsingen bij 2-norbornyl brosylaten
Klaus Banert en Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI: 1021/ja00377a057 - Een verbeterde synthese van Azidothymidine
I. Balagopala, A. P. Ollapally, & H. J. Lee
Nucleosides, Nucleotides & Nucleic Acids 1996, 4, 899-906
DOI: 10.1080/07328319608002136
Aziden kunnen worden gebruikt als nucleofielen in SN2-reacties. Ref. #3 toont het gebruik van azide-ionen in de synthese van AZT (azidothymidine). De omzetting van 1 naar 5 via 3 in ref. #3 maakt gebruik van de Mitsunobu Reactie, die de verplaatsing van een -OH groep met een nucleofiel met omkering van de configuratie mogelijk maakt. - Reductie van organische aziden tot primaire aminen met lithiumaluminiumhydride
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
De reductie van organische aziden tot primaire aminen is een handige methode voor de synthese van primaire aminen, die anders moeilijk selectief te synthetiseren zijn met standaardmethoden. - De explosieve gevoeligheid van de metaalaziden voor impact
P. G. Fox
J. Solid State Chem. 1970, 2 (4), 491-502
DOI: 10.1016/0022-4596(70)90043-5
Een onderzoek naar de schokgevoeligheid van NaN3, TlN3, en Pb(N3)2. - De Curtiusreactie
Smith, P. A. S. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Een oud maar uitgebreid overzicht van de Curtius-reactie, met onder meer de geschiedenis van de ontdekking van deze herschikking, de reikwijdte van het substraat, beperkingen, vergelijking met andere soortgelijke reacties, en experimentele procedures. - Synthetische methoden en reacties. 121. Zinkjodide gekatalyseerde bereiding van aroyl aziden uit aroyl chloriden en trimethylsilyl azide
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, and George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051b
Een handige procedure voor het bereiden van aromatische aryl aziden van Nobelprijswinnaar Prof. George A. Olah. Deze kunnen vervolgens worden gebruikt voor Curtius herschikkingen.
Epoxide opening en geconjugeerde additie:
- CYCLOHEXENE IMINE (7-AZA-BICYCLOHEPTANE)
Iain D. G. Watson, Nicholas Afagh and Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI: 10.15227/orgsyn.087.0161
Dit is een bijzonder nuttige procedure, omdat het een Staudinger-reactie is voor de omzetting van epoxiden in NH-aziridines (het stikstofanalogon van epoxiden). De synthese kan lastig zijn, maar er is hier veel detail gegeven zodat dit gereproduceerd kan worden, als passend bij een procedure in Organic Syntheses. - Amine-gekatalyseerde additie van Azide-ionen aan α,β-onverzadigde carbonylverbindingen
David J. Guerin, Thomas E. Horstmann, and Scott J. Miller
Organic Letters 1999, 1 (7), 1107-1109
DOI: 10.1021/ol9909076
Dit artikel is interessant omdat het een vroege vorm of organokatalyse vertegenwoordigt en waarschijnlijk via een imine of iminium ion intermediair verloopt. Helaas wordt de term nergens in het artikel gebruikt – deze auteurs hadden Prof. MacMillan voor kunnen zijn! - Click Chemistry: Diverse chemische functies uit een paar goede reacties
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI: 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
De Cu-gekatalyseerde cycloadditie van aziden met alkynen is een ‘click’-reactie genoemd door Nobelprijswinnaar prof. K. Barry Sharpless (The Scripps Research Institute, La Jolla, CA) vanwege zijn eenvoud, hoge opbrengst, snelle kinetiek, en compatibiliteit met een breed scala van omstandigheden en substraten. Cu-vrije reacties zijn ook mogelijk indien gespannen alkynen worden gebruikt (b.v. cyclooctynen).