- Review Article
- Enterocutane Fistel: Evidence-based Management
- Abstract
- Inleiding
- Tabel 1
- Tabel 1: Classificatie.
- Tabel 2
- Tabel 2: ECF Prognostische Variabelen.
- Classificatie
- Prognostische factoren voor ECF
- Diagnose
- Figuur 1
- Management
- Resuscitatie
- Broncontrole
- Behandeling van effluent
- Wondverzorging
- Tabel 3
- Tabel 3: Tijdsduur tot definitieve behandeling.
- Nutrition
- Conclusie
Review Article
Enterocutane Fistel: Evidence-based Management
Ryan P Dumas1*, Sarah A Moore1 and Carrie A Sims2
1Department of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
2Department of Surgery, Division of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
*Corresponderende auteur: Ryan P Dumas, Department ofTraumatology, Surgical Critical Care& Emergency Surgery, PerelmanSchool of Medicine at the University of Pennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstract
Het beheer van enterocutane fistels (ECF) is een klinische vaardigheid die in het arsenaal van elke algemeen chirurg zou moeten zitten. Hoewel de definitieve behandeling vaak berust op chirurgische sluiting, zijn pre-operatieve zorg en zorgvuldigheid van het grootste belang voor een succesvol resultaat. De zorg voor deze patiënten moet zich richten op vier belangrijke fasen. De eerste fase wordt gekenmerkt door de juiste herkenning en reanimatie. Tijdens de tweede fase wordt een volledige voedingsbeoordeling en -plan uitgevoerd. Radiografische evaluatie tijdens de derde fase helpt om de anatomie van de ECF te bepalen. Ten slotte wordt de vierde fase gekenmerkt door definitieve sluiting als de fistel niet spontaan geneest.Dit overzicht zal zich richten op de belangrijkste aspecten die elke fase definiëren en de algemeen chirurg helpen de kansen op een positief resultaat te maximaliseren.
Inleiding
De ontwikkeling van een enterocutane fistel (ECF), gedefinieerd als een abnormale verbinding tussen het darmlumen en de uitwendige huid, is een belangrijke bron van morbiditeit en mortaliteit ondanks de vooruitgang in zowel de chirurgische als de medische zorg. De totale incidentie van ECF is echter onbekend en de meeste gegevens over ECF zijn afkomstig van grote retrospectieve of chirurg-specifieke series van instellingen. Opmerkelijk is dat slechts 25% van alle ECF’s secundair zijn aan inflammatoire darmziekten, diverticulaire pathologie, trauma, bestraling en maligniteit. Daarentegen is bijna 75% van alle ECF’s het directe gevolg van laparoscopische of open chirurgie, waarbij een astomotisch lek naenterectomie verantwoordelijk is voor meer dan 50% van deze fistels. Onopzettelijke iatrogene letsels zoals enterotomieën of niet herkend thermisch letsel opgelopen tijdens een operatie zijn verantwoordelijk voor de resterende fistels. Omdat ECF meestal een door de chirurg veroorzaakt probleem is, ligt de verantwoordelijkheid voor preventie, management, planning en definitieve behandeling terecht bij de chirurg.
De morbiditeit en mortaliteit na ECF is zeer hoog. Naar schatting 90% van de patiënten krijgt te maken met een ECF-gerelateerde morbiditeit, variërend van huidexcidatie tot uitdroging en sepsis. Bovendien varieert het sterftecijfer als gevolg van een ECF van 5-20% en is afhankelijk van een aantal factoren, waaronder de onderliggende infectie en de locatie van de fistel. Omdat de belangrijkste doodsoorzaak bij patiënten met ECF sepsis is, blijft controle van de bron een van de hoekstenen van de therapie. In retrospectieve reeksen werd vastgesteld dat het sterftecijfer 16 keer hoger ligt in het geval van sepsis en 22 keer hoger in het geval van een ongecontroleerde infectie. Als zodanig kan een vroege en definitieve behandeling van niet-gedraineerde collecties in combinatie met antimicrobiële middelen op korte termijn de resultaten aanzienlijk verbeteren. In de meeste series lijkt het sterftecijfer ook te correleren met de output en locatie van de fistel. Het sterftecijfer stijgt van 26% bij fistels met een lage productie tot 50% bij fistels met een hoge productie, gezien de uitdagingen op het gebied van vocht, elektrolyten en voeding die gepaard gaan met ECF-management. Het sterftecijfer hangt ook samen met de locatie en neemt af met meer distale fistels. Terwijl jejunale fistels met 29% het hoogste sterftecijfer hebben en aanzienlijk moeilijker te beheren zijn, is het sterftecijfer van colonale fistels met 6% het laagst. Naast de gevolgen voor de patiënt, die zowel fysiologisch als psychologisch van aard zijn, legt ECF-management een enorme druk op de middelen van de gezondheidszorg. De kosten van ECF-management worden geschat op meer dan $500.000 en vereisen een multidisciplinair team van voedingsdeskundigen, wondverpleegkundigen en chirurgen om een goed resultaat te garanderen. Het belang van hooggekwalificeerde behandelingscentra mag niet worden onderschat en het is aangetoond dat het sterftecijfer er aanzienlijk door daalt, van 42% tot 20%.
Tabel 1

| Anatomisch | Proximaal of distaal | Gastric, duodenal, jejunal, ileal, colon |
| Fysiologisch | Hoge, matige, lage output | Hoge output >500 cc/dag Matige 200-500 cc/dag Lage output < 200 cc/dag |
| Etiologie | Iatrogene vs. spontaan Traumatisch |
Maligne Radiation Inflammatoire darmziekte Diverticulair |
Tabel 1: Classificatie.
Tabel 1
Classificatie.
Tabel 2

| FAVORABLE | UNFAVORABLE |
|---|---|
| Nutritionally replete | Nutritionally deplete |
| – Albumine >3.0 | -Laag albumine, laag transferrine |
| Lang fistelkanaal (>2cm) | Korte fistel, meervoudige, complexe fistels |
| Diverticulaire fistel | Groot enteraal defect (>1cm), zichtbare mucosa |
| Lage productie | Hoge productie (>500cc/dag) |
| Eenvoudige fistel | Prior bestraling |
| Intestinale continuïteit | Meerdere voorafgaande operaties |
| Indexoperatie uitgevoerd in hetzelfde centrum | Externe verwijzingen naar een centrum metvolume centrum |
Tabel 2: ECF Prognostische Variabelen.
Tabel 2
ECF Prognostische Variabelen.
Classificatie
Er bestaat geen universeel of vastomlijnd classificatieschema voorECF’s. Fistels worden in het algemeen anatomisch, fysiologisch of naar ziekteproces ingedeeld. Fistels kunnen ook worden ingedeeld naar de hoeveelheid dagelijkse output. Het is van het grootste belang dat de productie van fistels nauwkeurig wordt gedocumenteerd, omdat de hoeveelheid veranderingen in de behandeling kan dicteren. Tabel 1 geeft drie verschillende classificatieparadigma’s weer.
Prognostische factoren voor ECF
De prognostische factoren voor ECF zijn zeer goed beschreven en komen overeen met het standaard chirurgische dogma. Patiënten met een proximale fistel met hoge output hebben een laag albuminegehalte. Patiënten zonder comorbiditeiten die fistels hebben die het resultaat zijn van een chirurgische ingreep en een lage output hebben, hebben daarentegen een gunstiger prognose met hogere spontane afsluitingen. Tabel 2 geeft een overzicht van veel van de variabelen die een succesvol resultaat kunnen voorspellen.
Het belang van institutionele steun en multidisciplinaire deskundigheid als positieve prognostische factor kan niet genoeg worden benadrukt.Meerdere studies hebben bevestigd dat institutionele ervaring en volume kritische factoren zijn voor het verlagen van de morbiditeit en het verbeteren van de mortaliteit. Onlangs heeft de Canadian Association for EnterostomalTherapy het belang van multidisciplinaire zorg gecodificeerd door negen essentiële teamleden te identificeren in hun “ECF Best Practice” aanbevelingen. Deze geïntegreerde teambenadering, die varieert van chirurgen tot apothekers, erkent de deskundigheid die elk specialisme inbrengt in de zorg voor deze complexe patiënten.
Diagnose
Een smeulend postoperatief beloop, gecompliceerd door ileus en de ontwikkeling van een postoperatieve wondinfectie, is een voorbode voor ECF. Zodra een fistel wordt vermoed of bij lichamelijk onderzoek is vastgesteld, is radiologisch onderzoek een noodzakelijke aanvulling en 97% van alle patiënten ondergaat enige vorm van radiologische evaluatie. Een CT-scan met contrastvloeistof is essentieel om de aanwezigheid van een bijbehorend abces of een niet gedraineerde verzameling te kunnen vaststellen. Zodra de broncontrole is geoptimaliseerd, speelt fluoroscopische fistulografie een belangrijke rol bij het bepalen van de anatomie van de fistel. Een fistulogram helpt bij het lokaliseren van de oorsprong, het bepalen van de lengte, het evalueren van de aanwezigheid van distale obstructie en het bepalen of de fistel in continuïteit is met de rest van de darm. Zodra de diagnose van een ECF is bevestigd, moet de aandacht worden verlegd naar de behandeling.
Figuur 1
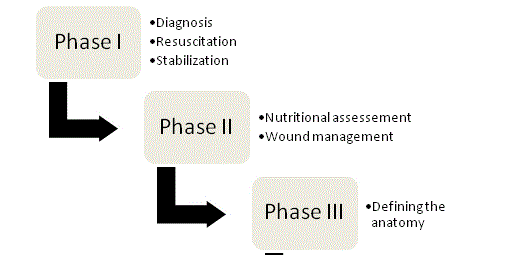
Figuur 1
Vier fasen van ECF-beheer.
Management
De grondbeginselen van ECF-management werden voor het eerst verdedigd door Chapman en collega’s in 1964 en tot op heden blijven zij de hoekstenen van de therapie. In hun oorspronkelijke artikel identificeerden Chapman et al. vier sleutelfactoren: vloeistofreanimatie, broncontrole, effluentbeheer en huidbescherming. Het belang van voeding is onlangs naar voren gekomen als een vijfde sleutelelement. Bij elke fistelpatiënt moet een georganiseerde, systematische aanpak worden gevolgd om de kans op een succesvol resultaat te optimaliseren; het beheer kan uiteindelijk worden onderverdeeld in de vier fasen (figuur 1).
Resuscitatie
Resuscitatie van een patiënt met een nieuw gediagnosticeerde ECF volgt veel van dezelfde principes als de reanimatie van septische patiënten en de beginselen van de Surviving Sepsis Campaign moeten als kader dienen. De eerste zorg moet gericht zijn op agressieve vloeistofreanimatie, snelle beoordeling en correctie van elektrolytenonevenwichtigheden, en normalisatie van melkzuurose. Patiënten met ECF zijn gewoonlijkhyponatremisch, hypokaliëmisch en acidotisch als gevolg van voortdurende verliezen in de dunne darm. Bij patiënten met fistels met een hoge output moeten vocht-, elektrolyten- en bicarbonaatverliezen intraveneus worden vervangen om uitdroging en ernstige metabolische instabiliteit tijdens de eerste stabilisatieperiode te voorkomen. Zorgvuldige controle van de urineproductie en doelgerichte vervanging van het effluent van de fistel om de 4 tot 8 uur zullen voortdurende uitdroging voorkomen.
Broncontrole
Zodra de patiënt is gereanimeerd, moet de aandacht worden verlegd naar het vaststellen van broncontrole. Zoals eerder vermeld, is een met contrast versterkte CT-scan nuttig bij het opsporen van niet-afgedreven verzamelingen en abcessen. Bij post-operatieve patiënten wordt de broncontrole waarschijnlijk uitgevoerd door interventionele radiologie. In geval van ontoegankelijke collecties of ongecontroleerde intra-abdominale sepsis kan een operatie echter onvermijdelijk zijn. Breed spectrum, empirische intra veneuze antibiotica dienen niet routinematig te worden gebruikt om ECF te behandelen, tenzij er bewijs is van intra-abdominale collecties of wondinfectie met een geassocieerde cellulitis. Indien mogelijk moeten antibiotica worden toegespitst op specifieke kweekgegevens en beperkt tot maximaal 2 weken.
Behandeling van effluent
Het beheer van succeseffluent kan een aanzienlijke invloed hebben op de volumestatus, de elektrolytenbalans, de voeding en de huidintegriteit.Het gebruik van protonpompremmers kan beide doelen bereiken en de dosis moet worden getitreerd tot de pH van de uitstromende vloeistof hoger is dan 6 en het volume van de uitstromende vloeistof minder is dan 1 liter per dag. Hoewel psyllium zeer nuttig kan zijn om de uitstromende vloeistof op te vullen en de transittijd te verlengen, zijn antimotiliteits- en antisecretiemiddelen, waaronder loperamide, atropinedifenoxylaat, codeïne, opiumtinctuur en zelfs methadon, de steunpilaar van de volumevermindering. Gezien de rol van somatostatine als de universele maag-darmhormoonremmer, is veel onderzoek verricht naar de effecten van exogene somatostatine op patiënten metECF. Ondanks een aanzienlijk aantal gerandomiseerde gecontroleerde onderzoeken, zijn significante conclusies moeilijk te trekken vanwege de kleine steekproefgrootte en de inconsistente opzet van de onderzoeken. Octreotide, een somatostatine-analoog met een langere werkingsduur, is ook onderzocht als ECF-adjunct met veelbelovende resultaten. Octreotide 100 mcg driemaal daags kan het uitstromende volume verminderen en in sommige studies is aangetoond dat het de tijd tot spontane sluiting verkort. Als zodanig kan een proef met octreotidetherapie gedurende 72 uur met nauwgezette controle van de fistelproductie gerechtvaardigd zijn, met name in gevallen waarin andere therapieën er niet in zijn geslaagd het uitstralingsvolume te verminderen. Veel voorkomende bijwerkingen zijn hyperglykemie, hoofdpijn en cholelithiasis.
Hoewel de gegevens duidelijk maken dat fistels met een laag uitgangsvolume sneller spontaan sluiten, is het minder duidelijk dat het verminderen van het uitgangsvolume het sluiten van de fistel verbetert. Desalniettemin kan het verminderen van het volume van de output de last van het fistelbeheer aanzienlijk verlichten en het welzijn van de patiënt positief beïnvloeden.
Wondverzorging
Een van de meer uitdagende en middelenvragende aspecten van ECF-beheer is wellicht de lokale controle van de effluenten. Geslaagde enterale weefsels kunnen de huid snel beschadigen en irritatie veroorzaken die moeilijk te behandelen is. Daarom is een goed huidbeheer met barrièrecrèmes, vochtbarrières, pouchingapparaten en afzuigapparaten van het grootste belang. Met name fistels met een hoge productie vereisen vaak een ingewikkeld netwerk van drains, pouches en afzuigapparatuur om de uitstroom adequaat onder controle te houden. Zeer gespecialiseerde wondverzorgingsteams en enterostomale therapeuten zijn van onschatbare waarde voor zowel de wondbehandeling als het comfort van de patiënt.
Met het alomtegenwoordige gebruik van negatieve druktherapie (NPT) voor de behandeling van wonden en open buiken, is het niet verrassend dat NPT deel is gaan uitmaken van het chirurgische arsenaal voor de behandeling vanECF. In de grootste serie tot nu toe rapporteerden Wainstein et al. hun ervaring met 91 patiënten met fistels met een hoge output, die werden behandeld met negatieve druk variërend van -350 tot -600 mmHg. Naast een significante verlaging van de effluentproductie van gemiddeld 1400 cc/dag naar 138 cc/dag, werd spontane sluiting bereikt bij 46% van de patiënten.In 2016 publiceerden Misky et al. een meta-analyse waarin het gebruik van NPT bij ECF werd onderzocht. Met behulp van tien retrospectieve studies met in totaal 151 patiënten vonden deze auteurs dat het mediane percentage van spontane sluiting 65% was (variërend van 7%-100%) met een mediane tijd tot sluiting van 58 dagen. Deze onderzoekers meldden ook een percentage nieuwe fistels van 4,4% – een bekende complicatie die sommige artsen doet aarzelen.Hoewel er duidelijk meer onderzoek nodig is om vast te stellen of NPT het sluiten van ECF’s definitief kan verbeteren of de tijd tot spontane sluiting kan verkorten, mogen de positieve voordelen van deze verbanden niet over het hoofd worden gezien. Deze technologie kan op zijn minst het beheer van ECF vergemakkelijken door de effluenten onder controle te houden, de huid te beschermen en de frequentie van verbandwissels te verlagen.
Tabel 3

| Onderzoekers | Institutionele praktijk |
|---|---|
| Hollington | 8 Maanden |
| Evenson | 4 Maanden |
| Rahbour | 12 Maanden |
| Datta | 6 Maanden |
| Lynch | 6 Maanden |
| Li | 6 Maanden |
| Mcintyre | 6 Maanden |
Tabel 3: Tijdsduur tot definitieve behandeling.
Tabel 3
Timing tot Definitive Management.
Nutrition
AssessmentDe voedingsstatus van een ECF-patiënt is van het grootste belang. Vóór de komst van op peptiden gebaseerde enterale formules en totale parenterale voeding (TPN), wijzen retrospectieve historische reeksen op de last van ondervoeding bij ECF-patiënten. In een serie van 157 patiënten in de jaren 1950 en 1960 was bijna 75% van de patiënten met proximale fistels ondervoed. Vergelijkbare resultaten werden gerapporteerd door Chapman et al. die ontdekten dat slechts een kleine minderheid van de patiënten optimale voeding had; en dat zodra de voeding werd verbeterd, het sterftecijfer als gevolg van ECF’s daalde van 55% tot 12-16%.
Een volledige voedingsbeoordeling moet worden uitgevoerd bij elke patiënt met een ECF. Hoewel de Harris-Benedict-vergelijking een goed uitgangspunt vormt voor de berekening van de voedingsbehoeften, wordt algemeen aangenomen dat ECF-patiënten katabool en hypermetabolisch zijn. In het algemeen hebben deze patiënten meer calorische ondersteuning nodig met ten minste 25-30 kcal/kg/dag aan koolhydraten en vet en 1,5 tot 2 gram eiwit/kg/dag.
De voedingsstatus en de vooruitgang dienen regelmatig opnieuw te worden beoordeeld. Naast de dagelijkse gewichten moeten ook regelmatig voedingsuitslagen zoals albumine, prealbumine, transfer en CRP worden gemeten. Vooral preoperatieve albumine blijkt de sterkste voorspeller te zijn van mortaliteit en morbiditeit na algemene chirurgie en hypoalbuminemie blijft een belangrijke voorspeller van slechte uitkomsten bij ECF-patiënten. Misschien wel het meest bestudeerde eiwit in ECF is echter transferrine en niveaus van meer dan 140 zijn in verband gebracht met hogere spontane sluitingspercentages en een lagere mortaliteit. Hoewel de stikstofbalans een nuttig hulpmiddel kan zijn, kan deze standaardmeting moeilijk zijn bij patiënten met fistels met een hoge productie. Aanvullende tests zoals indirecte calorimetrie kunnen worden overwogen in meer complexe gevallen die niet reageren op standaardzorg.
Parenterale versus enterale voeding
Parenterale voeding heeft een cruciale rol gespeeld bij de behandeling van ECF, waarbij het gebruik ervan stevig werd verankerd door Dudrick in 1969. In zijn toonaangevende artikel waarin het optimale beheer van TPN werd beschreven, concludeerde Dudrick dat: “bij het exclusieve gebruik van parenterale hyperalimentatie worden gewichtstoename, positieve stikstofbalans, groei en ontwikkeling regelmatig bereikt”. Sindsdien is TPN algemeen aanvaard als een middel om voeding te verstrekken en tegelijk de “darmrust” te bevorderen en het effluentbeheer te vereenvoudigen. Hoewel TPN de darmsecreties met 30%-50% vermindert, waardoor de incidentie van uitdroging en elektrolytenonevenwichtigheden afneemt, zijn er geen gerandomiseerde studies over de impact van TPN op anabole conversie, spontane sluitingspercentages of mortaliteit. Niettemin blijft TPN een populaire langetermijnbehandelingsmodaliteit ondanks ernstige complicaties zoals infectie en leverdisfunctie.
Meer recentelijk is het gebruik van enterale voeding bij ECF echter aan een opmars begonnen. Het gebruik van enterale voeding heeft een aantal voordelen, waaronder lagere kosten, minder infecties en een betere immunologische functie in vergelijking met TPN. Bovendien kan zelfs het toedienen van slechts 20% van de calorieën via een enterale route helpen om de darmflora in stand te houden en bacteriële translocatie te verminderen. In een retrospectieve serie van Li et al. werden 86,4% van 1168 patiënten effectief behandeld met enterale ondersteuning. Enterale voeding kan zelfs met succes worden gebruikt in de setting van fistels met een hoge output als het wordt gecombineerd met elementaire formules, antimotiliteitsmiddelen en vezelversterkende middelen. In een serie van 335 patiënten met fistels met een hoge output, waren Levy et al. in staat om met succes TPN-afhankelijkheid te bereiken bij 85% van hun cohort met behulp van enterale voeding. Interessant is dat, ondanks enterale voeding en het ontbreken van “darmrust”, mortaliteit en spontane sluitingspercentages vergelijkbaar waren met eerdere series.
In de setting van een ECF met hoge output en een distale mucocutane ledemaat, kan fistuloclyse een belangrijke aanvulling zijn op standaard enterale voeding. De praktijk van fistuloclyse is ontstaan uit de praktijk van het toedienen van chyme bij pasgeborenen en kan zowel verwijzen naar het toedienen van een geslaagde voeding als naar het aanvullen van extra enterale sondevoeding via een katheter die in het distale deel van een ECF is geplaatst. Teubner et al. beschreven in 2004 voor het eerst fistuloclyse als therapie voor ECF in een case serie van twaalf patiënten met proximale fistels. Sindsdien hebben een aantal case reports en kleine series de nutritionele werkzaamheid van deze techniek aangetoond. In vergelijking met een vergelijkbaar cohort van patiënten die TEN kregen zonder fistuloclyse, vertoonden patiënten met fistels met een hoge output die werden behandeld met fistuloclyse een aanzienlijke verbetering van de leverfunctie en de voedingsparameters. Fistuloclyse kan bijzonder nuttig zijn bij patiënten die TPN-gerelateerde complicaties ontwikkelen, waaronder infecties, problemen met de veneuze toegang of leverfalen. Complicaties kunnen echter ook optreden, zoals obstructie als de peristaltische activiteit van de dunne darm de fistelkatheter distaal in de dunne darm brengt.
Vitamines en mineralen zijn vaak verarmd bij ECF-patiënten. Tekorten aan vetoplosbare vitamines komen vaak voor, terwijl tekorten aan wateroplosbare vitamines zeldzaam zijn, tenzij de fistel zich in het proximale jejunum bevindt. Omdat vitamine B12 alleen wordt opgenomen in de laatste 50 tot 60 cm van het ileum, is bij veel ECF-patiënten wellicht injecteerbare vitamine B12 nodig. Magnesium wordt vaak verspild bij fistels met een hoge output en moet worden aangevuld met intraveneus magnesiumsulfaat of oraal magnesiumchloride om de enterale absorptie te verbeteren. Tenslotte wordt aanbevolen om zink en vitamine C in hoge doses aan te vullen. Hoewel omega-3 en visolie zijn onderzocht in de intensive care met enig voordeel, zijn deze supplementen nooit geëvalueerd bij ECF-patiënten en worden ze niet routinematig gebruikt.
Operatieve overwegingen
Het percentage spontane ECF-sluitingen varieert in de literatuur tussen 15 en 75%. Dit brede scala aan sluitingspercentages weerspiegelt waarschijnlijk verschillen in patiëntenpopulaties en institutionele praktijkpatronen. De kans op spontane sluiting van fistels na 4 weken is aanzienlijk kleiner; slechts 10% van de fistels sluit na 2 maanden. Omdat het percentage spontane ECF-sluitingen laag is, is chirurgisch ingrijpen vaak de enige definitieve strategie.
De beslissing om een ECF te opereren moet echter niet te licht worden opgevat, aangezien het recidiefpercentage na verwijdering van de ECF varieert van 13 tot 34%. Hoewel de principes van chirurgisch ingrijpen voor ECF veel van de kernprincipes van algemene chirurgie omvatten, is het tijdstip van opereren misschien wel de belangrijkste factor om te overwegen. Fazioet al toonden het belang aan van verwachtingsvol management bij de zorg voor patiënten met ECF. Wanneer de operatie minder dan 6 weken na het tijdstip van ECF-vorming plaatsvond, bedroeg de mortaliteit meer dan 20%. Door de operatie echter meer dan 6 weken uit te stellen, daalde de mortaliteit tot 11%.Bovendien leidt een vroege operatie mogelijk tot een verhoogd recidiefrisico. In een serie van Lynch et al. hadden patiënten die tussen 2 en 12 weken aan ECF-vorming werden geopereerd een recidiefpercentage van 28%, terwijl een vertraging van meer dan 12 weken dit percentage tot 15% deed dalen. Tabel 3 laat zien hoe lang deskundige auteurs adviseren te wachten alvorens een operatieve ingreep te overwegen voor een niet-genezende ECF.
Operatief beheer dient alleen te worden nagestreefd met de volledige investering en het begrip van zowel patiënt als chirurg. ECF-behandelingen zijn lange, technisch uitdagende gevallen met het risico van aanzienlijke complicaties. Gezien het feit dat 36% van de terugkerende fistels het gevolg zijn van verwondingen die tijdens de ECF-sluitingsoperatie zijn ontstaan, moet tijdens de lysis van verklevingen grote zorgvuldigheid worden betracht om onbedoeld letsel van de gezonde darm te voorkomen. Behandeling van de fistelvormige darm moet altijd een darmresectie en een primaire astomose omvatten. Te veel of te grote resectie van de fistel leidt steevast tot een hoger recidief (36% vs. 16%).
Conclusie
Entero cutane fistels vormen een van de meest uitdagende complicaties waarmee de algemeen chirurg wordt geconfronteerd. Het gebruik van een zorgvuldige, systematische en patiëntgerichte benadering zal helpen om de klinische resultaten zo succesvol mogelijk te maken. Ondanks de consistentie van de principes van ECF-management bij alle patiënten, is elke fistel uniek en wordt het management ervan voor een groot deel bepaald door de output, de locatie en de co-morbiditeiten van de patiënt. Chirurgische en institutionele ervaring onderstreept het belang van uitgestelde interventie. Hoewel zowel chirurgen als patiënten een sterke wens kunnen hebben om over te gaan tot chirurgische sluiting, zijn patiënten het meest gebaat bij een niet-operatieve behandeling van ten minste 6 maanden. Uiteindelijk vereist de zorg op lange termijn van ECF-patiënten een multidisciplinaire aanpak, vaak gecoördineerd door de chirurg.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. Een 11-jarige ervaring met enterocutane fistels. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Behandeling van enterocutane fistels: 30 jaar klinische ervaring. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Management of enterocutaneous fistulas: A review of 132 cases. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Review of 404 patients with gastrointestinal fistulas. Impact van parenterale voeding. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Seven-year experience of enterocutaneous fistula with univariate and multivariate analysis of factors associated with healing: development of a validated scoring system. Colorectal Dis. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. Optimalisering van de behandeling van bovenste gastro-intestinale fistels. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Voeding en beheer van enterocutane fistels. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Classification and pathophysiology of enterocutaneous fistulas. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. De pathofysiologie van enterocutane fistels. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM. Enterocutaneous fistula: are treatments improving? Surgery. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Systematic management of postoperative enterocutaneous fistulas: factors related to outcomes. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. A systematic literature review on the use of vacuum assisted closure for enterocutaneous fistula. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. Een multivariaat model om prognostische factoren te bepalen bij gastro-intestinale fistels. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. High-output external fistulae of the small bowel: management with continuous enteral nutrition. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Historical perspectives in the care of patients with enterocutaneous fistula. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Metabolic support of the enterocutaneous fistula patient. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Enterocutane fistelcomplicatie bij trauma laparotomie: A major resource burden. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Three years’ experience with an intestinal failure unit. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Enteric fistulas: principles of management. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Enterocutane Fistels: Bewezen Strategieën en Updates. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Summary of best practice recommendations for management of enterocutaneous fistulae from the Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Current management of enterocutaneous fistula. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Management of Intestinal Fistulas. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Role of somatostatin-14 and its analogues in the management of gastrointestinal fistulae: clinical data. Gut. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Treatment of high-output enterocutaneous fistulas with a vacuum-compaction device. Een ervaring van tien jaar. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr., Williams GM, Welch CE. External fistulas arising from the gastro-intestinal tract. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Metabolic and nutritional support of the enterocutaneous fistula patient: a three-phase approach. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Preoperative serum albumin level as a predictor of operative mortality and morbidity: results from the National VA Surgical Risk Study. Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Factors predictive of recurrence and mortality after surgical repair of enterocutaneous fistula. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract. 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. Can intravenous feeding as the sole means of nutrition support growth in the child and restore weight loss in an adult? Een bevestigend antwoord. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enterale versus parenterale voeding bij kritisch zieke patiënten: een geactualiseerde systematische review en meta-analyse van gerandomiseerde gecontroleerde trials. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. Fistuloclyse kan parenterale voeding succesvol vervangen in de voedingsondersteuning van patiënten met enterocutane fistels. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloclysis: case report and literature review. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. Fistuloclyse verbetert de leverfunctie en voedingsstatus bij patiënten met een hoger gelegen enterische fistel. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Beheer van enterocutane fistels. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. Surgical management of high output enterocutaneous fistulae: a 24-year experience. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Operative surgery for enterocutaneous fistula. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Clinical outcome and factors predictive of recurrence after enterocutaneous fistula surgery. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Outcome of 132 consecutive reconstructive operations for intestinal fistula–staged operation without primary anastomosis improved outcome in retrospective analysis. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Management of external gastrointestinal fistulas. Ann Surg. 1978;188:460-7.