In de celgemedieerde tak van de adaptieve immuunrespons worden korte peptiden gebonden door major histocompatibility complex (MHC) klasse I en klasse II moleculen en gepresenteerd aan het celoppervlak waar ze worden herkend door de antigeenreceptoren van T-lymfocyten. Binding van een T-celreceptor (TCR) die een bepaald MHC-peptidecomplex herkent, induceert naïeve lymfocyten om zich te differentiëren in effectorcellen (cytotoxische en helper T-cellen) die geïnfecteerde gastheercellen vernietigen of de antilichaamproductie stimuleren, en geheugencellen die beschermende immuniteit bieden tegen herinfectie.
Structuur en functie van MHC-moleculen
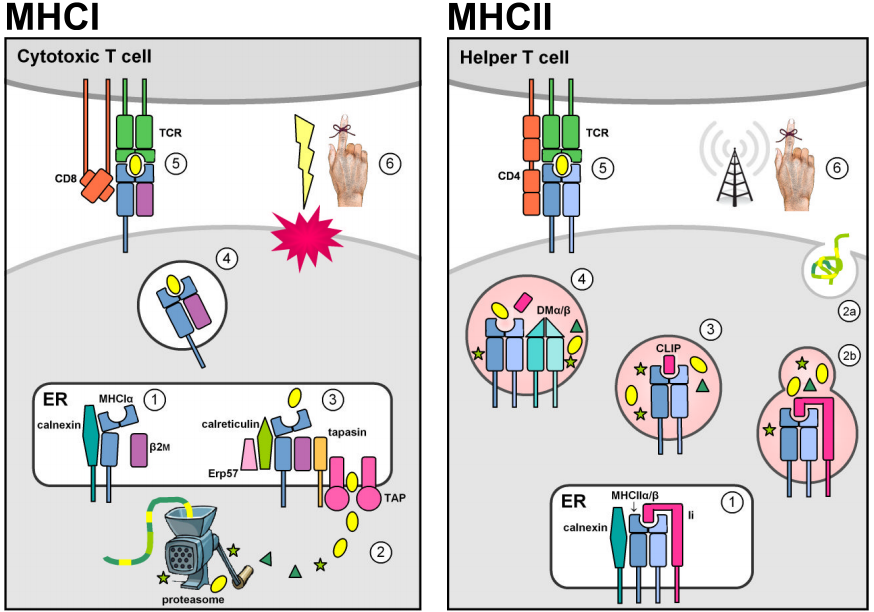
Twee multigene families die zich binnen de MHC-genomische regio bevinden, coderen antigeen-bindende moleculen die vreemde peptiden aan het celoppervlak presenteren. In werkelijkheid presenteren MHC-moleculen ook zelfafgeleide peptiden. Negatieve thymische selectie tegen autoreactieve T-cellen verhindert echter dat MHC-zelf-peptidecomplexen een immuunrespons uitlokken. MHC klasse I moleculen komen tot expressie op de meeste cellen met een celkern en bevatten typisch endogene peptiden die afkomstig zijn van intracellulaire pathogenen die zich in het cytosol vermenigvuldigen (b.v. virussen). Cytosolische eiwitten worden door het proteasoom afgebroken tot korte peptidefragmenten, die eerst naar het endoplasmatisch reticulum (ER) worden getransporteerd door de ATP-afhankelijke transporters TAP1 & 2 voor het laden van MHCI, en vervolgens naar het celoppervlak voor presentatie aan circulerende cytotoxische CD8+ T-cellen, die apoptose en lysis van de geïnfecteerde doelcel moeten induceren. (Figuren zijn aangepast van Murphy et al. (2008) Figs. 3.12, 3.25, 5.5, & 5.11.)
Constitutieve expressie van MHC klasse II loci is beperkt tot antigeen-presenterende cellen van het immuunsysteem (APC’s, bv. macrofagen, dendritische cellen, en B-lymfocyten). MHCII-moleculen worden gestabiliseerd en kunnen geen antigeen binden wanneer zij in het ER verblijven door associatie met de klasse II invariante keten (Ii, of CD74), en worden dan van de standaard secretorische route omgeleid naar de endocytische route. Daar komen zij in aanraking met peptiden afkomstig van pathogenen die zich in intracellulaire vesikels repliceren of van extracellulaire pathogenen en eiwitten die de cel worden binnengebracht. Stabiele peptide binding wordt gekatalyseerd door het niet-klassieke MHCII DMα/β dimeer, en maakt het mogelijk dat MHCII-peptide complexen ontsnappen aan de endocytische route voor presentatie aan het celoppervlak. Herkenning door CD4+ T-cellen activeert de doel-gastheercel om antibacteriële mechanismen te stimuleren (in macrofagen) of om antilichaamproductie en de humorale immuunrespons op gang te brengen.
Structurele overeenkomsten tussen MHCI- en MHCII-moleculen weerspiegelen waarschijnlijk hun afstamming van een gemeenschappelijke voorouder. Volgroeide MHC-moleculen zijn type I integrale membraanglycoproteïnen die bestaan uit een peptidebindende groef en immunoglobulineachtige, transmembrane en cytoplasmatische domeinen. De extracellulaire delen van MHC-moleculen bestaan uit twee membraandistrictale domeinen die samen een peptidebindende holte vormen die wordt begrensd door twee onderbroken α-helixen die rusten op een antiparallelle β-blad, en twee membraan-proximale immunoglobulineachtige (Ig-achtige) domeinen die deelnemen aan CD4- en CD8-kernceptorbinding.
Ondanks deze structurele overeenkomsten worden de eiwitsubeenheden voor klasse I- en II-moleculen verschillend gecodeerd. MHCI-moleculen zijn heterodimeren die worden gevormd door een niet-scheidende associatie tussen een MHCIα-zware keten en β2-microglobuline (β2m), dat wordt gecodeerd door een grotendeels invariante locus die buiten de MHC-genomische regio ligt. De zware keten levert zowel de peptide-bindende spleet als één van de Ig-achtige domeinen, terwijl β2m slechts een tweede Ig-achtig gebied levert dat een transmembraananker ontbeert. MHC klasse II moleculen zijn heterodimeren die worden gevormd door de niet-scheidende associatie van een α- en een β-keten, die beide bijdragen aan enkele peptidebindende en membraanverankerde Ig-achtige domeinen, en die elk worden getranscribeerd vanuit een afzonderlijke locus die typisch binnen de MHC-regio wordt gevonden.
MHC-genfamilieleden kunnen verder worden onderverdeeld in klassieke of niet-klassieke loci, naast niet-functionele pseudogenen. Klassieke MHC Ia loci komen op grote schaal tot expressie en worden doorgaans geassocieerd met een hoge sequentievariabiliteit en positieve selectie die inwerkt op substituties in peptide-bindende regio (PBR) residuen. Niet-klassieke MHC Ib loci komen daarentegen minder tot expressie of hebben een beperkte weefseldistributie, een lager polymorfisme en kunnen beperkte of gewijzigde functies hebben. Voor klasse II genen verwijst “klassiek” gewoonlijk naar alle antigeen-presenterende loci, terwijl de term “niet-klassiek” gereserveerd is voor genen zoals DMα/β die bijkomende rollen vervullen in de antigeen-presentatie pathway. Hoewel deze functionele categorisering van genfamilieleden een nuttig werkwoordenboek biedt, is de grens tussen klassieke en niet-klassieke loci in de praktijk niet altijd duidelijk en sommige niet-klassieke MHCI loci zijn polymorf, komen op grote schaal tot expressie, of binden peptide liganden op de traditionele manier van klassieke genen.
Extreem polymorfisme op populatieniveau en bewijs van balancerende selectie geven aan dat aanzienlijke allelische variatie van MHC genen waarschijnlijk nodig is om een gevarieerd assemblage van ziekteverwekkers te herkennen en erop te reageren. Ondanks uitgebreide gen duplicatie in sommige soorten, brengen individuen echter slechts een matig aantal klassieke MHC loci tot expressie en wordt er ook een terugkeer naar disomische overerving waargenomen in sommige polyploïde Xenopus soorten. Beperkingen op intra-individuele MHC variatie (tenminste voor sterk tot expressie komende klassieke loci) worden verondersteld een functionele afweging te weerspiegelen tussen het vergroten van het allel-repertoire om een grotere variëteit aan pathogene peptiden te presenteren en de daarmee gepaard gaande vermindering van het T-cel repertoire dat nodig zou zijn om de zelftolerantie in stand te houden. Individuele MHC-moleculen moeten daarom in staat zijn tot permissieve peptidebinding om een breed scala van vreemde antigenen adequaat te kunnen herkennen. Het is echter ook nodig om stabiele MHC-peptidecomplexen te genereren die lang genoeg blijven bestaan om T-celherkenning mogelijk te maken en die geen peptiden uitwisselen aan het celoppervlak, wat zou kunnen resulteren in de vernietiging van niet-geïnfecteerde cellen. Een dergelijke stabiliteit gaat in het algemeen gepaard met intermoleculaire interacties met hoge affiniteit, en dus beperkend.
MHC moleculen verzoenen deze tegenstrijdige bindingsvereisten door een elegante structurele oplossing: contacten tussen zeer geconserveerde peptide-bindende regio (PBR) residuen van het MHC molecuul en peptide hoofdketen atomen stabiliseren de promiscue binding van de meeste peptide liganden, terwijl polymorfe residuen die de peptide-bindende groef bekleden onregelmatige zakken creëren met verschillende stereochemie die peptide residuen op een volgorde-afhankelijke manier huisvesten. De beperkingen die opgelegd worden door de compartimenten die de zijketen binden, variëren zowel tussen allelen als tussen compartimenten binnen één MHC-molecule. Pockets met strengere bindingsvereisten bieden plaats aan “primaire anker”-peptideresten, terwijl “secundaire ankers” flexibeler zijn in hun bindingsvoorkeuren. Samen bepalen deze specifieke kenmerken het peptidebindingsmotief van een bepaald MHC-allel om selectiviteit te verlenen bij antigeenpresentatie.