ATP, NAD EN FAD
ATP
Cellen gebruiken een molecuul genaamd Adenosinetrifosfaat (of ATP) als energiebron (Zie figuur 2). De fosfaten in deze molecule kunnen energie leveren aan substraten in onze cellen. In onze cellen bestaan enzymen die een fosfaat uit ATP kunnen verwijderen en het aan een ander molecuul – meestal een eiwit – kunnen vastmaken (zie figuur 3). Wanneer dit gebeurt, zeggen we dat het eiwit gefosforyleerd is. Beschouw het derde fosfaat als een klein zakje energie. Wanneer het wordt overgedragen aan een eiwit, kan deze energie worden gebruikt om iets te doen. Bijvoorbeeld, in figuur 3 verandert het eiwit van vorm wanneer het gefosforyleerd wordt. Wanneer eiwitten van vorm veranderen, noemen we dit vaak een conformationele verandering van de eiwitstructuur. Er zijn veel eiwitten in het lichaam die een fosfaat uit ATP gebruiken om een conformatieverandering teweeg te brengen. Deze verandering van de eiwitvorm maakt uiteindelijk dingen mogelijk als spiersamentrekking, celmobiliteit, membraantransport en enzymactiviteit. Cellen en leven bestaan alleen als er een constante en constante aanvoer van ATP beschikbaar is.
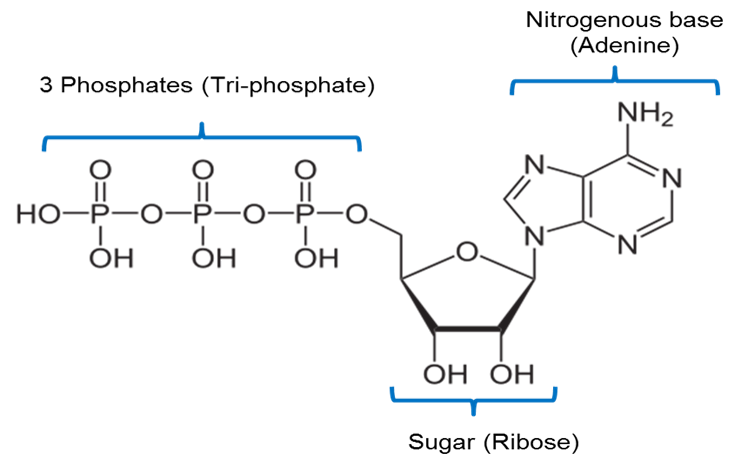
Afbeelding gemaakt door JS at BYU Idaho F2013.
De bovenstaande afbeelding is een weergave van de chemische structuur van ATP. ATP bevat een stikstofhoudende basis, adenine genaamd, die is verbonden met een 5-koolstof suiker, ribose genaamd, en 3 fosfaatgroepen.
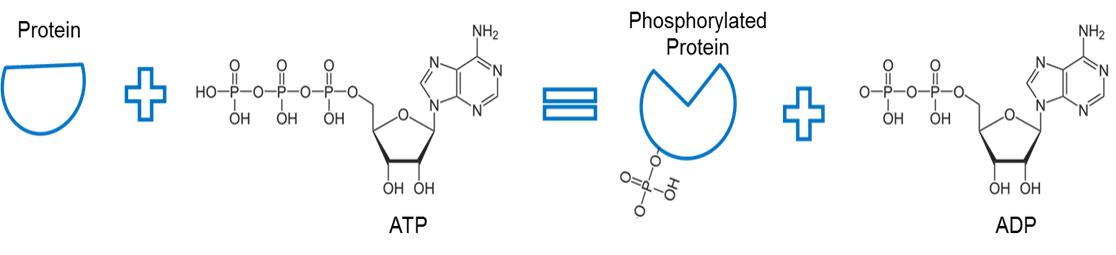
Afbeelding gemaakt door JS at BYU Idaho F2013.
ATP wordt gebruikt om een eiwit te fosforyleren. Een enzym, kinase genaamd (niet afgebeeld) verwijdert een fosfaat uit ATP en vergemakkelijkt de binding tussen het fosfaat en een ander eiwit. De binding van een fosfaat aan een eiwit op deze manier wordt fosforylering genoemd. De fosfaatbinding met het eiwit heeft een hogere energie. Merk op dat fosforylering deze energie gebruikt om een conformationele verandering van de eiwitvorm te veroorzaken.
NAD en FAD
Nicotinamide Adenine Dinucleotide (NAD) en Flavin Adenine Dinucleotide (FAD) zijn co-enzymen die betrokken zijn bij omkeerbare oxidatie- en reductiereacties. Vaak wordt gezegd dat deze verbindingen elektronendragers zijn omdat zij elektronen accepteren (gereduceerd worden) tijdens katabole stappen in de afbraak van organische moleculen zoals koolhydraten en lipiden. Vervolgens kunnen deze gereduceerde co-enzymen deze elektronen afstaan aan een andere biochemische reactie die gewoonlijk betrokken is bij een proces dat anabool is (zoals de synthese van ATP).
NAD+ / NADH
Nicotinamide Adenine Dinucleotide in zijn geoxideerde toestand wordt NAD+ genoemd, nadat het is gereduceerd (of elektronen accepteert) wordt het NADH genoemd. Zie figuur 4 voor een moleculaire illustratie. De vitamine Niacine (ook B3 genoemd) wordt gebruikt om deze verbinding af te leiden. Niacine levert de organische ringstructuur die direct deelneemt aan de overdracht van een waterstofatoom en 2 elektronen. NAD+ wordt vaak aangetroffen in combinatie met een “dehydrogenase”-enzym. Een dehydrogenase reactie verwijdert twee waterstofatomen; één als een hydride (:H-) (een hydride is een waterstofatoom met 2 elektronen) en één als een waterstofkation (H+) (en natuurlijk heeft een waterstofkation geen elektronen). Het hydride bindt zich met NAD+ en creëert een gereduceerde verbinding van Nictinamide Adenine Dinucleotide (NADH). Het tweede waterstofatoom (H+) komt vrij in oplossing zie figuur 4.
Als je de reacties voor metabolisme onderzoekt, zoek dan naar reacties die NADH opleveren. NADH is belangrijk omdat het de hydrogenen en elektronen die het oppikt, levert aan biochemische processen die de elektronen en hydrogenen kunnen gebruiken om ATP te maken.
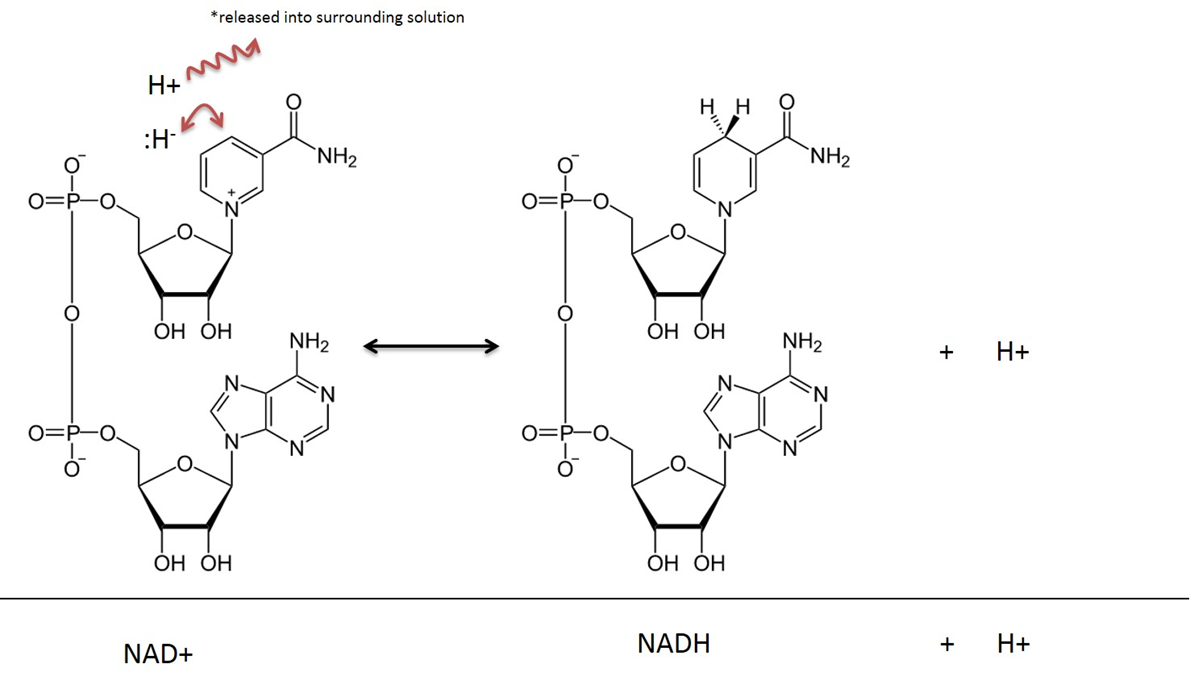
Afbeelding gemaakt door JS at BYU Idaho F2013.
In metabolische reacties waarbij NAD betrokken is, worden twee waterstofatomen en twee elektronen uit een substraat verwijderd en overgedragen aan NAD+. NAD+ accepteert een hydride-ion (een waterstof met 2 elektronen) en wordt Nicotinamide Adenine Dinucleotide in de gereduceerde vorm (NADH). Het waterstofkation dat ook bij de reactie wordt gevangen, komt vrij in de omringende oplossing. Vergeet niet dat deze reactie omkeerbaar is.
Bij de uitleg van reacties die in de stofwisseling optreden, wordt gewoonlijk geen rekening gehouden met het in de oplossing vrijkomende H+ en in deze tekst wordt het resultaat van de reductie van NAD gewoon NADH genoemd, in plaats van NADH + H+.
FAD / FADH2
Flavine-adenine-dinucleotide in geoxideerde toestand wordt FAD genoemd. Na reductie wordt het FADH2 genoemd. Zie figuur 5 voor een moleculaire illustratie. De vitamine riboflavine (of B2) wordt gebruikt om deze verbinding af te leiden. Riboflavine levert de ringstructuren die direct zullen deelnemen aan de overdracht van twee waterstofatomen (deze keer elk met één elektron). Net als NAD werkt FAD samen met een “dehydrogenase”-enzym. De reactie verwijdert twee waterstofatomen; elk een proton met één elektron. Beide waterstofatomen binden zich met FAD. Bij deze reactie komt geen H+ vrij, zoals bij de reductie van NAD.
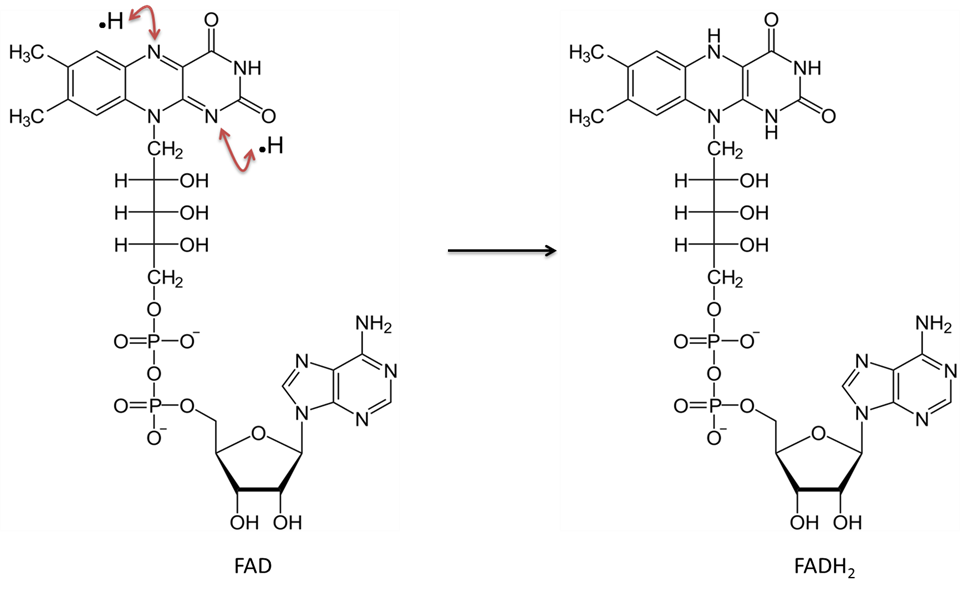
Afbeelding gemaakt door JS van BYU Idaho F2013.
Flavine adenine dinucleotide in de geoxideerde vorm (FAD) accepteert twee waterstofatomen (elk met één elektron) en wordt FADH2.
Als je de reacties voor metabolisme bekijkt, zoek dan naar een reactie die FADH2 oplevert. Net als NADH is FADH2 belangrijk omdat het waterstof en elektronen levert aan biochemische processen die de elektronen en waterstof kunnen gebruiken om ATP te maken.
**U kunt de knoppen hieronder gebruiken om naar de volgende of vorige lezing in deze module te gaan**

