Gelokaliseerd vs. gedelokaliseerd
Het onderscheid tussen “gelokaliseerd” en “gedelokaliseerd” bestaat alleen wanneer we de elektronenbeweging beschrijven aan de hand van de bindingstheorie van Lewis.
Volgens deze theorie vertonen gelokaliseerde elektronen normaal gedrag. Een gelokaliseerd lone paar blijft dicht bij één atoom. Een gelokaliseerd bindingspaar beweegt zich tussen twee atomen.
Resonantiehybriden bevatten noodzakelijkerwijs enkele “abnormale” elektronen. Een lone paar kan sommige bindingskenmerken schijnen te hebben; in plaats van in de buurt van één atoom te blijven, bezoekt het twee atomen. Een bindingspaar kan lijken te bewegen tussen twee verschillende atomenparen. Deze elektronen treden buiten de grenzen die de theorie van Lewis voor hen heeft vastgesteld, en wij beschouwen ze als gedelokaliseerd.
De gemakkelijkste manier om gedelokaliseerde elektronen op te sporen is de elektronenlocaties in twee resonantievormen te vergelijken. Als een paar op de ene plaats in de ene vorm voorkomt, en op een andere plaats in een andere vorm, is het paar gedelokaliseerd.
U kunt gedelokaliseerd gedrag zien in resonantievormen I en II hieronder. Beide vormen bevatten twee gedelokaliseerde elektronenparen. Kun je ze vinden? Welk soort elektronenparen zijn in elke structuur gedelokaliseerd?
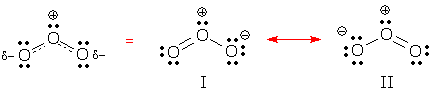
(Antwoord: deze vormen bevatten één gedelokaliseerd bindingspaar en één gedelokaliseerd lone-pair.)
Gelokaliseerde bindingen en gedelokaliseerde ladingen
Het label “gedelokaliseerd” is ook van toepassing op bindingen en ladingen.
Een gedelokaliseerde binding is een binding die in sommige resonantievormen voorkomt, maar in andere niet. Resonantievorm I bevat 2 gelokaliseerde bindingen en 1 gedelokaliseerde binding.
Een gedelokaliseerde lading is een formele lading die in sommige resonantievormen op één atoom voorkomt en in andere vormen op andere atomen. De negatieve lading van Ozon is gedelokaliseerd over de twee uiteinden O, terwijl de positieve lading gelokaliseerd is op het middelste O.