Leerdoelen
- Celnotatie gebruiken om galvanische cellen te beschrijven
- De basiscomponenten van galvanische cellen beschrijven
Galvanische cellen, ook wel voltaïsche cellen genoemd, zijn elektrochemische cellen waarin spontane oxidatie-reductiereacties elektrische energie opleveren. Bij het schrijven van de vergelijkingen is het vaak handig om de oxidatiereductiereacties te scheiden in halfreacties om het in evenwicht brengen van de totale vergelijking te vergemakkelijken en de eigenlijke chemische omzettingen te benadrukken.
Bedenk wat er gebeurt als een schoon stuk kopermetaal in een oplossing van zilvernitraat wordt geplaatst (figuur 1). Zodra het kopermetaal wordt toegevoegd, begint zich zilvermetaal te vormen en komen er koperionen in de oplossing. De blauwe kleur van de oplossing uiterst rechts wijst op de aanwezigheid van koperionen. De reactie kan worden opgesplitst in twee halfreacties. Halfreacties scheiden de oxidatie van de reductie, zodat ze elk afzonderlijk kunnen worden beschouwd.
De vergelijking voor de reductiehalfreactie moest verdubbeld worden, zodat het aantal elektronen “gewonnen” bij de reductiehalfreactie gelijk was aan het aantal elektronen “verloren” bij de oxidatiehalfreactie.

Galvanische of voltaïsche cellen zijn spontane elektrochemische reacties waarbij de halfreacties worden gescheiden (figuur 2) zodat er stroom kan vloeien door een externe draad. Het bekerglas links in de figuur wordt een halfcel genoemd, en bevat een 1 M oplossing van koper(II)nitraat met een stuk kopermetaal gedeeltelijk ondergedompeld in de oplossing. Het kopermetaal is een elektrode. Het koper ondergaat oxidatie; daarom is de koperelektrode de anode. De anode is met een draad verbonden met een voltmeter en de andere klem van de voltmeter is met een draad verbonden met een zilverelektrode. Het zilver ondergaat reductie; de zilverelektrode is dus de kathode. De halve cel aan de rechterkant van de figuur bestaat uit de zilverelektrode in een 1 M oplossing van zilvernitraat (AgNO3). Op dit punt vloeit er geen stroom, d.w.z. er vindt geen significante verplaatsing van elektronen door de draad plaats omdat de stroomkring open is. De stroomkring wordt gesloten met behulp van een zoutbrug, die de stroom door bewegende ionen geleidt. De zoutbrug bestaat uit een geconcentreerde, niet-reactieve elektrolytoplossing, zoals de in dit voorbeeld gebruikte natriumnitraatoplossing (NaNO3). Terwijl de elektronen van links naar rechts door de elektrode en de draad stromen, gaan de nitraationen (anionen) door de poreuze stop aan de linkerkant in de koper(II)nitraatoplossing. Dit houdt het bekerglas links elektrisch neutraal door de lading van de koper(II)-ionen te neutraliseren die in de oplossing ontstaan als het kopermetaal wordt geoxideerd. Op hetzelfde moment dat de nitraationen naar links bewegen, bewegen natriumionen (kationen) naar rechts, door de poreuze stop, en in de zilvernitraatoplossing rechts. Deze toegevoegde kationen “vervangen” de zilverionen die uit de oplossing zijn verwijderd bij de reductie tot zilvermetaal, waardoor het bekerglas rechts elektrisch neutraal blijft. Zonder de zoutbrug zouden de compartimenten niet elektrisch neutraal blijven en zou er geen stroom van betekenis vloeien. Als de twee compartimenten echter in direct contact staan, is een zoutbrug niet nodig. Op het moment dat de schakeling is voltooid, geeft de voltmeter +0,46 V aan, dit wordt de celpotentiaal genoemd. De celpotentiaal ontstaat wanneer de twee ongelijke metalen met elkaar worden verbonden, en is een maat voor de energie per ladingseenheid die beschikbaar is door de oxidatiereductiereactie. De volt is de afgeleide SI-eenheid voor elektrische potentiaal
In deze vergelijking is A de stroom in ampère en C de lading in coulomb. Merk op dat volt moet worden vermenigvuldigd met de lading in coulomb (C) om de energie in joule (J) te verkrijgen.
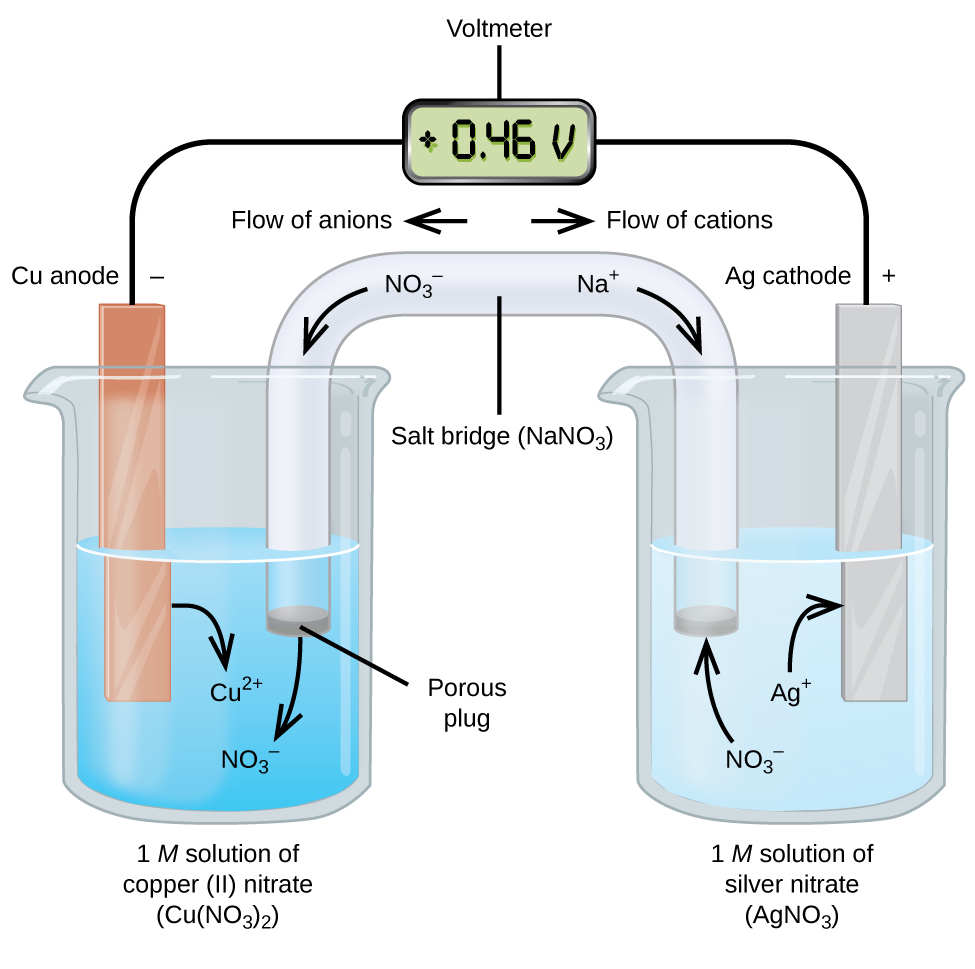
Wanneer de elektrochemische cel op deze manier is geconstrueerd, wijst een positieve celpotentiaal op een spontane reactie en op het feit dat de elektronen van links naar rechts stromen. Er gebeurt veel in figuur 2, dus is het handig om voor dit systeem de zaken samen te vatten:
- Elektronen stromen van de anode naar de kathode: van links naar rechts in de standaard galvanische cel in de figuur.
- De elektrode in de linker halfcel is de anode omdat hier oxidatie optreedt. De naam verwijst naar de stroom van anionen in de zoutbrug ernaartoe.
- De elektrode in de rechter halfcel is de kathode omdat hier reductie optreedt. De naam verwijst naar de stroom van kationen in de zoutbrug ernaartoe.
- Oxidatie vindt plaats aan de anode (de linker halfcel in de figuur).
- Reductie vindt plaats aan de kathode (de rechter halfcel in de figuur).
- De celpotentiaal, +0.46 V, is in dit geval het gevolg van de inherente verschillen in de aard van de materialen die worden gebruikt om de twee halfcellen te maken.
- De zoutbrug moet aanwezig zijn om de stroomkring te sluiten (voltooien) en zowel een oxidatie als een reductie moeten optreden om stroom te laten vloeien.
Er zijn veel mogelijke galvanische cellen, dus wordt meestal een stenografische notatie gebruikt om ze te beschrijven. De celnotatie (soms ook celdiagram genoemd) geeft informatie over de verschillende soorten die bij de reactie betrokken zijn. Deze notatie werkt ook voor andere soorten cellen. Een verticale lijn, │, geeft een fasegrens aan en een dubbele lijn, ‖, de zoutbrug. Informatie over de anode wordt links geschreven, gevolgd door de anodeoplossing, dan de zoutbrug (indien aanwezig), dan de kathodeoplossing, en ten slotte informatie over de kathode rechts. De celnotatie voor de galvanische cel in figuur 2 is dan
Merk op dat spectatorionen niet zijn opgenomen en dat de eenvoudigste vorm van elke halfreactie is gebruikt. Indien bekend, zijn de beginconcentraties van de verschillende ionen meestal opgenomen.
Een van de eenvoudigste cellen is de Daniell-cel. Men kan deze batterij construeren door een koperelektrode op de bodem van een pot te plaatsen en het metaal te bedekken met een kopersulfaatoplossing. Bovenop de kopersulfaatoplossing drijft men een zinksulfaatoplossing; vervolgens plaatst men een zinkelektrode in de zinksulfaatoplossing. Door de koperelektrode met de zinkelektrode te verbinden kan er een elektrische stroom vloeien. Dit is een voorbeeld van een cel zonder zoutbrug, en ionen kunnen over het grensvlak tussen de twee oplossingen stromen.
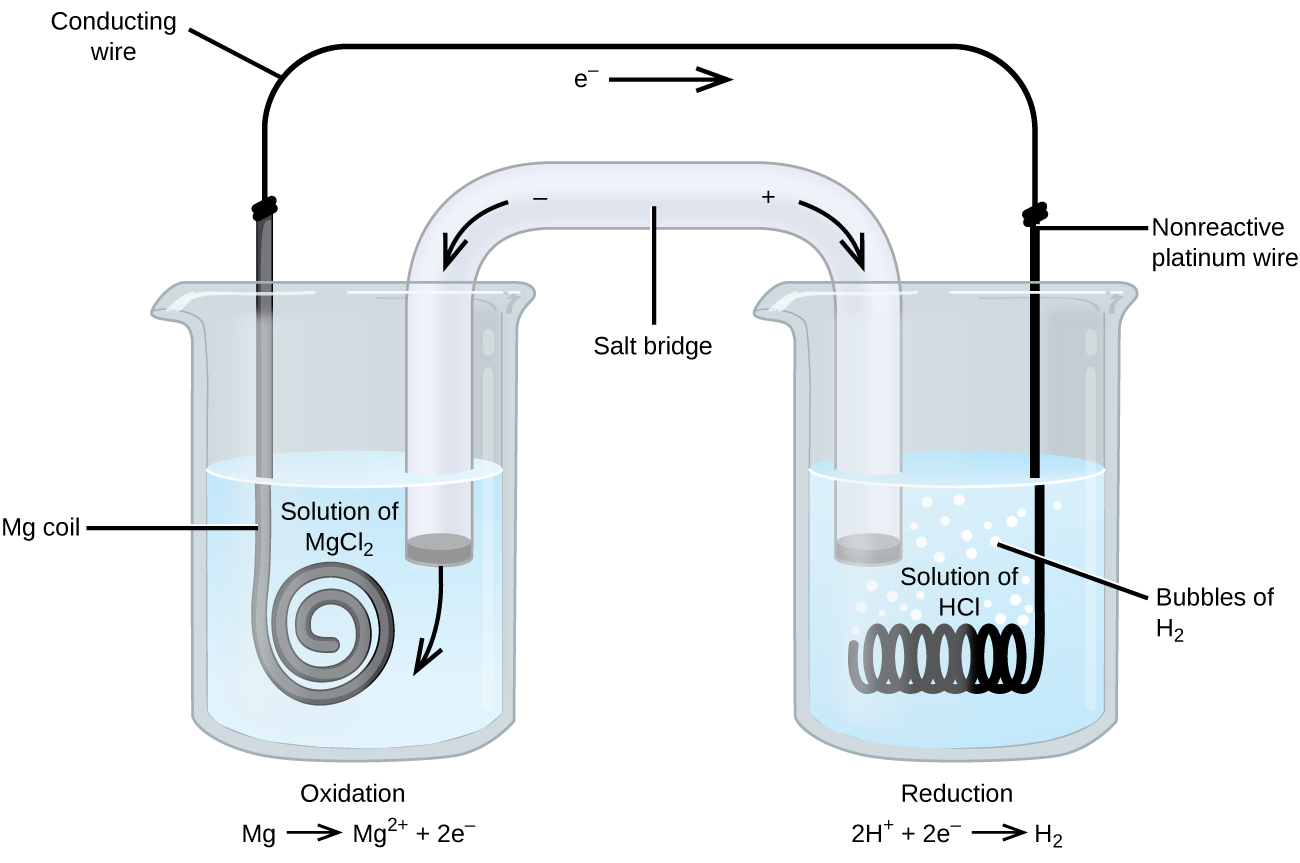
Bij sommige oxidatiereductiereacties zijn soorten betrokken die slechte geleiders van elektriciteit zijn, en daarom wordt een elektrode gebruikt die niet aan de reacties deelneemt. Vaak bestaat de elektrode uit platina, goud of grafiet, die alle inert zijn voor vele chemische reacties. Een dergelijk systeem is afgebeeld in figuur 3. Magnesium ondergaat oxidatie aan de anode links in de figuur en waterstofionen ondergaan reductie aan de kathode rechts. De reactie kan worden samengevat als
De cel gebruikte een inerte platina draad voor de kathode, dus de celnotatie is
De magnesiumelektrode is een actieve elektrode omdat hij deelneemt aan de oxidatie-reductiereactie. Inerte elektroden, zoals de platina elektrode in figuur 3, nemen niet deel aan de oxidatiereductiereactie en zijn aanwezig zodat er stroom door de cel kan lopen. Platina of goud zijn in het algemeen goede inerte elektroden, omdat zij chemisch niet reactief zijn.
Voorbeeld 1
Celnotatie gebruiken
Bedenk een galvanische cel bestaande uit
Schrijf de oxidatie- en reductiehalfreacties en schrijf de reactie met behulp van celnotatie. Welke reactie vindt plaats aan de anode? De kathode?
Oplossing
Als je kijkt, wordt Cr geoxideerd als drie elektronen verloren gaan en Cr3+ wordt gevormd, en Cu2+ wordt gereduceerd als het twee elektronen krijgt en Cu wordt gevormd. Het in evenwicht brengen van de ladingen geeft
Celnotatie gebruikt de eenvoudigste vorm van elk van de vergelijkingen, en begint met de reactie aan de anode. Er zijn geen concentraties gespecificeerd, dus: \text{Cr}(s){\mid}\text{Cr}^{3+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s). De oxidatie vindt plaats aan de anode en de reductie aan de kathode.
Celnotatie gebruiken
Bedenk een galvanische cel bestaande uit
Schrijf de oxidatie- en reductiehalfreacties en schrijf de reactie met behulp van celnotatie. Welke reactie vindt plaats aan de anode? De kathode?
Oplossing
Zo te zien ondergaat Fe2+ oxidatie wanneer het één elektron verliest en Fe3+ vormt, en MnO4- wordt gereduceerd wanneer het vijf elektronen krijgt en Mn2+ vormt. Het in evenwicht brengen van de lading geeft
Celnotatie gebruikt de eenvoudigste vorm van elk van de vergelijkingen, en begint met de reactie aan de anode. Het is noodzakelijk een inerte elektrode, zoals platina, te gebruiken, omdat er geen metaal aanwezig is om de elektronen van de anode naar de kathode te geleiden. Er zijn geen concentraties gespecificeerd, dus: \text{Pt}(s){\mid}\text{Fe}^{2+}(aq)\text{,}\;\text{Fe}^{3+}(aq){\parallel}\text{MnO}_4^{\;\;-}(aq)\text{,}\;\text{H}^{+}(aq)\text{,}\;\text{Mn}^{2+}(aq){\mid}\text{Pt}(s). De oxidatie vindt plaats aan de anode en de reductie aan de kathode.
Check Your Learning
Gebruik de celnotatie om de galvanische cel te beschrijven waarin koper(II)-ionen worden gereduceerd tot kopermetaal en zinkmetaal wordt geoxideerd tot zinkionen.
Antwoord:
Vanuit de in het probleem gegeven informatie:
begin{array}{lr @{}longrightarrow{}} l} &>Tekst{anode;(oxidatie):} & \text{Zn}(s) & \text{Zn}^{2+}(aq)\;+;2\text{e}^{-} \\ kathode;(reductie):} & \text{Cu}^{2+}(aq)\;+\;2\text{e}^{-} & \text{Cu}(s) \hline \\text{overall:} & \text{Zn}(s)^{2+}(aq) & \text{Zn}^{2+}(aq)\;+;\text{Cu}(s) \eind{array}
Gebruik makend van celnotatie:
\text{Zn}(s){\mid}\text{Zn}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s).
Elektrochemische cellen bestaan gewoonlijk uit twee halfcellen. De halfcellen scheiden de oxidatiehalfreactie van de reductiehalfreactie en maken het mogelijk stroom te laten lopen door een externe draad. Eén halfcel, die in een figuur gewoonlijk aan de linkerkant wordt afgebeeld, bevat de anode. Oxidatie vindt plaats aan de anode. De anode is verbonden met de kathode in de andere halfcel, die in een figuur vaak aan de rechterkant wordt afgebeeld. Reductie vindt plaats aan de kathode. Het toevoegen van een zoutbrug maakt het circuit compleet zodat er stroom kan vloeien. Anionen in de zoutbrug stromen naar de anode en kationen in de zoutbrug stromen naar de kathode. De beweging van deze ionen maakt de kringloop rond en houdt elke halfcel elektrisch neutraal. Elektrochemische cellen kunnen worden beschreven met behulp van celnotatie. In deze notatie staat informatie over de reactie aan de anode links en informatie over de reactie aan de kathode rechts. De zoutbrug wordt weergegeven door een dubbele lijn, ‖. De vaste, vloeibare of waterige fasen binnen een halfcel worden gescheiden door een enkele lijn, │. De fase en de concentratie van de verschillende soorten worden achter de naam van de soort vermeld. Elektroden die deelnemen aan de oxidatiereductiereactie worden actieve elektroden genoemd. Elektroden die niet deelnemen aan de oxidatiereductiereactie, maar er wel zijn om stroom te laten vloeien, worden inerte elektroden genoemd. Inerte elektroden worden vaak gemaakt van platina of goud, die bij veel chemische reacties onveranderd blijven.
Chemistry End of Chapter Exercises
- Schrijf de volgende evenwichtige reacties met behulp van celnotatie. Gebruik platina als inerte elektrode, indien nodig.
(a) \text{Mg}(s)\;+\;\text{Ni}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Ni}(s)
(b) 2\text{Ag}^{+}(aq)\;+\;\text{Cu}(s)\;{\longrightarrow}\;\text{Cu}^{2+}(aq)\;+\;2\text{Ag}(s)
(c) \text{Mn}(s)\;+\;\text{Sn(NO}_3)_2(aq)\;{\longrightarrow}\;\text{Mn(NO}_3)_2(aq)\;+\;\text{Au}(s)
(d) 3\text{CuNO}_3(aq)\;+\;\text{Au(NO}_3)_3(aq)\;{\longrightarrow}\;3\text{Cu(NO}_3)_2(aq)\;+\;
- Bepaal in de volgende celnotaties de geoxideerde en gereduceerde stoffen en het oxidatie- en reductiemiddel, zonder de evenwichtsreacties op te schrijven.
(a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s)
(b)
- Voor de celnotaties in het vorige probleem, schrijf de bijbehorende evenwichtige reacties.
- Balanceer de volgende reacties en schrijf de reacties met behulp van de celnotatie. Negeer eventuele inerte elektroden, want die maken nooit deel uit van de halfreacties.
(a) \text{Al}(s)\;+\;\text{Zr}^{4+}(aq)\;{\longrightarrow}\;\text{Al}^{3+}(aq)\;+\;\text{Zr}(s)
(b) \text{Ag}^{+}(aq)\;+\;\text{NO}(g)\;{\longrightarrow}\;\text{Ag}(s)\;+\;\text{NO}_3^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(acidic\;solution)}
(c) \text{SiO}_3^{\;\;2-}(aq)\;+\;\text{Mg}(s)\;{\longrightarrow}\;\text{Si}(s)\;+\;\text{Mg(OH)}_2(s)\;\;\;\;\;\;\;\text{(basic\;solution)}
(d) \text{ClO}_3^{\;\;-}(aq)\;+\;\text{MnO}_2(s)\;{\longrightarrow}\;\text{Cl}^{\;\;-}(aq)\;+\;\text{MnO}_4^{\;\;-}(aq)\;\;\;\;\;\;
- Benoem de geoxideerde en gereduceerde stoffen en de oxiderende en reducerende stoffen voor alle reacties in het vorige probleem.
- Gebruik uit de gegeven informatie de celnotatie om de volgende systemen te beschrijven:
(a) In de ene halfcel vormt een oplossing van Pt(NO3)2 Pt-metaal, terwijl in de andere halfcel Cu-metaal in een Cu(NO3)2-oplossing gaat met alle concentraties van het oplosmiddel 1 M.
(b) De kathode bestaat uit een goudelektrode in een 0,55 M Au(NO3)3-oplossing en de anode is een magnesiumelektrode in 0.75 M Mg(NO3)2 oplossing.
(c) De ene halfcel bestaat uit een zilverelektrode in een 1 M AgNO3 oplossing, en in de andere halfcel wordt een koperelektrode in 1 M Cu(NO3)2 geoxideerd.
- Waarom is een zoutbrug nodig in galvanische cellen zoals die in figuur 2?
- Een actieve (metaal)elektrode bleek massa te verliezen naarmate de oxidatiereductiereactie doorgang vond. Maakte de elektrode deel uit van de anode of de kathode? Leg uit.
- Actieve elektroden nemen deel aan de oxidatiereductiereactie. Omdat metalen kationen vormen, zou de elektrode massa verliezen als metaalatomen in de elektrode zouden oxideren en in oplossing zouden gaan. Oxidatie vindt plaats aan de anode.
- De massa van drie verschillende metaalelektroden, elk van een andere galvanische cel, werd bepaald voor en nadat men de stroom, opgewekt door de oxidatiereductiereactie in elke cel, een paar minuten had laten lopen. De eerste metaalelektrode, met het label A, bleek in massa te zijn toegenomen; de tweede metaalelektrode, met het label B, veranderde niet in massa; en de derde metaalelektrode, met het label C, bleek massa te hebben verloren. Doe een beredeneerde gok welke elektroden actief waren en welke inert, en welke de anode(n) en welke de kathode(n) waren.
Glossary
actieve elektrode elektrode die deelneemt aan de oxidatiereductiereactie van een elektrochemische cel; de massa van een actieve elektrode verandert tijdens de oxidatiereductiereactie anode elektrode in een elektrochemische cel waaraan oxidatie plaatsvindt; informatie over de anode wordt genoteerd aan de linkerkant van de zoutbrug in celnotatie kathode-elektrode in een elektrochemische cel waarin reductie optreedt; informatie over de kathode wordt genoteerd aan de rechterkant van de zoutbrug in celnotatie celnotatie stenografische manier om de reacties in een elektrochemische cel weer te geven celpotentiaalverschil in elektrische potentiaal dat ontstaat wanneer ongelijksoortige metalen met elkaar worden verbonden; de drijvende kracht achter de stroom van lading (stroom) in oxidatiereductiereacties galvanische cel elektrochemische cel waarbij een spontane oxidatiereductiereactie optreedt; elektrochemische cellen met positieve celpotentialen; ook wel voltaïsche cel genoemd inerte elektrode elektrode die stroom laat lopen, maar verder niet deelneemt aan de oxidatiereductiereactie in een elektrochemische cel; de massa van een inerte elektrode verandert niet tijdens de oxidatiereductiereactie; inerte elektroden zijn vaak gemaakt van platina of goud omdat deze metalen chemisch niet reactief zijn. voltaïsche cel een andere naam voor een galvanische cel
Oplossingen
Answers to Chemistry End of Chapter Exercises
1. (a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Ni}^{2+}(aq){\mid}\text{Ni}(s); (b) \text{Cu}(s){\mid}\text{Cu}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s); (c) \text{Mn}(s){\mid}\text{Mn}^{2+}(aq){\parallel}\text{Sn}^{2+}(aq){\mid}\text{Sn}(s); (d) \text{Pt}(s){\mid}\text{Cu}^{+}(aq)\text{,\;Cu}^{2+}(aq){\parallel}\text{Au}^{3+}(aq){\mid}\text{Au}(s)
3. (a) \text{Mg}(s)\;+\;\text{Cu}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Cu}(s); (b) 2\text{Ag}^{+}(aq)\;+\;\text{Ni}(s)\;{\longrightarrow}\;\text{Ni}^{2+}(aq)\;+\;2\text{Ag}(s)
5. Geoxideerde stoffen = reductiemiddel: (a) Al(s); b) NO(g); c) Mg(s); en d) MnO2(s); Soorten gereduceerd = oxiderende agens: (a) Zr4+(aq); b) Ag+(aq); c) {SiO}_3^(aq); en d) {ClO}_3^(aq)
7. Zonder de zoutbrug zou de stroomkring open (of verbroken) zijn en zou er geen stroom kunnen lopen. Met een zoutbrug blijft elke halfcel elektrisch neutraal en kan er stroom door de kring lopen.
9. Een actieve (metalen) elektrode bleek aan massa te winnen als men de oxidatiereductiereactie liet doorgaan. Maakte de elektrode deel uit van de anode of de kathode? Leg uit.