Chemguide: Support for CIE A level Chemistry
Wynik nauczania 11.2(f)
Ta wypowiedź dotyczy współczynników podziału.
Zanim przejdziesz dalej, powinieneś znaleźć i przeczytać tę wypowiedź w swojej kopii sylabusa.
Podział
Jeśli masz dwie niemieszające się ciecze, takie jak eter i woda, i wstrząsasz nimi w lejku rozdzielającym, to oczywiście tworzą one dwie warstwy. Eter jest mniej gęsty niż woda, a więc tworzy górną warstwę.
Załóżmy teraz, że wstrząsasz mieszaniną eteru i wody zawierającą substancję, która jest rozpuszczalna w obu tych cieczach. Załóżmy, że substancja ta, X, jest bardziej rozpuszczalna w eterze niż w wodzie.
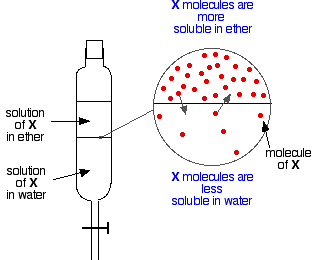
Cząstki X przekroczą granicę między dwiema warstwami cieczy i wkrótce dojdzie do ustanowienia równowagi dynamicznej. Na każdą cząsteczkę, która przejdzie do górnej warstwy, jedna przejdzie z powrotem do dolnej.
Możesz napisać na to równanie:
![]()
![]()
. . i jak w przypadku każdej innej równowagi, można znaleźć stałą równowagi:
![]()
![]()
Tę stałą równowagi nazywa się współczynnikiem podziału i często podaje się jej symbol Kpc.
Podobnie jak inne stałe równowagi, współczynniki podziału są stałe w stałej temperaturze, ale mają też pewne inne ograniczenia. Działają one prawidłowo tylko dla dość rozcieńczonych roztworów, a solute musi być w tej samej formie chemicznej w obu rozpuszczalnikach. Nie może reagować, jonizować się lub asocjować (łączyć się w dimery, na przykład).
Obliczanie współczynnika podziału
Uwaga na jednostki
Zauważ, że współczynnik podziału jest prostym stosunkiem dwóch stężeń. Nie ma znaczenia jakich jednostek stężenia używasz – tak długo jak używasz tych samych na górze i na dole.
Możesz użyć mol dm-3, ale częściej używasz g cm-3 – gramów na centymetr sześcienny.
Technicznie, nawiasy kwadratowe mogą być użyte tylko dla stężenia w mol dm-3, ale Application Support Booklet i schematy oznaczeń CIE używają ich również dla innych jednostek.
Nie jestem na to przygotowany, dlatego będę używał określenia „stężenie X”, a nie tam, gdzie stosowane są niestandardowe jednostki stężenia.
Obliczanie współczynnika podziału
Gdy roztwór 1,00 g X w 100 cm3 wody wytrząsano z 10 cm3 eteru, do warstwy eteru przeniesiono 0,80 g X. Oblicz współczynnik podziału X między eter i wodę.
Jeśli masz obliczyć współczynnik podziału między dwa rozpuszczalniki, stężenie pierwszego wymienionego rozpuszczalnika wchodzi do wyrażenia Kpc. Zatem w tym przypadku:
![]()
![]()
Masz wystarczająco dużo informacji, aby obliczyć oba stężenia w g cm-3.
![]() stężenie X w eterze = 0,80/10 g cm-3
stężenie X w eterze = 0,80/10 g cm-3
Jeśli 0,80 g zostało przeniesione do eteru, 1,00 – 0,80 g = 0.20 g pozostało w wodzie.
![]() stężenie X w wodzie = 0,20/100 g cm-3
stężenie X w wodzie = 0,20/100 g cm-3
Więc:
![]()
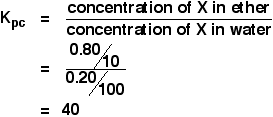
Oczywiście, mógłbyś obliczyć stężenia w eterze i w wodzie jako liczby rzeczywiste, zanim umieścisz je w wyrażeniu. Zrób to tak, jak Ci najwygodniej.
Współczynniki podziału takie jak ten nie mają jednostek – jednostki się znoszą, ponieważ są takie same na górze i na dole.
Obliczenia z wykorzystaniem współczynników podziału
Program nauczania CIE mówi wyraźnie, że powinieneś być w stanie obliczyć współczynnik podziału (innymi słowy, to co właśnie zrobiliśmy). Nie mówi nic o używaniu ich do obliczania innych rzeczy. Te dodatkowe obliczenia są omówione w Application Support Booklet i zostały zadane dwa razy na egzaminach do czerwca 2013 (oba w 2009).
The Coursebook nie zawiera ich (całkiem poprawnie!), ponieważ sylabus nie wspomina o nich, a ta książka została zatwierdzona przez egzaminatorów CIE jako „kompletne i dokładne pokrycie” sylabusa. Czy to oznacza, że CIE nie będzie zadawać więcej pytań w przyszłości? Nie licz na to!
Podstawowy przykład
Użyjemy tego samego przypadku co poprzednio – te same rozpuszczalniki, ten sam X i ten sam współczynnik podziału, który właśnie obliczyliśmy.
Tym razem obliczymy, jaka ilość X zostałaby wyekstrahowana do warstwy eteru, gdybyśmy pierwotny roztwór 1,00 g X w 100 cm3 wody wytrząsali z zaledwie 5 cm3 eteru.
Próbujemy obliczyć masę wyekstrahowanego X. Nazwijmy ją m.
Opracujmy teraz wyrażenie na stężenie roztworu X w eterze.
![]() stężenie X w eterze = m/5 g cm-3
stężenie X w eterze = m/5 g cm-3
Co z wodą? W wodzie pozostanie (1,00 – m) g X. Zatem:
![]() stężenie X w wodzie = (1,00 – m)/100 g cm-3
stężenie X w wodzie = (1,00 – m)/100 g cm-3
Teraz możesz to wszystko ująć w wyrażeniu na współczynnik podziału. Pamiętaj, że obliczyliśmy już współczynnik podziału X między eter i wodę jako 40.
![]()
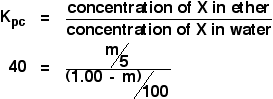
Teraz czeka Cię prosta, ale nieco żmudna algebra:
![]()
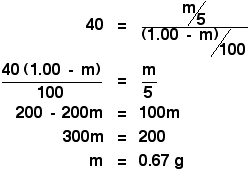
Jeszcze bardziej żmudna!
W oryginalnych obliczeniach, aby znaleźć współczynnik podziału, powiedziano Ci, że jeśli wstrząśniesz oryginalny roztwór 1,00 g X w 100 cm3 wody z 10 cm3 eteru, wyekstrahujesz 0,80 g X.
Wstrząsając go z 5 cm3 eteru, właśnie opracowaliśmy, że wyekstrahujesz 0,67 g X.
To pozostawiłoby 0,33 g X w 100 cm3 wody. Załóżmy, że starannie zachowałeś ten roztwór, a następnie wstrząsnąłeś go drugim świeżym 5 cm3 eteru.
Ile X wyekstrahowałbyś w sumie używając eteru jako dwóch oddzielnych partii 5 cm3 zamiast 10 cm3 za jednym razem?
Nazwijmy masę X wyekstrahowaną przez drugą partię eteru n – abyśmy się nie mylili.
Opracuj wyrażenie na stężenie roztworu X w eterze.
![]() stężenie X w eterze = n/5 g cm-3
stężenie X w eterze = n/5 g cm-3
Co z wodą? Po drugiej ekstrakcji w wodzie pozostanie (0,33 – n) g X. Zatem:
![]() stężenie X w wodzie = (0,33 – n)/100 g cm-3
stężenie X w wodzie = (0,33 – n)/100 g cm-3
Teraz można to wszystko ująć w wyrażeniu na współczynnik podziału X między eter i wodę, tak jak poprzednio.
![]()

To oznacza, że gdybyś połączył dwie partie eteru o objętości 5 cm3, wyekstrahowałbyś łącznie 0,67 + 0,22 g X. To jest 0.89 g.
Początkowo powiedziano ci, że gdybyś zrobił to tylko raz, używając eteru jako pojedynczej partii 10 cm3, wyekstrahowałbyś tylko 0,80 g.
Uzyskasz bardziej wydajną ekstrakcję, dzieląc rozpuszczalnik na mniejsze objętości, jak powyżej.
Tego rodzaju technikę stosujesz podczas przygotowywania niektórych związków organicznych. Wyodrębniasz to, co próbujesz zrobić z jakiegoś nieporządnego roztworu w wodzie tak, że kończy się to w rozpuszczalniku organicznym. Następnie usuwasz rozpuszczalnik przez ostrożną destylację.
CIE zadało pytanie podobne do tego w czerwcu 2009 r. papier 4 Q8. Trzeba było obliczyć wartość współczynnika podziału, a następnie użyć go w dwuetapowej ekstrakcji dokładnie tak, jak powyżej. Obliczenia były warte 4 punkty. Może to być żmudne i (oprócz obliczania współczynnika podziału) nie znajduje się w programie nauczania, ale nie możesz sobie pozwolić na to, żeby tego nie umieć.