Cele nauczania
- Używać notacji ogniwowej do opisu ogniw galwanicznych
- Opisać podstawowe elementy ogniw galwanicznych
Ogniwa galwaniczne, zwane również ogniwami woltaicznymi, są ogniwami elektrochemicznymi, w których w wyniku spontanicznych reakcji utleniania-redukcji powstaje energia elektryczna. Przy pisaniu równań często wygodnie jest rozdzielić reakcje utleniania-redukcji na pół-reakcje, aby ułatwić zbilansowanie ogólnego równania i podkreślić rzeczywiste przemiany chemiczne.
Rozważmy, co się stanie, gdy czysty kawałek metalu miedzianego zostanie umieszczony w roztworze azotanu srebra (Rysunek 1). Natychmiast po dodaniu metalu miedzi zaczyna się tworzyć srebro, a jony miedzi przechodzą do roztworu. Niebieskie zabarwienie roztworu po prawej stronie wskazuje na obecność jonów miedzi. Reakcja ta może być podzielona na dwie półreakcje. Półreakcje oddzielają utlenianie od redukcji, więc każda z nich może być rozpatrywana oddzielnie.
Równanie dla półreakcji redukcji musiało być podwojone, aby liczba elektronów „zdobytych” w półreakcji redukcji była równa liczbie elektronów „utraconych” w półreakcji utleniania.

Ogniwa galwaniczne lub woltaiczne polegają na spontanicznych reakcjach elektrochemicznych, w których pół-reakcje są rozdzielone (Rysunek 2) tak, że prąd może płynąć przez zewnętrzny przewód. Zlewka po lewej stronie rysunku nazywana jest półogniwem i zawiera 1 M roztwór azotanu(V) miedzi(II) z kawałkiem miedzianego metalu częściowo zanurzonym w roztworze. Miedziany metal jest elektrodą. Miedź ulega utlenieniu, dlatego elektroda miedziana jest anodą. Anodę podłączamy przewodem do woltomierza, a drugi koniec woltomierza łączymy przewodem z elektrodą srebrną. Srebro ulega redukcji, dlatego elektroda srebrna jest katodą. Półogniwo po prawej stronie rysunku składa się z elektrody srebrnej umieszczonej w 1 M roztworze azotanu srebra (AgNO3). W tym miejscu nie płynie żaden prąd – to znaczy, nie zachodzi żaden znaczący ruch elektronów przez przewód, ponieważ obwód jest otwarty. Obwód jest zamykany za pomocą mostka solnego, który przenosi prąd z poruszającymi się jonami. Mostek solny składa się ze stężonego, niereaktywnego roztworu elektrolitu, takiego jak roztwór azotanu sodu (NaNO3) użyty w tym przykładzie. Podczas przepływu elektronów z lewej strony na prawą przez elektrodę i drut, jony azotanowe (aniony) przechodzą przez porowaty korek po lewej stronie do roztworu azotanu miedzi(II). Dzięki temu zlewka po lewej stronie pozostaje elektrycznie obojętna, neutralizując ładunek jonów miedzi(II), które powstają w roztworze w wyniku utleniania metalu miedzi. W tym samym czasie, gdy jony azotanowe przemieszczają się w lewo, jony sodu (kationy) przemieszczają się w prawo, przez porowaty korek i do roztworu azotanu srebra po prawej stronie. Te dodane kationy „zastępują” jony srebra, które zostały usunięte z roztworu podczas redukcji do metalu srebra, utrzymując zlewkę po prawej stronie jako elektrycznie obojętną. Bez mostka solnego przedziały nie pozostałyby elektrycznie obojętne i nie płynąłby w nich znaczący prąd. Jeśli jednak obie komory są w bezpośrednim kontakcie, mostek solny nie jest konieczny. W momencie, gdy obwód jest zakończony, woltomierz wskazuje +0,46 V, co nazywamy potencjałem ogniwa. Potencjał ogniwa powstaje w momencie połączenia dwóch niepodobnych do siebie metali i jest miarą energii przypadającej na jednostkę ładunku dostępnego w reakcji utleniania-redukcji. Wolt jest pochodną jednostki SI dla potencjału elektrycznego
W tym równaniu, A jest prądem w amperach, a C ładunkiem w kulombach. Należy zauważyć, że wolty należy pomnożyć przez ładunek w kulombach (C), aby otrzymać energię w dżulach (J).
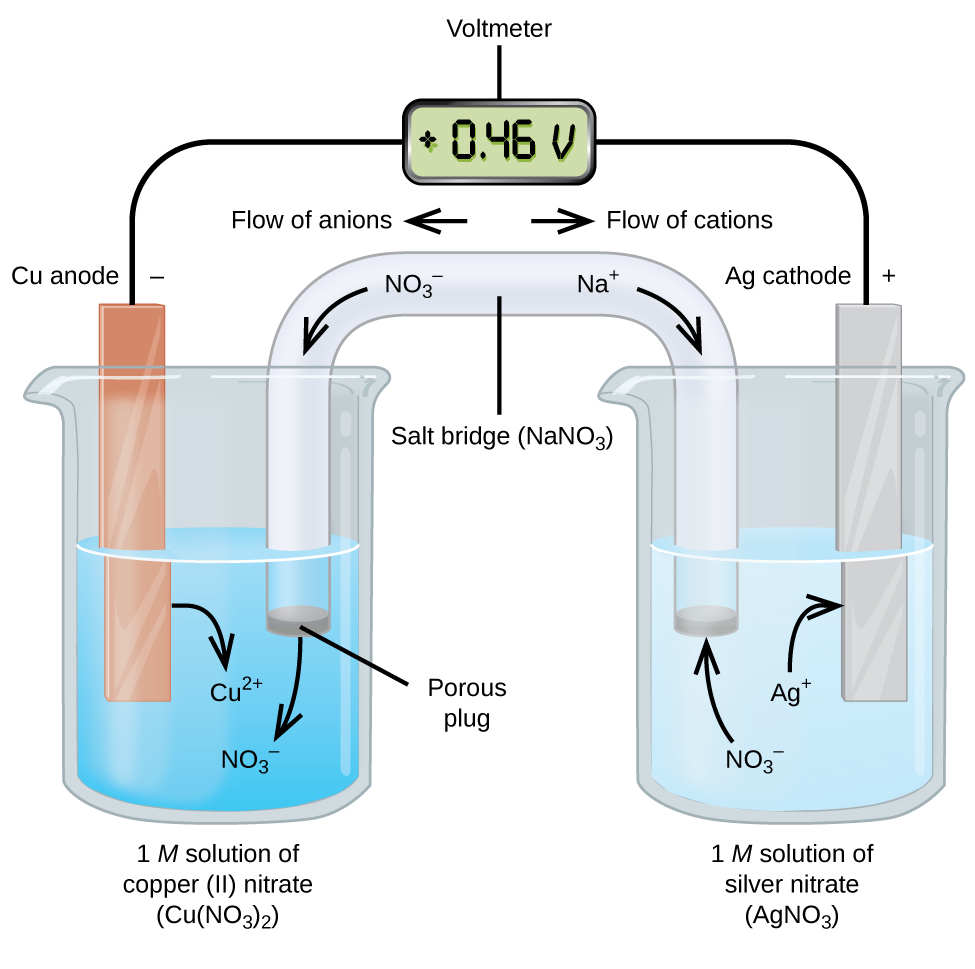
Gdy ogniwo elektrochemiczne jest skonstruowane w ten sposób, dodatni potencjał ogniwa wskazuje na spontaniczną reakcję i na to, że elektrony przepływają z lewej strony do prawej. Na rysunku 2 dużo się dzieje, więc warto podsumować rzeczy dla tego układu:
- Elektrony przepływają od anody do katody: od lewej do prawej w standardowym ogniwie galwanicznym na rysunku.
- Elektroda w lewym półogniwie jest anodą, ponieważ zachodzi tu utlenianie. Nazwa odnosi się do przepływu anionów w mostku solnym w jej kierunku.
- Elektroda w prawym półogniwie jest katodą, ponieważ zachodzi tu redukcja. Nazwa ta odnosi się do przepływu kationów w mostku solnym w jej kierunku.
- Oksydacja zachodzi przy anodzie (lewe półogniwo na rysunku).
- Redukcja zachodzi przy katodzie (prawe półogniwo na rysunku).
- Potencjał ogniwa, +0.46 V, w tym przypadku, wynika z nieodłącznych różnic w naturze materiałów użytych do wykonania dwóch półogniw.
- Mostek solny musi być obecny, aby zamknąć (zakończyć) obwód i zarówno utlenianie, jak i redukcja muszą wystąpić, aby prąd mógł płynąć.
Istnieje wiele możliwych ogniw galwanicznych, więc do ich opisu stosuje się zwykle skróconą notację. Notacja ogniwowa (czasami nazywana schematem ogniwowym) dostarcza informacji o różnych gatunkach biorących udział w reakcji. Zapis ten działa również dla innych typów ogniw. Pionowa linia, │, oznacza granicę faz, a podwójna linia, ‖, mostek solny. Po lewej stronie zapisuje się informacje o anodzie, następnie o roztworze anodowym, potem o mostku solnym (jeśli występuje), potem o roztworze katodowym, a na końcu po prawej stronie informacje o katodzie. Notacja ogniwa dla ogniwa galwanicznego z rysunku 2 jest więc taka
Zauważ, że jony spektatorowe nie są uwzględnione i że użyto najprostszej formy każdej półreakcji. Jeśli znane są początkowe stężenia różnych jonów, są one zazwyczaj uwzględniane.
Jednym z najprostszych ogniw jest ogniwo Daniella. Można je skonstruować umieszczając elektrodę miedzianą na dnie słoika i pokrywając metal roztworem siarczanu miedzi. Na wierzchu roztworu siarczanu miedzi pływa roztwór siarczanu cynku; następnie w roztworze siarczanu cynku umieszcza się elektrodę cynkową. Podłączenie elektrody miedzianej do elektrody cynkowej umożliwia przepływ prądu elektrycznego. Jest to przykład ogniwa bez mostka solnego, a jony mogą przepływać przez interfejs między dwoma roztworami.
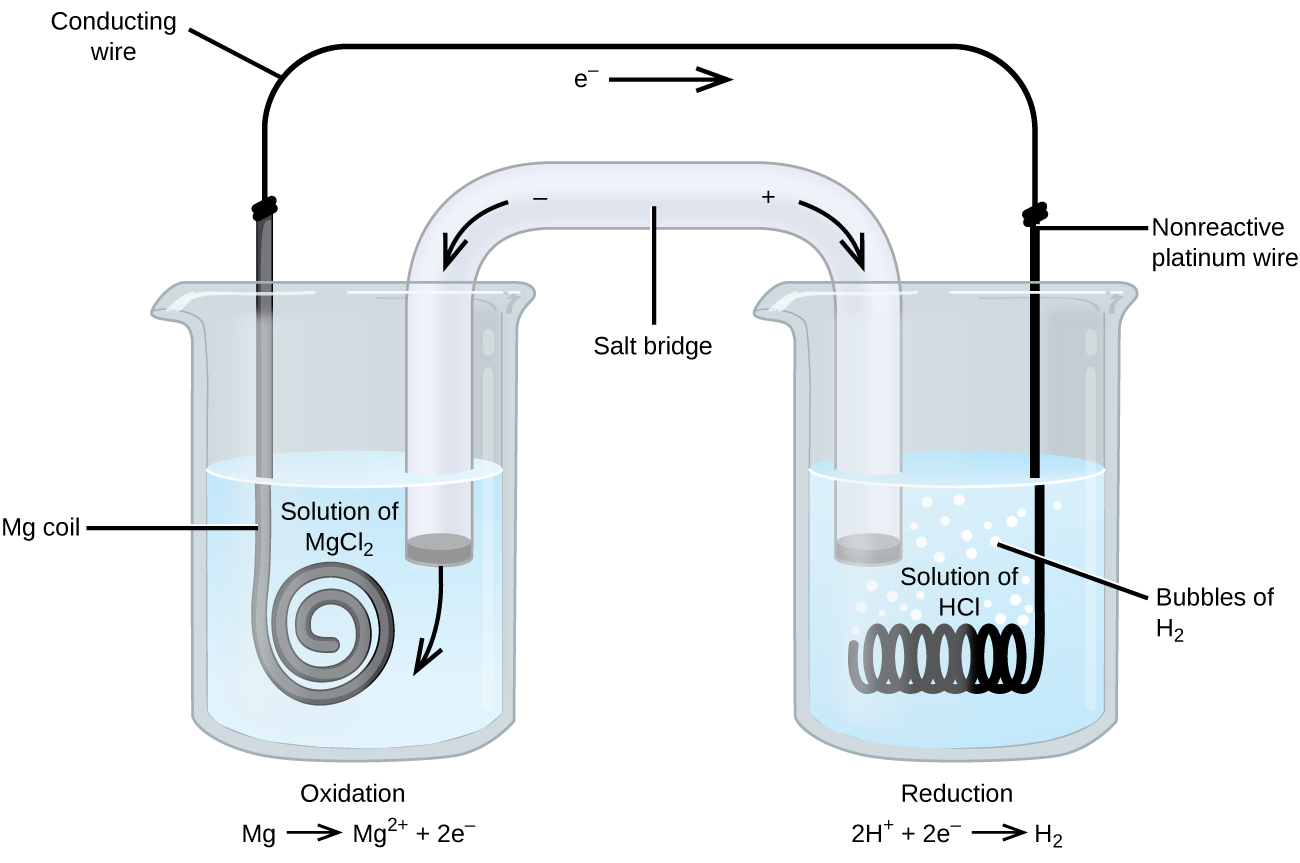
Niektóre reakcje utleniania-redukcji dotyczą gatunków, które są słabymi przewodnikami elektryczności, dlatego stosuje się elektrodę, która nie bierze udziału w reakcjach. Często elektrodą jest platyna, złoto lub grafit, z których wszystkie są obojętne dla wielu reakcji chemicznych. Jeden z takich układów pokazany jest na rysunku 3. Magnez ulega utlenieniu na anodzie po lewej stronie rysunku, a jony wodoru redukcji na katodzie po prawej stronie. Reakcję można streścić jako
W ogniwie zastosowano obojętny drut platynowy jako katodę, Elektrody obojętne, takie jak elektroda platynowa na rysunku 3, nie uczestniczą w reakcji utleniania-redukcji i są obecne, aby prąd mógł przepływać przez ogniwo. Platyna lub złoto generalnie stanowią dobre elektrody obojętne, ponieważ są one chemicznie niereaktywne.
Przykład 1
Używanie notacji ogniwowej
Rozważmy ogniwo galwaniczne składające się z
Zapisz półreakcje utleniania i redukcji oraz zapisz reakcję używając notacji komórkowej. Która reakcja zachodzi na anodzie? Katodzie?
Rozwiązanie
Poprzez sprawdzenie, Cr jest utleniany, gdy traci trzy elektrony tworząc Cr3+, a Cu2+ jest redukowany, gdy zyskuje dwa elektrony tworząc Cu. Zrównoważenie ładunków daje
Notacja komórkowa wykorzystuje najprostszą postać każdego z równań i zaczyna się od reakcji na anodzie. Nie podano stężeń, więc: \text{Cr}(s){\mid}\text{Cr}^{3+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s). Utlenianie zachodzi przy anodzie, a redukcja przy katodzie.5text{Fe}^{3+}(aq)\;+\;\N}^{2+}(aq)\;+\;4text{H}_2text{O}(l)
Zapisz półreakcje utleniania i redukcji oraz zapisz reakcję stosując notację komórkową. Która reakcja zachodzi na anodzie? Katoda?
Rozwiązanie
Poprzez sprawdzenie, Fe2+ utlenia się, gdy traci jeden elektron tworząc Fe3+, a MnO4- redukuje się, gdy zyskuje pięć elektronów tworząc Mn2+. Zrównoważenie ładunków daje
Notacja komórkowa wykorzystuje najprostszą postać każdego z równań i rozpoczyna się od reakcji na anodzie. Konieczne jest użycie elektrody obojętnej, takiej jak platyna, ponieważ nie ma metalu, który przewodziłby elektrony z anody do katody. Nie określono stężeń, więc: \text{Pt}(s){\mid}\text{Fe}^{2+}(aq)\text{,}\;\text{Fe}^{3+}(aq){\parallel}\text{MnO}_4^{\;\;-}(aq)\text{,}\;\text{H}^{+}(aq)\text{,}\;\text{Mn}^{2+}(aq){\mid}\text{Pt}(s). Utlenianie zachodzi przy anodzie a redukcja przy katodzie.
Check Your Learning
Use cell notation to describe the galvanic cell where copper(II) ions are reduced to copper metal and zinc metal is oxidized to zinc ions.
Odpowiedź:
Z informacji podanych w problemie:
begin{array}{lr @{}longrightarrow{} l}} \^text{anode};(utlenianie):} & \tekst{Zn}(s) & \tekst{Zn}^{2+}(aq)\;+:2 \tekst{e}^{-} \\ (redukcja):} & \text{Cu}^{2+}(aq)\;+\;2\text{e}^{-} & \\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\
\text{Zn}(s){\mid}\text{Zn}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s).
Ogniwa elektrochemiczne składają się zwykle z dwóch półogniw. Półogniwa oddzielają półreakcję utleniania od półreakcji redukcji i umożliwiają przepływ prądu przez zewnętrzny przewód. Jedna z półogniw, zwykle przedstawiona po lewej stronie na rysunku, zawiera anodę. Utlenianie zachodzi na anodzie. Anoda jest połączona z katodą w drugim półogniwie, często pokazanym na rysunku po prawej stronie. Redukcja zachodzi na katodzie. Dodanie mostka solnego uzupełnia obwód umożliwiając przepływ prądu. Aniony w mostku solnym płyną w kierunku anody, a kationy w mostku solnym płyną w kierunku katody. Ruch tych jonów dopełnia obwód i utrzymuje każde półogniwo elektrycznie neutralne. Ogniwa elektrochemiczne mogą być opisane przy użyciu notacji komórkowej. W tym zapisie informacja o reakcji zachodzącej przy anodzie pojawia się po lewej stronie, a informacja o reakcji zachodzącej przy katodzie po prawej. Mostek solny jest przedstawiony za pomocą podwójnej linii „‖. Faza stała, ciekła lub wodna w półogniwie jest oddzielona pojedynczą linią │. Po nazwie gatunku podana jest faza i stężenie poszczególnych gatunków. Elektrody, które biorą udział w reakcji utleniania-redukcji nazywane są elektrodami aktywnymi. Elektrody, które nie biorą udziału w reakcji utleniania-redukcji, ale umożliwiają przepływ prądu, są elektrodami obojętnymi. Elektrody obojętne są często wykonane z platyny lub złota, które są niezmienne w wielu reakcjach chemicznych.
Chemia End of Chapter Exercises
- Zapisz następujące zrównoważone reakcje używając notacji komórkowej. W razie potrzeby użyj platyny jako elektrody obojętnej.
(a) \text{Mg}(s)\;+\;\text{Ni}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Ni}(s)
(b) 2\text{Ag}^{+}(aq)\;+\;\text{Cu}(s)\;{\longrightarrow}\;\text{Cu}^{2+}(aq)\;+\;2\text{Ag}(s)
(c) \text{Mn}(s)\;+\;\text{Sn(NO}_3)_2(aq)\;{\longrightarrow}\;\text{Mn(NO}_3)_2(aq)\;+\;\text{Au}(s)
(d) 3\text{CuNO}_3(aq)\;+\;\text{Au(NO}_3)_3(aq)\;{\longrightarrow}\;3\text{Cu(NO}_3)_2(aq)\;+\;
- Podając następujące oznaczenia komórek, określ gatunki utlenione, gatunki zredukowane oraz czynnik utleniający i czynnik redukujący, bez zapisywania zrównoważonych reakcji.
(a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s)
(b)
- Dla oznaczeń komórek z poprzedniego zadania, zapisz odpowiadające im zbilansowane reakcje.
- Zbilansuj poniższe reakcje i zapisz je używając notacji komórkowej. Zignoruj wszelkie elektrody obojętne, ponieważ nigdy nie są one częścią pół-reakcji.
(a) \text{Al}(s)\;+\;\text{Zr}^{4+}(aq)\;{\longrightarrow}\;\text{Al}^{3+}(aq)\;+\;\text{Zr}(s)
(b) \text{Ag}^{+}(aq)\;+\;\text{NO}(g)\;{\longrightarrow}\;\text{Ag}(s)\;+\;\text{NO}_3^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(acidic\;solution)}
(c) \text{SiO}_3^{\;\;2-}(aq)\;+\;\text{Mg}(s)\;{\longrightarrow}\;\text{Si}(s)\;+\;\text{Mg(OH)}_2(s)\;\;\;\;\;\;\;\text{(basic\;solution)}
(d) \text{ClO}_3^{\;\;-}(aq)\;+\;\text{MnO}_2(s)\;{\longrightarrow}\;\text{Cl}^{\;\;-}(aq)\;+\;\text{MnO}_4^{\;\;-}(aq)\;\;\;\;\;\;\(roztwór)}
- Zidentyfikuj gatunki utlenione, gatunki zredukowane oraz czynnik utleniający i czynnik redukujący dla wszystkich reakcji w poprzednim zadaniu.
- W oparciu o podane informacje, zastosuj notację komórkową do opisu następujących układów:
(a) W jednej półkomórce roztwór Pt(NO3)2 tworzy metal Pt, natomiast w drugiej półkomórce metal Cu przechodzi do roztworu Cu(NO3)2 o stężeniu wszystkich solutów 1 M.
(b) Katodę stanowi elektroda złota w 0,55 M roztworze Au(NO3)3, a anodę elektroda magnezowa w 0.75 M roztworze Mg(NO3)2.
(c) Jedno półogniwo składa się z elektrody srebrnej w 1 M roztworze AgNO3, a w drugim półogniwie utlenia się elektroda miedziana w 1 M roztworze Cu(NO3)2.
- Dlaczego mostek solny jest niezbędny w ogniwach galwanicznych takich jak na rysunku 2?
- Stwierdzono, że elektroda aktywna (metalowa) traci masę, gdy reakcja utleniania-redukcji może postępować. Czy elektroda ta była częścią anody czy katody? Wyjaśnij.
- Aktywne elektrody uczestniczą w reakcji utleniania-redukcji. Ponieważ metale tworzą kationy, elektroda straciłaby masę, gdyby atomy metalu w elektrodzie utleniły się i przeszły do roztworu. Utlenianie zachodzi na anodzie.
- Masa trzech różnych elektrod metalowych, każdej z innego ogniwa galwanicznego, została określona przed i po tym, jak prąd wytworzony przez reakcję utleniania-redukcji w każdym ogniwie pozwolono płynąć przez kilka minut. Stwierdzono, że masa pierwszej elektrody metalowej, oznaczonej literą A, wzrosła, masa drugiej elektrody metalowej, oznaczonej literą B, nie zmieniła się, a masa trzeciej elektrody metalowej, oznaczonej literą C, zmniejszyła się. Zgadnij, które elektrody były aktywne, a które obojętne oraz które z nich były anodami, a które katodami.
Glossary
elektroda czynna elektroda, która bierze udział w reakcji utleniania-redukcji w ogniwie elektrochemicznym; masa elektrody czynnej zmienia się podczas reakcji utleniania-redukcji anoda elektroda w ogniwie elektrochemicznym, na której zachodzi utlenianie; informacje o anodzie zapisuje się po lewej stronie mostka solnego w notacji ogniwowej elektroda katodowa w ogniwie elektrochemicznym, w którym zachodzi redukcja; informacje o katodzie zapisuje się po prawej stronie mostka solnego w notacji ogniwowej notacja ogniwowa skrótowy sposób przedstawiania reakcji zachodzących w ogniwie elektrochemicznym różnica potencjałów elektrycznych powstająca przy połączeniu różnych metali; siła napędowa przepływu ładunku (prądu) w reakcjach utleniania-redukcji ogniwo galwaniczne ogniwo elektrochemiczne, w którym zachodzi spontaniczna reakcja utleniania-redukcji; ogniwa elektrochemiczne o dodatnim potencjale ogniwa; zwane również ogniwem woltaicznym elektroda obojętna elektroda, która umożliwia przepływ prądu, ale poza tym nie uczestniczy w reakcji utleniania-redukcji w ogniwie elektrochemicznym; masa elektrody obojętnej nie zmienia się podczas reakcji utleniania-redukcji; elektrody obojętne są często wykonane z platyny lub złota, ponieważ metale te są chemicznie niereaktywne. ogniwo woltaiczne inna nazwa ogniwa galwanicznego
Rozwiązania
Answers to Chemistry End of Chapter Exercises
1. (a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Ni}^{2+}(aq){\mid}\text{Ni}(s); (b) \text{Cu}(s){\mid}\text{Cu}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s); (c) \text{Mn}(s){\mid}\text{Mn}^{2+}(aq){\parallel}\text{Sn}^{2+}(aq){\mid}\text{Sn}(s); (d) \text{Pt}(s){\mid}\text{Cu}^{+}(aq)\text{,\;Cu}^{2+}(aq){\parallel}\text{Au}^{3+}(aq){\mid}\text{Au}(s)
3. (a) \text{Mg}(s)\;+\;\text{Cu}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Cu}(s); (b) 2\text{Ag}^{+}(aq)\;+\;\text{Ni}(s)\;{\longrightarrow}\;\text{Ni}^{2+}(aq)\;+\;2\text{Ag}(s)
5. Gatunek utleniony = reduktor: (a) Al(s); (b) NO(g); (c) Mg(s); oraz (d) MnO2(s); Gatunki zredukowane = czynnik utleniający: (a) Zr4+(aq); (b) Ag+(aq); (c) ^{SiO}_3^{;^;2-}(aq); oraz (d) ^{ClO}_3^{;^;-}(aq)
7. Bez mostka solnego obwód byłby otwarty (lub przerwany) i nie mógłby płynąć prąd. Z mostkiem solnym, każde półogniwo pozostaje elektrycznie obojętne i prąd może płynąć przez obwód.
9. Stwierdzono, że elektroda czynna (metalowa) przybiera na masie w miarę postępowania reakcji utleniania-redukcji. Czy elektroda ta była częścią anody czy katody? Wyjaśnij.