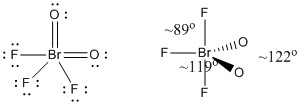Intermediate Inorganic Chemistry
University of Rhode Island
Fall 2013
Exam 1
1. Napisz konfigurację elektronową (stosując notację gazów szlachetnych dla powłok zamkniętych) oraz symbol stanu podstawowego dla następujących pierwiastków: a) Sc; b) Sc+; c) Sc2+; d) Sc3+; e) Sc-.
a) Sc
4s23d1
Tylko elektron 3d wnosi wkład do symbolu terminowego: L = 2 i S = ½ dając 2D
b) Sc+
3d2
L = 3 i S = 1 dając 3F
c) Sc2+
3d1
L = 2 i S = ½ dając 2D
d) Sc3+
L = 0 i S = 0 dając 1S
d) Sc-
4s23d2
L = 3 i S = 1 dając 3F
2. Napisz strukturę kropkową Lewisa, podaj ładunki formalne wszystkich atomów, przewidz geometrię cząsteczki, oszacuj wszystkie kąty wiązań oraz podaj prawdopodobny orbital hybrydowy dla następujących związków: a) BrO2-; b) BrO3-; c) BrO2F3.
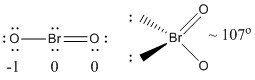
a) BrO2-
Struktura Lewisa:
Ładunki formalne podane są na Strukturze Lewisa
Struktura: wygięta planarna z kątem wiązania ~107°
Orbital hybrydowy na Br: sp3
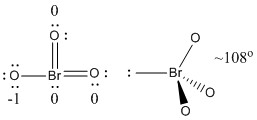
b) BrO3-
Struktura Lewisa:
Oładunki formalne podane są na Strukturze Lewisa
Struktura: piramidalna z kątami wiązań O-Br-O ~108°
Orbital hybrydowy na Br: sp3
c) BrO2F3
Struktura Lewisa:
Ładunki formalne są podane na Strukturze Lewisa
Struktura: trygonalna dwupiramidowa z kątami wiązań pokazanymi na rysunku
Orbital hybrydowy na Br: dsp3
3. Twardość bezwzględna atomu jest zdefiniowana jako η = ½(IP – EA), IP to potencjał jonizacji, a EA to powinowactwo elektronowe. Przewiduj trendy okresowe η i podaj uzasadnienie swoich przewidywań.
Dla prawie wszystkich atomów IP >> EA, więc η będzie podążać za trendami okresowymi IP: rosnącymi w miarę przesuwania się w prawo na Układzie Okresowym (podążając za Z*) i nieznacznie malejącymi w miarę przesuwania się w dół Układu Okresowego wraz ze wzrostem promienia atomu.
4. Cr2 ma konfigurację elektronową σ2π4δ4δ*2. Jaka jest kolejność wiązań i ile niesparowanych spinów jest przewidywanych? Czy oczekiwałbyś, że Cr2 będzie absorbował światło w widzialnym obszarze widma? Dlaczego lub dlaczego nie?
Porządek wiązania = ½(2 + 4 + 4 – 2) = 4 z 2 niesparowanymi spinami (ponieważ są 2 orbitale δ, muszą być również 2 orbitale δ*, które mają po jednym elektronie na podstawie reguł Hunda). Boczne nakładanie się orbitali d w celu utworzenia orbitali δ jest słabe, więc podział pomiędzy orbitalami δ i δ* będzie mały. To sugeruje, że energia potrzebna do przeniesienia elektronu z HOMO do LUMO jest również mała, co przewiduje absorpcję w widzialnej części widma.
.