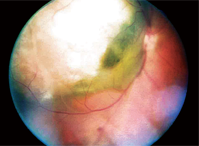
1. Zdjęcie dna oka prawego naszego pacjenta.
65-letni biały mężczyzna, osadzony w więzieniu stanowym, zgłosił się do kliniki okulistycznej zakładu poprawczego ze skargą na „błędy” w widzeniu lewego oka. Sytuacja taka miała miejsce od około trzech tygodni; pacjent zaprzeczał fotopsji. W wywiadzie ogólnoustrojowym u pacjenta stwierdzono nadciśnienie tętnicze, problemy z sercem (dwie wymiany zastawek) oraz cukrzycę typu 2 kontrolowaną lekami doustnymi.
W wywiadzie ocznym istotna była „długotrwała” ślepota prawego oka.
Po dalszych pytaniach dotyczących tej długotrwałej ślepoty, dowiedzieliśmy się, że 15 lat wcześniej pacjent widział się ze specjalistą od siatkówki, który powiedział mu, że ma „pieg” w oku. Zgłosił, że stracił wzrok w prawym oku około 10 lat temu, ale nie widział się ze specjalistą od czasu tej wizyty 15 lat temu.
Dane diagnostyczne
Podczas badania, ostrość wzroku pacjenta wynosiła Light Perception Only O.D., i 20/25 O.S. Źrenice mierzyły 4 mm O.D. i 3 mm O.S., były okrągłe i reaktywne, z wadą dośrodkową 3+ O.D. Ocena przedniego odcinka oka była godna uwagi ze względu na jądrową zaćmę sklerotyczną. Przeprowadziliśmy poszerzone badanie dna oka i stwierdziliśmy, że główną przyczyną dolegliwości pacjenta było tylne odłączenie ciała szklistego, które spowodowało gęstą, centralną synerezę ciała szklistego. Nie stwierdziliśmy w tym oku żadnych przerw w siatkówce ani niczego innego o znaczeniu klinicznym.
Dilated fundus examination of his right eye revealed a large elevated lesion, approximately 12 disc diameters in size, extending from-and including-the temporal optic disc, past the temporal macula and beyond the superior arcade. Była ona koloru szaro-białego z tym, co wydawało się być pewną zawartością płynu w aspekcie dolno-nosowym (ryc. 1).
Diagnoza
Postawiliśmy tymczasową diagnozę czerniaka naczyniówki z surowiczym odwarstwieniem siatkówki i udokumentowaliśmy ją zdjęciami dna oka.
Treatment and Follow-Up
Skierowaliśmy pacjenta do okulisty z ośrodka w celu dalszej oceny i leczenia. Około dwóch tygodni później, okulista zobaczył go i wykonał angiogram fluoresceinowy, jak również ultrasonografię A- i B-skan. Raporty z interpretacji tych procedur były dość szczątkowe; stwierdzały, że skany A i B ujawniły „litą masę”, a fluoresceina wykazała, że masa była wypełniona barwnikiem na początku, a następnie powoli zanikała. Po tych badaniach okulista postawił diagnozę różnicową czerniak złośliwy lub zwyrodnienie plamki żółtej. Skierował pacjenta do specjalisty chorób siatkówki, który widział go zaledwie kilka dni po konsultacji okulistycznej.
Specjalista chorób siatkówki natychmiast rozpoznał czerniaka naczyniówki i jeszcze tego samego dnia wysłał pacjenta do specjalisty okuloplastyki w celu omówienia leczenia. Wyniki badań diagnostycznych od specjalisty chorób siatkówki i okuloplastyki nie były dla nas dostępne w dokumentacji pacjenta. Zlecono również tomografię komputerową jamy brzusznej z kontrastem oraz RTG klatki piersiowej.
Pacjent i okuloplastyk zdecydowali się na leczenie enukleacją, a pacjent został umówiony na operację w następnym tygodniu. Zabieg enukleacji zakończył się sukcesem, jednak pacjentka niestety miała problemy ze znieczuleniem i zmarła dwa dni po enukleacji. Tomografia komputerowa jamy brzusznej i zdjęcia rentgenowskie klatki piersiowej nie zostały jeszcze wykonane.
Dyskusja
Czerniaki rogówki są stosunkowo rzadkie, występują z częstością około pięciu do sześciu przypadków na milion osób, co odpowiada około 1400 przypadkom w Stanach Zjednoczonych każdego roku.1,2 Występują głównie u dorosłych (ze szczytem około 55 roku życia), na ogół nie występują rodzinnie i wykazują nieznaczne upodobanie do mężczyzn w większości grup wiekowych.1,3,4 Występują głównie u osób o jasnej karnacji, z niebieskimi lub zielonymi tęczówkami, rzadko u czarnoskórych lub Azjatów.1,4
Pacjenci z czerniakami naczyniówki są często bezobjawowi, ale mogą zgłaszać się z pogorszeniem widzenia, ubytkami w polu widzenia, pływaczkami, fotopsjami lub, w rzadkich przypadkach, z bólem.4,5 Jeśli wystąpi ból, jest on zwykle wynikiem wtórnej jaskry lub martwicy guza; czerniaki naczyniówki mogą również powodować ból poprzez oddziaływanie na leżące u ich podłoża nerwy rzęskowe tylne, ale zdarza się to rzadko.3,5
Zmiany te są zwykle wyniosłe i mogą być cętkowane, ciemnobrązowe, matowo-szare, szaro-zielone lub żółte (amelanotyczne).4-6 Mogą przybierać kształt grzybka lub kopuły z zatłoczonymi naczyniami krwionośnymi wewnątrz guza – taka konfiguracja reprezentuje 20% czerniaków naczyniówki, które wychodzą przez błonę Brucha i nabłonek barwnikowy siatkówki (RPE).1,4,5
Czerniaki naczyniówki często wykazują nagłe uniesienie z naczyniówki, płyn podsiatkówkowy, pomarańczową pigmentację na powierzchni zmiany i wzrost w czasie.4 Płyn podsiatkówkowy z wynikającym z niego surowiczym odwarstwieniem siatkówki jest skutkiem rozpadu RPE. Te surowicze odwarstwienia często przesuwają się i mogą sprawiać wrażenie, że zawierają krew, jeśli guz przeszedł przez błonę Brucha.5
Podstawową pomarańczową pigmentacją jest lipofuscyna; pigment ten składa się z białek, lipidów i małych chromoforów i gromadzi się w RPE w wyniku degeneracji komórek i niekompletnego trawienia zewnętrznych segmentów fotoreceptorów.6,7 Lipofuscyna nie jest specyficzna dla czerniaków; może być również związana ze znamionami naczyniówkowymi lub innymi łagodnymi guzami naczyniówki. Jednakże lipofuscyna jest znacznie częściej obserwowana w czerniakach niż w ich łagodnych odpowiednikach.5
Inne możliwe objawy związane z czerniakami naczyniówki obejmują wylewy do ciała szklistego lub pigmentowane komórki ciała szklistego, zasinienie na powierzchni guza, naczyniówkowe błony neowaskularne w naczyniówce, a nawet proptozę, jeśli guz zaatakuje oczodół.4
Diagnozy różnicowe
Istnieje wiele diagnoz różnicowych dla melanotycznych i amelanotycznych czerniaków naczyniówki, które różnią się na kontinuum prognostycznym ciężkości.
– Znamiona naczyniówki są głównym rozpoznaniem różnicowym. Są one częstymi, łagodnymi nowotworami melanocytowymi i występują u około 2% do 6,5% populacji rasy białej.8-10 Znamiona są zwykle łupkowoszare i stosunkowo płaskie (mniej niż 2 mm grubości), chociaż istnieje znaczne nakładanie się rozmiarów małych czerniaków i większych znamion.8,9 Podobnie jak czerniaki naczyniówki, mogą one również wykazywać leżące u ich podłoża druzy lub lipofuscynę (ryc. 2). Statystycznie, na każde 500 znamion naczyniówki, jedno ulegnie transformacji złośliwej, jeśli będzie obserwowane przez 10 lat; szacowany roczny wskaźnik transformacji złośliwej wynosi jeden na 8 845.6,9
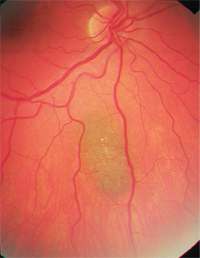
2. Znamię naczyniówki z leżącym nad nim ropniem.
Istnieją liczne znane czynniki ryzyka takiej transformacji (patrz „Transformacja złośliwa.”).4,8 Najważniejszym wydaje się być początkowa grubość znamienia większa niż 2 mm, ale duża średnica podstawy (większa niż 7 mm) również sugeruje przedzłośliwość znamienia.8,9 Brak obecności zasinień jest dobrym wskaźnikiem rokowniczym.7
Podczas gdy czerniaki naczyniówki mają tendencję do stosunkowo szybkiego wzrostu, znamiona naczyniówki mogą powiększać się powoli przez okres kilku lat, niekoniecznie wskazując na transformację złośliwą. Taki niezłośliwy wzrost jest częstszy u młodszych pacjentów i ma tendencję do stabilizowania się z wiekiem.11 Tak więc powolny wzrost znamion naczyniówki nie jest niezmiennie oznaką złośliwości, zwłaszcza u młodszych pacjentów bez innych czynników ryzyka.11
Co ciekawe, barwnikowe zmiany naczyniówki z żadnym z powyższych czynników ryzyka mają 3% szans na wzrost w ciągu pięciu lat; takie zmiany to zwykle znamiona naczyniówki.9 Obecność jednego z powyższych czynników niesie ze sobą 38% szans na wzrost, a ponad 50% szans na wzrost istnieje w przypadku obecności dwóch lub więcej czynników ryzyka.9 Względne ryzyko wzrostu wzrasta od 1,9 raza do 27,1 raza w przypadku obecności jednego vs. wszystkich pięciu czynników ryzyka.9
– Przerzuty do naczyniówki odnoszą się do guza, który rozprzestrzenił się do naczyniówki drogą hematogenną z pierwotnego nowotworu złośliwego w innym miejscu ciała. Nie są to więc guzy pierwotne, jak czerniak naczyniówki – najczęściej są to przerzuty z raka piersi lub płuc. Zmiany te mają zwykle kształt kopuły, kremowo-żółty kolor i często powodują odwarstwienie siatkówki. Przerzuty do naczyniówki są często obustronne lub wieloogniskowe i nie mają kształtu grzyba, w przeciwieństwie do czerniaków amelonowych.1
– Wrodzony przerost RPE objawia się jako pojedyncze lub wieloogniskowe, ciemno pigmentowane, płaskie zmiany, często z hipopigmentowanymi lukami. Są one łagodne, zwykle nie zmieniają się z czasem i nie wymagają leczenia.1
Wynikające z tego surowicze odwarstwienie siatkówki i uniesienie siatkówki wtórne do wysiękowego zwyrodnienia plamki związanego z wiekiem (AMD) stanowi kolejny czynnik różnicujący dla czerniaka naczyniówki. AMD może wykazywać krwotok podsiatkówkowy, wysięk lipidowy lub mętny, brudnoszary lub żółty obrzęk plamki, fałdy naczyniówki, odwarstwienia nabłonka barwnikowego lub dyskretne blizny.1 Angiografia fluoresceinowa pomaga w różnicowaniu tych stanów.
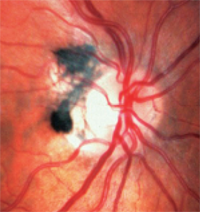
3. Melanocytoma są ciemno pigmentowane i występują na lub wokół tarczy nerwu wzrokowego.
– Melanocytoma są ciemno pigmentowane i występują na lub wokół tarczy nerwu wzrokowego (ryc. 3). W przeciwieństwie do czerniaków, są one wrodzone i często występują u osób z ciemnym pigmentem. Zazwyczaj są nieaktywne, ale mogą rosnąć i rzadko przekształcają się w czerniaki.1
– Naczyniaki naczyniówki są łagodnymi rozszerzeniami naczyniówki i są często związane z zespołem Sturge-Webera. Pojawiają się uniesione i mają czerwono-pomarańczowy kolor. Podobnie jak czerniaki naczyniówki, mogą powodować surowicze odwarstwienia siatkówki.1
– Naczyniaki krwionośne naczyniówki to żółto-pomarańczowe masy plackowate. Co ciekawe, są one zbudowane z dojrzałej tkanki kostnej. Mogą umożliwiać rozwój neowaskularyzacji naczyniówkowej i krwawienia podsiatkówkowego. Bardzo charakterystyczne cechy sprawiają, że łatwo je odróżnić od czerniaków naczyniówki za pomocą ultrasonografii lub tomografii komputerowej.1
– Dodatkowe czynniki różnicujące dla amelonotycznych lub melanotycznych czerniaków naczyniówki to odwarstwienie naczyniówki, chłoniak, rak przerzutowy, krwiak podsiatkówkowy lub podsiatkówkowy, zlokalizowany krwiak nadsiatkówkowy, guzkowe tylne zapalenie twardówki, reaktywna hiperplazja RPE lub masywna glioza siatkówki.4,5
Badania dodatkowe
Różne narzędzia mogą pomóc w diagnostyce czerniaków naczyniówki.
A- i B-skan ultrasonografii nie tylko pomaga w diagnozie, ale również może zapewnić dokładniejsze pomiary guza. Skan A zazwyczaj ujawnia niską wewnętrzną refleksyjność w obrębie guza; oscylacja wysokości echa w obrębie zmiany może odpowiadać pulsowi pacjenta, co wskazuje na obecność śródmiąższowego unaczynienia.1,5
Skan B pokazuje litą masę z akustycznie jasnym przednim aspektem z wewnętrznym i bazowym zaciemnieniem; kształt przekroju poprzecznego jest zazwyczaj dwuwypukły, ale może wyglądać jak grzyb. Może być również widoczne zagłębienie naczyniówki i zacienienie oczodołu.1,5
Angiografia fluoresceinowa typowo wykazuje hiperfluorescencję naczyń guza i rozproszone późne barwienie.1 Jednakże wzór fluoresceinowy zależy od wielkości guza, jego kształtu, pigmentacji, integralności RPE i tego, czy występuje odpowiednie surowicze odwarstwienie siatkówki, wśród innych zmiennych.5 Angiografia fluoresceinowa nie daje patognomonicznych objawów czerniaka naczyniówki.3
W przypadku tego konkretnego pacjenta czerniak naczyniówki został rozpoznany na podstawie badania fundoskopowego, ultrasonografii A- i B-scan oraz angiografii fluoresceinowej (bez biopsji).
Samo przedstawienie kliniczne tego pacjenta było wysoce sugerujące – w zasadzie jednoznacznie – czerniaka naczyniówki. Posiadał cztery z pięciu wyżej wymienionych czynników ryzyka złośliwości: grubość > 2 mm, płyn podsiatkówkowy, objawy/utratę wzroku i umiejscowienie < 3 mm od tarczy nerwu wzrokowego. Chociaż wymiary zmiany melanotycznej na podstawie ultrasonografii nie są dostępne, była ona wyraźnie pogrubiała ponad 2 mm i miała średnicę podstawną większą niż 7 mm (powszechnie akceptowane górne granice łagodnych znamion).8,12
Dodatkowo masa wykazywała cechy jawnie inwazyjne, takie jak wkraczanie na tarczę nerwu wzrokowego.8,12
Zarządzanie i rokowanie
W przypadku wykrycia podejrzanej masy ocznej ważne jest, aby zapytać pacjenta, czy przeszedł operację lub uraz oka; czy w przeszłości chorował na raka; czy występują u niego jakiekolwiek ogólnoustrojowe objawy raka, takie jak anoreksja, utrata masy ciała, ogólne zmęczenie, złe samopoczucie lub choroba. Chociaż u 98% pacjentów z czerniakami naczyniówki nie stwierdza się choroby przerzutowej wykrywalnej w momencie rozpoznania, należy wykluczyć przerzuty.5 Najlepiej, aby zajmował się tym onkolog oczny, dlatego takie skierowanie powinno być wystawione.
Badania obejmują pełną morfologię krwi, enzymy wątrobowe, TK jamy brzusznej, MRI lub USG oraz RTG klatki piersiowej.4,5 W przypadku czerniaków naczyniówki dostępnych jest kilka opcji leczenia, ale wiele z nich wiąże się z dużym ryzykiem; dlatego lekarz prowadzący musi starannie rozważyć wiele zmiennych przy wyborze odpowiedniej metody leczenia dla każdego pacjenta. Kilka czynników do rozważenia to wielkość i lokalizacja guza, stan przerzutów, stan wzroku zarówno w dotkniętym, jak i nie dotkniętym oku, a także wiek i ogólny stan zdrowia pacjenta.5 W zależności od tych czynników, obserwacja może być realnym planem postępowania, jeśli pacjent ma poważne problemy medyczne, ale generalnie nie jest zalecana.
Przemiana złośliwa
Do czynników ryzyka przemiany złośliwej znamion naczyniówki należą:4
– Grubość > 2 mm.
– Płyn podsiatkówkowy.
– Obecność objawów.
– Wyraźny pomarańczowy pigment pokrywający zmianę.
– Lokalizacja < 3 mm od tarczy nerwu wzrokowego.
*Jeśli obecne są dwa lub więcej czynników, zmiana jest prawdopodobnie czerniakiem naczyniówki.
Jedną z bardzo agresywnych metod leczenia jest enukleacja, ale wiąże się ona ze znacznym ryzykiem. Połowa pacjentów leczonych enukleacją umiera ostatecznie z powodu czerniaka z przerzutami. Ta inwazyjna opcja leczenia jest częściej omawiana, jeśli dotknięte nią oko jest ślepe, bolesne, wykazuje zajęcie tarczy nerwu wzrokowego lub jeśli guz jest bardzo duży.5
Większość małych czerniaków naczyniówki jest leczona terapiami niszczącymi miejscowo, takimi jak termoterapia, radioterapia lub napromienianie.12 Różne rodzaje promieniowania mogą być stosowane w leczeniu.4,5 Najbardziej powszechna jest brachyterapia płytkowa, która wykorzystuje radioaktywną płytkę, która jest przyszyta do powierzchni globu na zewnątrz guza.
To jest częściej próbowane z mniejszymi guzami, które są 3 średnice dysku lub więcej od dysku i fovea. U około 10% do 15% pacjentów leczonych w ten sposób dochodzi do miejscowego nawrotu nowotworu po leczeniu. Po leczeniu wzrok pacjenta zwykle pozostaje taki sam, jak przed leczeniem, ale istnieje szansa, że może ulec poprawie. Widzenie może jednak ulec późniejszemu pogorszeniu z powodu efektów wtórnych, takich jak retinopatia popromienna, brodawczakowatość nerwu wzrokowego, zaćma lub jaskra neowaskularna.
Fotokoagulacja może być próbowana w przypadku małych guzów (< 3mm grubości, < 7mm średnicy podstawowej).4,5 Podobnie jak w przypadku fotokoagulacji z jakiegokolwiek innego powodu, w obszarach poddanych fotokoagulacji wystąpi trwała skotoma. Można również stosować inne zabiegi laserowe, w tym termoterapię transpupilarną, w której wykorzystuje się laser podczerwony o małej mocy i długim czasie działania.5,12 Technika ta może być stosowana w połączeniu z radioterapią blaszki właściwej, ale nie wykazano znaczącej poprawy w zakresie miejscowej kontroli guza.13
Inne, mniej powszechne metody leczenia obejmują resekcję miejscową, terapię fotodynamiczną lub krioterapię.4,5 Często stosuje się wiele metod leczenia w ramach podejścia skojarzonego.
Niestety, rokowanie dla pacjentów z czerniakiem naczyniówki jest często złe. Pomimo leczenia, u 30% do 50% pacjentów dochodzi w końcu do rozwoju choroby przerzutowej; najczęściej do wątroby, ale także do płuc, kości, skóry, węzłów chłonnych lub ośrodkowego układu nerwowego.3,11,14 Ten sam odsetek pacjentów umrze w ciągu 10 lat od rozpoznania, zwykle z powodu rozsiewu przerzutowego.3,11
Po wystąpieniu przerzutów zgon jest prawie pewny.11 Największa częstość wykrywania przerzutów występuje w ciągu roku od rozpoznania czerniaka naczyniówki, choć może to nastąpić dopiero po wielu latach. Kilka czynników koreluje ze zwiększoną śmiertelnością, w tym większy rozmiar czerniaka, przednia lokalizacja, rozszerzenie pozagałkowe, wzrost przez błonę Brucha, rozszerzenie nerwu wzrokowego, brak pigmentacji i agresywny typ komórek i/lub aktywność mitotyczna.3
Widoczne jest, że ten pacjent nie otrzymał odpowiedniej opieki podczas pierwszej wizyty w klinice optometrii; jednakże, pomimo odpowiednich skierowań po drugiej wizycie, szanse na pomyślny wynik zostały znacznie zmniejszone.
Chociaż opóźnienie w skierowaniu o kilka miesięcy mogło nie zmienić znacząco wyników w tym przypadku, sytuacja ta podkreśla znaczenie dokładnego wywiadu i skutecznej komunikacji lekarz-pacjent. Podkreśla również znaczenie odpowiednich skierowań i dodatkowych badań, niezależnie od „długotrwałej” natury schorzenia.
Pomimo że rokowanie dla pacjentów z czerniakiem naczyniówki może wydawać się ponure, specjaliści zajmujący się opieką nad oczami muszą rozpocząć odpowiednie leczenie zaraz po wykryciu takiej zmiany, aby zwiększyć szanse pacjenta na uzyskanie pozytywnych wyników wtórnych, w tym zachowanie widzenia.
Dr Weidmayer praktykuje wraz z grupą optometrystów w Eye Center of Lenawee, P.C., w Adrian i Brooklyn, Mich.
1. Spaide RF. Diseases of the Retina and Vitreous. 1st ed. Philadelphia: W.B. Saunders; 1999:262-65.
2. Margo CE. The collaborative ocular melanoma study: an overview. Cancer Control. 2004 Sep-Oct;11(5):304-9.
3. Garcia-Valenzuela E, Pons ME, Puklin JE, Davidson CA. Choroidal Melanoma EMedicine Ophthalmology. Medscape Reference. June 24, 2009. http://emedicine.medscape.com/article/1190564-overview. Accessed August 17, 2010.
4. Znamię naczyniówki i czerniak złośliwy naczyniówki. In: Ehlers JP, Shah CP (eds). The Wills Eye Manual: Office and Emergency Room Diagnosis and Treatment of Eye Disease. 5th ed. Philadelphia: Lippincott Williams & Wilkins; 2008:330-3.
5. Augsburger JJ, Damato BE, Bornfeld N. Uveal Melanoma. In: Yanoff M, Duker JS, eds. Ophthalmology. 1st ed. London: Mosby;1999:1052-63.
6. Jones WL. Ophthalmoscopy. In: Terry JE (ed). Ocular Disease: Detection, Diagnosis, and Treatment. 1st ed. Boston: Butterworth Publishers; 1984:155-57.
7. Materin MA, Raducu R, Bianciotto C, Shields CL. Fundus autofluorescence and optical coherence tomography findings in choroidal melanocytic lesions. Middle East Afr J Ophthalmol. 2010 Jul;17(3): 201-6.
8. Augsburger JJ, Correa ZM, Trichopoulos N, Shaikh A. Size overlap between benign melanocytic choroidal nevi and choroidal malignant melanomas. Invest Ophthalmol Vis Sci. 2008 Jul;49(7):2823-8.
9. Kaiserman I, Kaiserman N, Pe’er J. Long term ultrasonic follow up of choroidal naevi and their transformation to melanomas. Br J Ophthalmol. 2006 Aug;90(8):994-8.
10. Mashayekhi A, Siu S, Shields CL, Shields JA. Slow enlargement of choroidal nevi: a long-term follow-up study. Ophthalmology. 2011 Feb;118(2):382-8.
11. Onken MD, Worley LA, Tuscan MD, Harbour JW. An accurate, clinically feasible multi-gene expression assay for predicting metastasis in uveal melanoma. J Mol Diagn. 2010 July;12(4):461-8.
12. Augsburger JJ, Correa ZM, Schneider S, et al. Diagnostic transvitreal fine-needle aspiration biopsy of small melanocytic choroidal tumors in nevus versus melanoma category. Trans Am Ophthalmol Soc. (2002);100:225-34.
13. Sagoo MS, Shields CL, Mashayekhi A, et al. Plaque radiotherapy for juxtapapillary choroidal melanoma: tumor control in 650 consecutive cases. Ophthalmology 2011 Feb;118(2):402-7.
14. Finger PT, Kurli M, Reddy S, et al. Whole body PET/CT for initial staging of choroidal melanoma. Br J Ophthalmol. 2005 Oct;89(10):1270-74.