W najprostszym ujęciu ogniwo elektrochemiczne składa się z dwóch przewodników elektronowych oddzielonych przewodnikiem jonowym i połączonych przewodnikiem elektronowym.
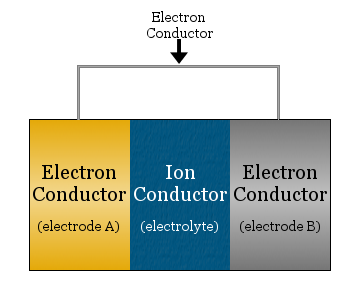
- przewodnik jonowy jest nazywany elektrolitem
- przewodniki elektronowe oddzielone elektrolitem są nazywane elektrodami
- przewodnik elektronowy używany do łączenia elektrod jest często metalowym drutem, takim jak miedziane okablowanie
Dwa typy ogniw
Istnieją dwa podstawowe typy ogniw elektrochemicznych: galwaniczne i elektrolityczne.
Konwersja energii jest osiągana przez spontaniczne (ΔG < 0) reakcje redoks wytwarzające przepływ elektronów.
Przepływ elektronów napędza nie spontaniczne (ΔG ≥ 0) reakcje redoks.
Przykłady
- Bateria zasilająca coś jest przykładem ogniwa galwanicznego.
- Akumulatory wielokrotnego ładowania są przykładami obu typów ogniw: działają jako ogniwa galwaniczne, gdy zasilają urządzenie i jako ogniwa elektrolityczne, gdy są ładowane.
- Przykłady ogniw elektrolitycznych obejmują również te używane do rozdzielania wody na wodór i tlen oraz te, które przekształcają rudę aluminium w metal aluminiowy.
Źródło danych termodynamicznych
Oprócz zastosowań praktycznych, takich jak opisane powyżej, ogniwa elektrochemiczne zapewniają doskonały sposób gromadzenia danych termodynamicznych.Na przykład, pozwalają one na wyznaczenie standardowych potencjałów redoks, na podstawie których można wygodnie uzyskać dane dotyczące standardowej entalpii, standardowej entropii i standardowej energii swobodnej Gibbsa dla reakcji.
Rozdzielanie reakcji
Ogniwa elektrochemiczne mogą:
- dostarczać energię elektryczną, lub
- przekształcać rudy metali w metale, lub
- dostarczać dane termodynamiczne,
ponieważ reakcje redoks zachodzą oddzielnie.
Przykład: Ogniwo Daniella
W ogniwach elektrochemicznych, reakcje zachodzą na oddzielnych elektrodach – i rzeczywiście same elektrody mogą być umieszczone w różnych naczyniach.Rozważmy jedno z wczesnych ogniw galwanicznych, ogniwo Daniella.
Źródłem energii w ogniwie Daniella jest spontaniczna reakcja metalu cynku z siarczanem miedzi, w wyniku której powstaje siarczan cynku i metal miedzi.
ΔG° = -212.6 kJ mol-1
Gdy materiały zetkną się ze sobą:
- w bezpośrednim kontakcie w jednym naczyniu, chemiczna energia potencjalna zamieniana jest na energię cieplną i naczynie reakcyjne staje się cieplejsze
- w ogniwie elektrochemicznym, chemiczna energia potencjalna zamieniana jest na energię elektryczną
Ogniwo Daniella
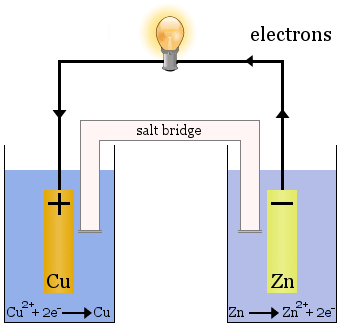
Ogniwo Daniella składa się z dwóch półogniw: w jednym redukują się jony miedzi, a w drugim utleniają się jony cynku.
Mostek solny w powyższym przypadku jest szklaną rurką wypełnioną nasyconym roztworem KNO3.Ma frytki na końcach, które zapobiegają mieszaniu się roztworów w każdej z pół-komórek, ale pozwala jonom przejść, aby zakończyć obwód elektryczny i utrzymać każdą pół-komórkę elektrycznie neutralną.
Siła napędowa jest taka sama ΔG° = -212.6 kJ mol-1 , którą uzyskuje się podczas zwykłego mieszania reagentów w jednym naczyniu; rozdzielając dwie półreakcje, elektrony muszą podróżować przez przewód i możemy wykorzystać energię elektryczną.

.