- Review Article
- Enterocutaneous Fistula: Evidence-based Management
- Abstract
- Wprowadzenie
- Tabela 1
- Table 1: Classification.
- Tabela 2
- Tabela 2: Zmienne prognostyczne ECF.
- Klasyfikacja
- Czynniki prognostyczne dla ECF
- Diagnostyka
- Rycina 1
- Zarządzanie
- Resuscytacja
- Kontrola źródła
- Zarządzanie wypływem
- Opieka nad ranami
- Tabela 3
- Tabela 3: Czas do uzyskania ostatecznego rozwiązania.
- Nutrition
- Wniosek
Review Article
Enterocutaneous Fistula: Evidence-based Management
Ryan P Dumas1*, Sarah A Moore1 and Carrie A Sims2
1Department of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
2Department of Surgery, Division of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
*Autor korespondencyjny: Ryan P Dumas, Department ofTraumatology, Surgical Critical Care& Emergency Surgery, PerelmanSchool of Medicine at the University ofPennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstract
Zarządzanie przetoką jelitowo-skórną (ECF) jest umiejętnością kliniczną, która powinna znajdować się w armamentarium każdego chirurga ogólnego. Chociaż ostateczne leczenie często polega na chirurgicznym zamknięciu przetoki, opieka przedoperacyjna i staranność są najważniejsze dla zapewnienia pomyślnego wyniku. Opieka nad tymi pacjentami powinna koncentrować się na czterech kluczowych fazach. Pierwsza faza charakteryzuje się odpowiednim rozpoznaniem i resuscytacją. W drugiej fazie przeprowadzana jest pełna ocena i plan żywieniowy. Ocena radiograficzna w trzeciej fazie pozwala na określenie anatomii ECF. Wreszcie, faza czwarta charakteryzuje się ostatecznym zamknięciem, jeśli przetoka nie zagoi się samoistnie.W tym przeglądzie skupimy się na kluczowych aspektach, które definiują każdą z faz i pomagają chirurgowi ogólnemu zmaksymalizować szanse na pozytywny wynik leczenia.
Wprowadzenie
Rozwój przetoki jelitowo-skórnej (ECF), definiowanej jako anomalne połączenie pomiędzy światłem jelita a skórą zewnętrzną, jest znaczącym źródłem zachorowalności i śmiertelności, pomimo postępu zarówno w opiece chirurgicznej, jak i medycznej. Ogólna częstość występowania ECF jest jednak nieznana, a większość danych dotyczących ECF pochodzi z dużych instytucjonalnych retrospektywnych lub specyficznych dla chirurga serii. Co znamienne, tylko 25% wszystkich ECF jest wtórne do zapalenia jelit, patologii uchyłków, urazów, napromieniania i nowotworów złośliwych. W przeciwieństwie do tego, prawie 75% wszystkich ECF jest bezpośrednim skutkiem operacji laparoskopowej lub otwartej, przy czym przeciek astomotyczny po wenterektomii jest odpowiedzialny za ponad 50% tych przetok. Pozostałe przetoki powstają w wyniku niezamierzonych urazów jatrogennych, takich jak enterotomia lub nierozpoznany uraz termiczny w trakcie operacji. Ponieważ ECF jest najczęściej problemem stworzonym przez chirurga, obowiązek zapobiegania, jak również odpowiedniego postępowania, planowania i ostatecznego leczenia słusznie spada na chirurga.
Zachorowalność i śmiertelność po ECF jest niezwykle wysoka. Szacuje się, że 90% pacjentów doświadcza zachorowalności związanej z ECF, począwszy od łuszczenia się skóry, poprzez odwodnienie, aż do sepsy. Ponadto śmiertelność związana z ECF waha się w granicach 5-20% i jest zależna od wielu czynników, w tym zakażenia i umiejscowienia przetoki. Ponieważ główną przyczyną zgonów u pacjentów z ECF jest sepsa, kontrola źródła pozostaje jednym z fundamentów terapii. W retrospektywnych badaniach wykazano 16-krotny wzrost śmiertelności w przypadku sepsy i 22-krotny w przypadku niekontrolowanej infekcji. W związku z tym wczesne i definitywne leczenie niedrenowanych zbiorników w połączeniu z krótkotrwałymi lekami przeciwbakteryjnymi może potencjalnie znacząco poprawić wyniki leczenia. W większości serii śmiertelność również wydaje się być skorelowana z wyjściową wartością przetoki i jej lokalizacją. Śmiertelność wzrasta z 26% w przypadku przetok o niskim wyjściu do 50% w przypadku przetok o wysokim wyjściu, biorąc pod uwagę wyzwania płynowe, elektrolitowe i żywieniowe związane z zarządzaniem ECF. Śmiertelność koreluje również z lokalizacją i zmniejsza się w przypadku przetok położonych bardziej dystalnie. Podczas gdy przetoki jelitowe mają najwyższą śmiertelność na poziomie 29% i są znacznie trudniejsze do zarządzania, śmiertelność związana z przetoką żołądkową jest najniższa i wynosi 6% .
Poza wpływem na pacjenta, który waha się od fizjologicznego do psychologicznego, zarządzanie ECF jest ogromnym obciążeniem dla zasobów opieki zdrowotnej. Szacuje się, że koszty zarządzania ECF jest dobrze ponad 500.000 dolarów i wymaga wielodyscyplinarnego zespołu dietetyków, pielęgniarek opieki rany i chirurgów w celu zapewnienia dobrego wyniku . Znaczenie centrów leczenia o wysokiej wiedzy specjalistycznej nie powinno być niedoceniane i wykazano, że znacznie zmniejszają one śmiertelność z 42% do 20%.
Tabela 1

| Anatomiczne | Proksymalne lub dystalne | Żołądkowe, dwunastnicze, jelitowe, krętnicze, okrężnicy |
| Fizjologiczna | Wysokie, umiarkowane, niskie natężenie przepływu | Wysokie natężenie przepływu >500 cm3/dobę Umiarkowane 200-500 cm3/dobę Niskie natężenie przepływu < 200 cm3/dobę |
| Etiologia | Jatrogenna vs. spontaneous Traumatic |
Malignant Radiation Inflammatory Bowel Disease Diverticular |
Table 1: Classification.
Table 1
Classification.
Tabela 2

| FAVORABLE. | UNFAVORABLE |
|---|---|
| Nutritionally replete | Nutritionally deplete |
| – Albumina >3.0 | -Low albumin, low transferrin |
| Długa droga przetoki (>2cm) | Krótka przetoka, liczne, złożone przetoki |
| Przetoka dwudzielna | Duży ubytek jelitowy (>1cm), widoczna błona śluzowa |
| Niskie wyjście | Wysokie wyjście (>500cc/dzień) |
| Pojedyncza przetoka | Przednie napromienianie |
| Ciągłość jelitowa | Wielokrotne wcześniejsze operacje |
| Indeksowa operacja wykonana w tym samym ośrodku | Zewnętrzne skierowanie do ośrodka o wysokiej |
Tabela 2: Zmienne prognostyczne ECF.
Tabela 2
Zmienne prognostyczne ECF.
Klasyfikacja
Nie ma uniwersalnego ani dobrze ugruntowanego schematu klasyfikacjiECF. Przetoki są zazwyczaj klasyfikowane anatomicznie, fizjologicznie lub według procesu chorobowego. Przetoki mogą być dodatkowo sklasyfikowane według ilości dziennego wypływu. Niezbędne jest dokładne udokumentowanie ilości wydzieliny z przetoki, ponieważ może ona dyktować zmiany w postępowaniu. Tabela 1 przedstawia trzy różne paradygmaty klasyfikacji.
Czynniki prognostyczne dla ECF
Czynniki prognostyczne dla ECF zostały bardzo dobrze opisane i są zgodne ze standardowym dogmatem chirurgicznym. Pacjentom z proksymalną przetoką o dużym wyrzucie towarzyszy niski poziom albumin (. I odwrotnie, pacjenci bez chorób współistniejących, którzy mają przetoki będące wynikiem zabiegu chirurgicznego i o małym wyrzucie, radzą sobie korzystniej z wyższym poziomem spontanicznego zamknięcia. W tabeli 2 wyszczególniono wiele zmiennych, które mogą prognozować pomyślny wynik leczenia.
Nie można przecenić znaczenia wsparcia instytucjonalnego i wielodyscyplinarnej wiedzy jako pozytywnego czynnika prognostycznego.Wiele badań potwierdziło doświadczenie instytucjonalne i objętość jako krytyczne czynniki zmniejszające zachorowalność i poprawiające śmiertelność. Ostatnio Canadian Association for EnterostomalTherapy skodyfikowało znaczenie wielodyscyplinarnej opieki, identyfikując dziewięciu niezbędnych członków zespołu w swoich zaleceniach „ECF Best Practice”. Począwszy od chirurgów, poprzez farmaceutów, a skończywszy na kapelanach, to zintegrowane podejście zespołowe uznaje specjalistyczną wiedzę, jaką każda specjalność wnosi do opieki nad tymi złożonymi pacjentami.
Diagnostyka
Tlący się przebieg pooperacyjny powikłany krętactwem i rozwojem infekcji rany pooperacyjnej jest zwiastunem ECF. Gdy przetoka jest podejrzewana lub została zidentyfikowana podczas badania fizykalnego, badania radiologiczne są niezbędnym uzupełnieniem i 97% wszystkich pacjentów poddawanych jest jakiejś formie oceny radiologicznej. Tomografia komputerowa z kontrastem jest niezbędna, ponieważ pozwala na ocenę obecności towarzyszącego ropnia lub niedrenowanego zbioru. Gdy kontrola źródła została zoptymalizowana, fluoroskopowa fistulografia odgrywa ważną rolę w określeniu anatomii przetoki. Fistulogram pomoże zlokalizować początek przetoki, określić jej długość, ocenić obecność niedrożności dystalnej i ustalić, czy przetoka jest w ciągłości z resztą jelita. Po potwierdzeniu rozpoznania ECF, należy skupić się na postępowaniu.
Rycina 1
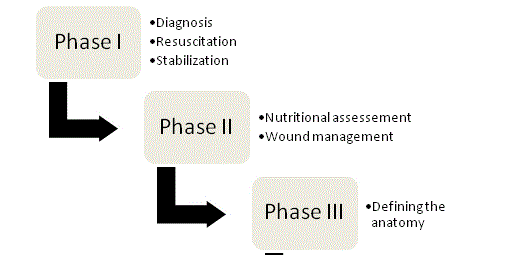
Rysunek 1
Cztery fazy zarządzania ECF.
Zarządzanie
Zasady zarządzania ECF zostały po raz pierwszy przedstawione przez Chapmana i współpracowników w 1964 roku i do dziś pozostają kamieniami węgielnymi terapii. W swoim oryginalnym artykule, Chapman et al.zidentyfikowane cztery kluczowe czynniki: resuscytacji płynów, kontroli źródła, zarządzania effluentmanagement i ochrony skóry. Znaczenie odżywiania pojawiło się niedawno jako piąty kluczowy element. W przypadku każdego pacjenta z przetoką należy przyjąć zorganizowane, systematyczne podejście, aby zoptymalizować szanse na pomyślny wynik leczenia; postępowanie można podzielić na cztery fazy (ryc. 1).
Resuscytacja
Resuscytacja pacjenta z nowo rozpoznaną przetoką ECF opiera się na tych samych zasadach, co resuscytacja pacjentów septycznych, a założenia kampanii Surviving Sepsis Campaign powinny służyć za punkt odniesienia. Początkowa opieka powinna koncentrować się na agresywnej resuscytacji płynami, szybkiej ocenie i korekcji zaburzeń równowagi elektrolitowej oraz normalizacji kwasicy mleczanowej. Pacjenci z ECF są zwykle hiponatremiczni, hipokaliemiczni i kwasicowi z powodu ciągłych strat żołądkowych.Pacjenci z przetokami o dużym wydatku powinni mieć uzupełniane dożylnie straty płynów, elektrolitów i wodorowęglanów, aby uniknąć odwodnienia i głębokiej niestabilności metabolicznej w początkowym okresie stabilizacji. Dokładne monitorowanie ilości oddawanego moczu i celowe uzupełnianie wypływu z przetoki co 4 do 8 godzin zapobiegnie ciągłemu odwodnieniu.
Kontrola źródła
Po reanimacji pacjenta należy zwrócić uwagę na ustanowienie kontroli źródła. Jak już wcześniej wspomniano, badanie tomografii komputerowej z użyciem kontrastu jest pomocne w identyfikacji nieopróżnionych zbiorników i ropni. U pacjentów pooperacyjnych kontrola źródła jest najprawdopodobniej realizowana przez radiologię interwencyjną. Jednak w przypadku niedostępnych zbiorników lub niekontrolowanej posocznicy wewnątrzbrzusznej, operacja może być nieunikniona. Antybiotyki o szerokim spektrum działania, podawane empirycznie dożylnie, nie powinny być stosowane rutynowo w leczeniu ECF, chyba że istnieją dowody na obecność zbiorników wewnątrzbrzusznych lub zakażenie rany z towarzyszącym zapaleniem tkanki łącznej. Zawsze, gdy jest to możliwe, antybiotyki powinny być ukierunkowane na konkretne dane z hodowli i ograniczone do okresu krótszego niż 2 tygodnie.
Zarządzanie wypływem
Zarządzanie sukcesem wypływu może mieć znaczący wpływ na stan objętościowy, równowagę elektrolitową, odżywianie i integralność skóry.Zastosowanie inhibitorów pompy protonowej może osiągnąć oba cele, a dawka powinna być miareczkowana do momentu, gdy pH płynu będzie większe niż 6, a objętość wyjściowa mniejsza niż 1L/dobę. Chociaż psyllium może być niezwykle użyteczne w wypełnianiu wypływu i zwiększaniu czasu tranzytu, środki zmniejszające motorykę i antysekrecyjne, w tym loperamid, atropinediphenoxylate, kodeina, nalewka z opium, a nawet metadon, są główną ostoją zmniejszania objętości. Biorąc pod uwagę rolę somatostatyny jako uniwersalnego inhibitora hormonów żołądkowo-jelitowych, przeprowadzono wiele badań nad wpływem egzogennej somatostatyny na pacjentów z ECF. Pomimo znacznej liczby randomizowanych badań kontrolowanych, trudno jest wyciągnąć istotne wnioski z powodu małej liczebności próby i niespójnego projektu badań. Oktreotyd, dłużej działający analog somatostatyny, był również badany jako lek wspomagający ECFadjunct z obiecującymi wynikami. Oktreotyd w dawce 100 mcg trzy razy dziennie może zmniejszać objętość wypływu i wykazano, że w niektórych badaniach skraca czas do samoistnego zamknięcia. W związku z tym, próba leczenia oktreotydem przez 72 godziny z dokładnym monitorowaniem objętości wypływu z przetoki może być uzasadniona, szczególnie w przypadkach, w których inne terapie nie zmniejszyły objętości wypływu. Powszechne działania niepożądane obejmują hiperglikemię, bóle głowy i kamicę żółciową.
Choć dane są jasne, że przetoki o niskim rzucie mają zwiększony odsetek samoistnego zamknięcia, to mniej jasne jest, że zmniejszenie objętości rzutu poprawi zamknięcie przetoki. Niemniej jednak, zmniejszenie objętości wyrzutu może znacząco zmniejszyć obciążenie związane z leczeniem przetoki i pozytywnie wpłynąć na samopoczucie pacjenta.
Opieka nad ranami
Prawdopodobnie jednym z trudniejszych i wymagających większych nakładów aspektów leczenia ECF jest miejscowa kontrola wypływu. Successenteric we can rapidly breakdown skin and cause irritation thatis difficult to treat. W związku z tym, odpowiednie zarządzanie skórą za pomocą kremów barierowych, barier przeciwwilgociowych, urządzeń woreczkowych i urządzeń ssących jest najważniejsze. Przetoki o dużej wydajności, w szczególności, często wymagają skomplikowanej sieci drenów, woreczków i odsysania w celu odpowiedniej kontroli wypływu. Wysoko wyspecjalizowane zespoły opieki nad ranami i terapeucienterostomalni są nieocenieni zarówno w leczeniu ran, jak i dla komfortu pacjenta.
Przy wszechobecnym stosowaniu terapii podciśnieniowej (NPT) w leczeniu ran i otwartego brzucha, nie jest zaskakujące, że NPT stało się częścią chirurgicznego armamentarium do radzenia sobie zECF. Wainstein i wsp. w największej jak dotąd serii przedstawili swoje doświadczenia z 91 pacjentami z przetokami o dużym wyjściu, leczonymi za pomocą ujemnego ciśnienia w zakresie od -350 do -600 mmHg. Poza znacznym zmniejszeniem odpływu ze średnio 1400 cc/dobę do 138 cc/dobę, samoistne zamknięcie uzyskano u 46% pacjentów.W 2016 roku Misky i wsp. opublikowali metaanalizę badającą zastosowanie NPT w ECF. Korzystając z dziesięciu retrospektywnych badań obejmujących łącznie 151 pacjentów, autorzy ci stwierdzili, że mediana odsetka samoistnych zamknięć wynosiła 65% (zakres od 7%-100%), a mediana czasu do zamknięcia 58 dni. Badacze ci odnotowali również odsetek nowych przetok wynoszący 4,4% – znane powikłanie, które dało niektórym praktykom powód do zastanowienia.Chociaż konieczne są dalsze badania w celu ustalenia, czy NPT może definitywnie poprawić odsetek zamknięć ECF lub skrócić czas do samoistnego zamknięcia, nie należy przeoczyć pozytywnych korzyści płynących ze stosowania tych opatrunków. Technologia ta może przynajmniej ułatwić zarządzanie ECF dzięki kontroli wypływu, ochronie skóry i zmniejszeniu częstości zmian opatrunków.
Tabela 3

| Inwestorzy | Praktyka instytucjonalna |
|---|---|
| Hollington | 8 miesięcy |
| Evenson | 4 miesiące |
| Rahbour | 12 miesięcy |
| Datta | 6 miesięcy |
| Lynch | 6 miesięcy |
| Li | 6 Miesięcy |
| Mcintyre | 6 Miesięcy |
Tabela 3: Czas do uzyskania ostatecznego rozwiązania.
Tabela 3
Timing to Definitive Management.
Nutrition
AssessmentThe nutritional status of an ECF patient is of paramountimportance. Przed pojawieniem się peptydowych preparatów dojelitowych i całkowitego żywienia pozajelitowego (TPN) retrospektywne serie historyczne uwydatniły ciężar niedożywienia u pacjentów z ECF. W serii 157 pacjentów z lat 50. i 60. ubiegłego wieku prawie 75% chorych z przetokami proksymalnymi było niedożywionych. Podobne wyniki uzyskali Chapman i wsp., którzy stwierdzili, że tylko niewielka mniejszość pacjentów była optymalnie odżywiona, a po poprawie stanu odżywienia śmiertelność związana z ECF zmniejszyła się z 55% do 12-16%.
Kompletna ocena stanu odżywienia powinna być przeprowadzona u każdego pacjenta z ECF. Chociaż równanie Harrisa-Benedicta stanowi dobry punkt wyjścia do obliczania potrzeb żywieniowych, powszechnie przyjmuje się, że pacjenci z ECF są kataboliczni i hiper metaboliczni.Ogólnie rzecz biorąc, pacjenci ci wymagają zwiększonego wsparcia kalorycznego z co najmniej 25-30 kcal/kg/dobę w węglowodanach i tłuszczach oraz 1,5 do 2 gramów białka/kg/dobę.
Stan odżywienia i postępy powinny być regularnie oceniane. Poza codzienną wagą, regularne badania żywieniowe, takie jak albumina, prealbum in, transfer i CRP powinny być śledzone.Przedoperacyjna albumina, w szczególności, okazała się być najsilniejszym predyktorem śmiertelności i zachorowalności po operacji chirurgii ogólnej, a hipoalbuminemia pozostaje znaczącym predyktorem złych wyników u pacjentów z ECF. Być może najczęściej badanym białkiem w ECF jest transferyna, której poziom powyżej 140 wiąże się ze zwiększonym odsetkiem samoistnych zamknięć i zmniejszoną śmiertelnością. Chociaż bilans azotowy może być pomocnym narzędziem, ten standardowy pomiar może być trudny do wykonania u pacjentów z przetokami o dużej przepustowości. Dodatkowe testy, takie jak pośrednia kalorymetria, mogą być rozważane w bardziej złożonych przypadkach, które nie odpowiadają na standardową opiekę.
Żywienie pozajelitowe vs. żywienie dojelitowe
Żywienie pozajelitowe odegrało krytyczną rolę w zarządzaniu ECF, a jego zastosowanie zostało mocno ustalone przez Dudricka w 1969 roku.W swoim artykule opisującym optymalne zarządzanie TPN, Dudrick stwierdził, że: „przy wyłącznym zastosowaniu hiperalimentacji pozajelitowej uzyskuje się regularnie przyrost masy ciała, dodatni bilans azotowy, wzrost i rozwój”. Podczas gdy TPN zmniejsza ilość wydzieliny jelitowej o 30%-50%, zmniejszając tym samym częstość występowania odwodnienia i zaburzeń równowagi elektrolitowej, nie ma randomizowanych badań dotyczących wpływu TPN na konwersję anaboliczną, częstość samoistnych zamknięć jelit czy śmiertelność. Mimo to TPN pozostaje popularną metodą leczenia długoterminowego, pomimo poważnych powikłań, w tym infekcji i dysfunkcji wątroby.
Ostatnio jednak zastosowanie żywienia dojelitowego w ECF zyskało na popularności. Stosowanie żywienia dojelitowego ma wiele zalet, w tym niższe koszty, mniej infekcji i lepszą funkcję immunologiczną w porównaniu z TPN. Co więcej, nawet dostarczenie zaledwie 20% kalorii drogą dojelitową może pomóc w utrzymaniu flory jelitowej i zmniejszeniu translokacji bakterii .
Kilka serii donosiło o zaskakującym sukcesie żywienia dojelitowego u pacjentów z ECF. W retrospektywnym badaniu Li i wsp. 86,4% z 1168 pacjentów było skutecznie leczonych dojelitowo. Żywienie dojelitowe może być nawet z powodzeniem stosowane w przypadku przetoki z dużym odpływem, gdy jest ono połączone z preparatami elementarnymi, lekami hamującymi łaknienie i środkami wypełniającymi włókno. W serii 335 pacjentów z przetokami o dużym wyjściu, Levy i wsp. byli w stanie skutecznie osiągnąć niezależność od TPN u 85% swojej kohorty, stosując żywienie dojelitowe. Co ciekawe, pomimo żywienia dojelitowego i braku „odpoczynku jelitowego”, śmiertelność i odsetek samoistnych zamknięć były podobne do wcześniejszych serii.
W przypadku przetok ECF o dużym wydatku z dystalnym śluzówkowo-skórnym odcinkiem, fistulokliza może być ważnym uzupełnieniem standardowego żywienia dojelitowego. Praktyka fistuloklizy wywodzi się z praktyki dokarmiania żylaków u noworodków i może odnosić się zarówno do dokarmiania w przypadku niepowodzenia, jak i uzupełniania dodatkowego żywienia dojelitowego przez cewnik umieszczony w dystalnej części ECF. Teubner i wsp. po raz pierwszy opisali przetokę jako metodę leczenia ECF w 2004 roku w serii przypadków dwunastu pacjentów z proksymalnymi przetokami. Od tego czasu w wielu opisach przypadków i małych seriach wykazano skuteczność żywieniową tej techniki. W porównaniu z dobraną kohortą pacjentów otrzymujących TEN bez fistuloklizy, pacjenci z przetoką o dużym wyrzucie, leczeni fistuloklizą, mieli istotnie lepszą funkcję wątroby i parametry żywieniowe. Fistulokliza może być szczególnie pomocna u pacjentów, u których rozwijają się powikłania związane z TPN, w tym infekcje, problemy z dostępem żylnym lub niewydolność wątroby. Powikłania mogą jednak wystąpić i mogą obejmować niedrożność, jeśli perystaltyka jelita cienkiego spowoduje przesunięcie cewnika przetoki dystalnie do jelita cienkiego.
Witaminy i minerały są często zubożone u pacjentów ECF.Niedobory witamin rozpuszczalnych w tłuszczach są powszechne, podczas gdy niedobory witamin rozpuszczalnych w wodzie są rzadkie, chyba że przetoka znajduje się w obrębie proksymalnego jelita czczego. Ponadto, ponieważ witamina B12 jest wchłaniana tylko w końcowych 50-60 cm jelita krętego, u wielu pacjentów z ECF może być konieczne podawanie witaminy B12 w iniekcjach. Magnez jest często marnowany w przetokach o dużym wydatku i powinien być uzupełniany albo siarczanem magnezu podawanym dożylnie albo doustnym chlorkiem magnezu w celu poprawy wchłaniania jelitowego. Wreszcie, zalecane jest uzupełnianie dużych dawek zarówno cynku, jak i witaminyC. Podczas gdy Omega-3 i olej rybny były badane w warunkach intensywnej terapii z pewnymi korzyściami, te suplementy nigdy nie były oceniane u pacjentów z ECF i nie są rutynowo stosowane.
Uwagi operacyjne
Odsetek spontanicznego zamknięcia ECF waha się w literaturze pomiędzy 15 a 75%. Ten szeroki zakres wskaźników zamknięcia prawdopodobnie odzwierciedla różnice w populacjach pacjentów i instytucjonalnych wzorcach postępowania. Prawdopodobieństwo samoistnego zamknięcia się przetok po 4 tygodniach jest znacznie mniejsze, a tylko 10% przetok zamyka się po 2 miesiącach. Ponieważ wskaźniki spontanicznego zamknięcia ECF są niskie, interwencja chirurgiczna jest często jedyną ostateczną strategią postępowania.
Decyzja o operowaniu ECF nie powinna być jednak podejmowana pochopnie, ponieważ wskaźniki nawrotów po usunięciu ECF wynoszą od 13 do 34%. Chociaż zasady interwencji chirurgicznej w przypadku ECF obejmują wiele podstawowych założeń chirurgii ogólnej, czas operacji jest prawdopodobnie najważniejszym czynnikiem, który należy rozważyć. Fazio i wsp. wykazali, jak ważne jest postępowanie wyczekujące u chorych z ECF. Gdy operacja miała miejsce w czasie krótszym niż 6 tygodni od momentu powstania ECF, śmiertelność przekraczała 20%. Jednak opóźnienie operacji o ponad 6 tygodni spowodowało zmniejszenie śmiertelności do 11%, a wczesna operacja może być przyczyną zwiększonego ryzyka nawrotu choroby. W serii Lyncha i wsp. u chorych operowanych między 2 a 12 tygodniem tworzenia ECF odsetek nawrotów wynosił 28%, natomiast opóźnienie operacji powyżej 12 tygodni zmniejszyło ten odsetek do 15%. Tabela 3 przedstawia czas, jaki eksperci sugerują odczekać przed rozważeniem interwencji operacyjnej w przypadku nie gojącego się ECF.
Postępowanie operacyjne powinno być prowadzone tylko przy pełnym zaangażowaniu i zrozumieniu zarówno pacjenta, jak i chirurga. Operacje zamknięcia ECF są długimi, trudnymi technicznie przypadkami, obarczonymi ryzykiem wystąpienia istotnych powikłań. Operacje często wymagają całkowitego unieruchomienia jelita od więzadła Treitza do odbytnicy. Biorąc pod uwagę, że 36% przetok nawrotowych jest wynikiem urazów powstałych podczas operacji zamykania ECF, należy zachować szczególną ostrożność podczas lizowania zrostów, aby uniknąć niezamierzonego uszkodzenia zdrowego jelita. Postępowanie z przetoką jelitową powinno zawsze obejmować resekcję jelita i pierwotną astomozę. Nadszycie lub wycięcie przetoki niezmiennie skutkuje większą liczbą nawrotów (36% vs. 16%).
Wniosek
Przetoka skórna jest jednym z najtrudniejszych powikłań dla chirurga ogólnego. Zastosowanie ostrożnego, systematycznego i skoncentrowanego na pacjencie podejścia pomoże zmaksymalizować pomyślne wyniki kliniczne. Pomimo spójności zasad postępowania z ECF u różnych pacjentów, każda przetoka jest unikalna, a sposób jej leczenia zależy w dużej mierze od parametrów wyjściowych, lokalizacji i chorób współistniejących. Doświadczenia poszczególnych chirurgów i instytucji podkreślają znaczenie opóźnionej interwencji. Chociaż zarówno chirurdzy, jak i pacjenci mogą mieć silne pragnienie chirurgicznego zamknięcia przetoki, najlepiej służy pacjentom co najmniej 6-miesięczne postępowanie nieoperacyjne. Ostatecznie, długoterminowa opieka nad pacjentami z ECF wymaga, wielodyscyplinarnej często koordynowanej przez chirurga.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. An 11-year experience of enterocutaneous fistula. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Management of enterocutaneous fistulas: 30-year clinical experience. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Management of enterocutaneous fistulas: A review of 132 cases. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Review of 404 patients with gastrointestinal fistulas. Impact of parenteral nutrition. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Seven-year experience of enterocutaneous fistula with univariate and multivariate analysis of factors associated with healing: development of a validated scoring system. Colorectal Dis. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. Optimising the treatment of upper gastrointestinal fistulae. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Nutrition and management of enterocutaneous fistula. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Classification and pathophysiology of enterocutaneous fistulas. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. The pathophysiology of enterocutaneous fistulas. World J Surg. 1983;7:446-50.
- Draus JM, Jr, Huss SA, Harty NJ, Cheadle WG, Larson GM. Enterocutaneous fistula: are treatments improving? Surgery. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Systematic management of postoperative enterocutaneous fistulas: factors related to outcomes. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. A systematic literature review on the use of vacuum assisted closure for enterocutaneous fistula. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. A multivariate model to determine prognostic factors in gastrointestinal fistulas. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. High-output external fistulae of the small bowel: management with continuous enteral nutrition. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Historical perspectives in the care of patients with enterocutaneous fistula. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Metabolic support of the enterocutaneous fistula patient. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Enterocutaneous fistula complicating trauma laparotomy: A major resource burden. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Three years’ experience with an intestinal failure unit. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Enteric fistulas: principles of management. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Enterocutaneous Fistula: Proven Strategies and Updates. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Summary of best practice recommendations for management of enterocutaneous fistulae from the Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Current management of enterocutaneous fistula. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Management of Intestinal Fistulas. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Role of somatostatin-14 and its analogues in the management of gastrointestinal fistulae: clinical data. Gut. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Treatment of high-output enterocutaneous fistulas with a vacuum-compaction device. A ten-year experience. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr, Williams GM, Welch CE. External fistulas arising from the gastro-intestinal tract. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Metabolic and nutritional support of the enterocutaneous fistula patient: a three-phase approach. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Preoperative serum albumin level as a predictor of operative mortality and morbidity: results from the National VA Surgical Risk Study. Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Factors predictive of recurrence and mortality after surgical repair of enterocutaneous fistula. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract. 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. Czy żywienie dożylne jako jedyny środek żywienia może wspierać wzrost u dziecka i przywrócić utratę masy ciała u dorosłego? Twierdząca odpowiedź. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. Fistuloclysis can successfully replace parenteral feeding in the nutritional support of patients with enterocutaneous fistula. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloclysis: case report and literature review. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. Fistuloclysis improves liver function and nutritional status in patients with high-output upper enteric fistula. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Management of enterocutaneous fistulas. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. Surgical management of high output enterocutaneous fistulae: a 24-year experience. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Operative surgery for enterocutaneous fistula. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Clinical outcome and factors predictive of recurrence after enterocutaneous fistula surgery. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Outcome of 132 consecutive reconstructive operations for intestinal fistula–staged operation without primary anastomosis improved outcome in retrospective analysis. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Management of external gastrointestinal fistulas. Ann Surg. 1978;188:460-7.
.