Les spasmes des paupières et du visage peuvent avoir un impact significatif sur la qualité de vie d’un patient, mais parvenir à la cause profonde du spasme – il peut s’agir d’une myokymie, d’un blépharospasme essentiel bénin ou d’un spasme hémifacial – peut être un défi pour le clinicien. Dans cet article, nous vous donnerons des conseils qui peuvent vous aider à diagnostiquer et à gérer ces conditions parfois difficiles.
Un aperçu
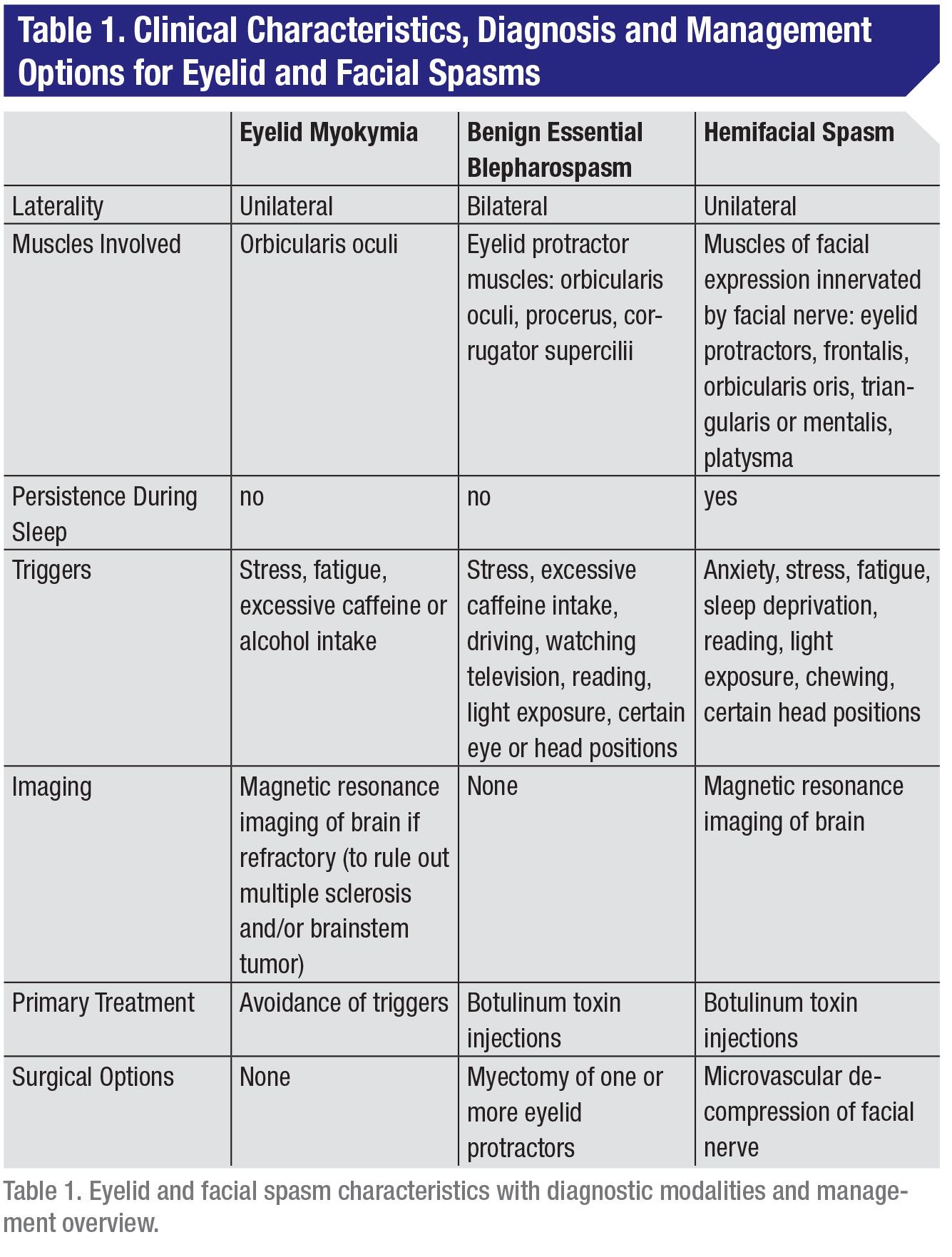
Dans la pratique neurologique et ophtalmique, classé du moins au plus grave, le spectre des spasmes des paupières et du visage comprend la myokymie des paupières (petites contractions involontaires de la paupière), le blépharospasme essentiel bénin (spasmes involontaires qui entraînent une fermeture partielle ou complète de l’œil) et le spasme hémifacial (spasmes des muscles contrôlant les expressions faciales) (tableau 1). Ces troubles consistent tous en des mouvements involontaires du visage qui peuvent être difficiles à gérer par les patients dans la vie quotidienne.
Myokymie des paupières
Le trouble des mouvements involontaires du visage le plus fréquent est la myokymie des paupières. La myokymie des paupières consiste en des contractions involontaires, fines, continues, ondulantes et non synchrones des fibres musculaires striées des protracteurs des paupières. En électrophysiologie, elle se caractérise par une décharge asynchrone spontanée d’unités motrices adjacentes en doublets ou triplets à une fréquence de 30 à 70 Hertz avec des intervalles de 100 à 200 ms séparant les décharges individuelles.2,3 La myokymie des paupières est considérée comme un processus bénin, autolimité, unilatéral et intermittent, la paupière inférieure étant plus touchée que la supérieure. Les épisodes sont transitoires et durent de quelques jours à quelques semaines ou mois, les spasmes se produisant par intermittence tout au long de la journée pendant plusieurs heures à la fois4
Les facteurs d’incitation comprennent le stress, l’épuisement, la consommation excessive de caféine ou d’alcool et l’effort physique5. La myokymie des paupières est le plus souvent isolée au muscle orbicularis oculi, mais elle peut s’étendre à d’autres muscles d’un ou des deux côtés du visage, auquel cas on parle de myokymie faciale.2
La myokymie faciale est causée par des lésions du noyau du nerf facial dans le pons dues à des maladies démyélinisantes comme la sclérose en plaques ou à une compression due à des tumeurs du tronc cérébral. Dans de rares cas, une myokymie persistante de la paupière a été signalée comme un signe de présentation d’une sclérose en plaques ou d’une tumeur du tronc cérébral.3 Si l’affection est chronique, réfractaire à l’élimination des facteurs d’incitation et qu’elle affecte la qualité de vie du patient, les injections de toxine botulique peuvent être efficaces dans le traitement. Le mécanisme et l’efficacité des injections de toxine botulique sont discutés en détail dans la section suivante. Une myokymie persistante de la paupière réfractaire aux traitements ci-dessus doit faire suspecter une lésion du tronc cérébral telle que décrite ci-dessus et justifie une analyse par imagerie par résonance magnétique.
Blépharospasme essentiel bénin
Le BEB a été décrit pour la première fois en 1857 comme un trouble des spasmes involontaires des muscles protracteurs de la paupière qui entraîne une fermeture partielle ou complète de la paupière. Le BEB a une incidence de 1,4 à 13,3 cas pour 100 000, affecte les femmes trois fois plus souvent que les hommes et survient le plus souvent entre la cinquième et la septième décennie de la vie.7,8 Le BEB est le plus souvent un trouble sporadique, mais 27 pour cent des patients ont été signalés comme ayant un membre de leur famille atteint de dystonie, ce qui suggère une possible composante génétique.1
La pathophysiologie du BEB n’est pas bien comprise. Des études de tomographie par émission de positons et d’imagerie par résonance magnétique fonctionnelle ont montré une activation des régions du cerveau impliquées dans le contrôle et la régulation des muscles responsables du clignement des yeux, notamment le thalamus, le striatum, le cortex visuel antérieur, le cortex moteur primaire et le cervelet supérieur7,9.Des études animales ont montré que la déplétion de la dopamine dans la substantia nigra diminue l’inhibition du réflexe de clignement du trijumeau, ce qui entraîne une hypersensibilité de ce réflexe en réponse à la lumière et à la sécheresse.10 Les facteurs d’incitation au BEB comprennent le stress, la consommation excessive de caféine, la conduite automobile, le fait de regarder la télévision, la lecture, les lumières vives, l’air pollué, le vent, le bruit et certains mouvements des yeux et de la tête11,12.
La présentation clinique du BEB consiste en des spasmes involontaires bilatéraux d’un ou de plusieurs muscles protracteurs de la paupière, y compris l’orbicularis oculi, le procerus et les muscles corrugateurs, avec des symptômes allant d’une légère augmentation de la vitesse de clignement à une fermeture forcée de la paupière pouvant entraîner une cécité fonctionnelle.1 Les symptômes du BEB ne persistent pas pendant le sommeil et il s’agit d’une affection progressive dans laquelle d’autres muscles sont impliqués avec le temps.7 Un sous-ensemble de patients peut présenter des spasmes au niveau de la partie moyenne ou inférieure du visage, une affection appelée syndrome de Meige.1 Un autre sous-ensemble de patients peut développer une apraxie de l’ouverture des paupières dans laquelle il y a une perte de la co-inhibition entre les protracteurs et les rétracteurs des paupières, ce qui entraîne une incapacité non paralytique à ouvrir les paupières en l’absence de spasme musculaire.1
Les patients se plaignent aussi souvent du symptôme sensoriel de photophobie. Les mécanismes proposés pour la photophobie comprennent un trouble douloureux entretenu par la sympathie, pour lequel les blocs des ganglions cervicaux supérieurs ont apporté un soulagement dans des rapports antérieurs.11 Les options de gestion supplémentaires pour contrôler la photophobie comprennent la modulation photochromatique avec des lentilles teintées FL-41 ou des lentilles de contact sclérales avec de la fluorescéine dans le réservoir de fluide, qui augmentent toutes deux l’intensité de la lumière tolérée par les patients atteints de BEB.13
Le traitement de choix pour le BEB est l’injection de toxine botulique dans les muscles protracteurs de la paupière affectés. La toxine botulique inhibe la libération d’acétylcholine à partir de la borne présynaptique de la jonction neuromusculaire, bloquant ainsi la capacité du muscle injecté à se contracter. Il existe sept sérotypes de toxine botulique (A à G). Les types A et B sont approuvés par la Food and Drug Administration américaine pour un usage clinique aux États-Unis. L’onabotulinumtoxinA (Botox) a été approuvé par la FDA pour le traitement du BEB en 1989 et est la formulation la plus couramment utilisée, bien que l’incobotulinumtoxinA, l’abobotulinumtoxinA et la rimabotulinumtoxinB soient également autorisés.14 Les injections sont nécessaires environ tous les trois à quatre mois.11 La FDA recommande une dose initiale de 1,25 à 2,5 unités injectées dans chaque site affecté avec une dose maximale de 15 unités et trois sites d’injection par côté.14 Cependant, des enquêtes ont montré que les chirurgiens oculoplastiques ont tendance à traiter le BEB avec une dose initiale moyenne de 22,5 ±9,5 unités.14
Typiquement, cinq à huit sites sont injectés autour de chaque œil, avec pas plus de 0,1 ml de toxine botulique injectée à chaque site pour éviter la diffusion du médicament dans les muscles adjacents12. Les cliniciens doivent veiller à injecter médialement et latéralement lors du traitement de la partie prétarsale du muscle orbicularis oculi dans les paupières supérieures, afin d’éviter l’injection dans le muscle levator palpebrae superioris, ce qui peut entraîner un ptosis. De même, au niveau de la paupière inférieure, les injections sont réalisées de manière centrale et latérale afin d’éviter l’injection dans l’oblique inférieur, ce qui entraînerait une diplopie. L’incidence des effets indésirables des injections de toxine botulique pour les patients BEB a été rapportée à environ 20 %, notamment une ecchymose au site d’injection, un œil sec, un larmoiement, une sensation de corps étranger, une lagophtalmie, une diplopie et un ptosis7.
Les autres médicaments qui ont été utilisés dans le traitement du BEB comprennent les antipsychotiques, les antiépileptiques, les anxiolytiques, les antidépresseurs, les antihistaminiques, les sédatifs et les stimulants, bien qu’aucun n’ait démontré une efficacité à long terme15. En particulier, les agonistes de la dopamine et les inhibiteurs du captage de la dopamine se sont avérés efficaces pour réduire les spasmes des paupières, étant donné que la déficience en dopamine a été impliquée dans la pathogenèse du BEB.11 Il a été démontré que le méthylphénidate, qui bloque le recaptage présynaptique de la dopamine et de la norépinéphrine, diminue les spasmes des paupières et le score d’invalidité.11 Les patients atteints de BEB ont montré une réponse partielle aux agonistes de l’acide gamma-aminobutyrique tels que les benzodiazépines, mais leur utilisation est limitée par l’effet secondaire de la somnolence.11
Lorsque le BEB est réfractaire à la prise en charge médicale ou que le patient ne tolère pas les injections de toxine botulique, une intervention chirurgicale avec myectomie peut être envisagée. Les principaux objectifs de cette procédure sont de réduire la sévérité du spasme et d’augmenter l’intervalle de temps nécessaire entre les injections de toxine botulique.11 Dans la myectomie chirurgicale, un ou plusieurs des muscles protracteurs sont réséqués. Une myectomie limitée implique la résection d’une partie seulement du muscle orbicularis oculi de la paupière supérieure, par opposition à une myectomie étendue dans laquelle le corrugator supercilii et le rapporteur sont enlevés en plus.15
Les effets indésirables de la chirurgie comprennent un mauvais aspect esthétique et la nécessité de procéder à des chirurgies supplémentaires. La récurrence des symptômes après une myectomie chirurgicale a été signalée comme allant de 30 à 50 % des cas après six mois.12 Une procédure alternative implique la section du nerf facial, qui dénerve efficacement les protracteurs de la paupière mais entraîne secondairement une paralysie du nerf facial et est donc rarement utilisée15.

Spasme hémifacial
Enfin, le SFS est un trouble involontaire unilatéral du mouvement facial impliquant des spasmes des muscles de l’expression faciale innervés par le nerf facial. L’incidence estimée est d’environ 10 cas pour 100 000, d’après des études menées au Minnesota et en Norvège.16,17 Le HFS a tendance à se manifester au cours de la quatrième ou de la cinquième décennie de la vie, les femmes étant touchées deux à trois fois plus souvent que les hommes, et les populations asiatiques plus fréquemment que les Caucasiens.18 Jusqu’à un tiers des patients signalent des facteurs aggravants du HFS, notamment l’anxiété, le stress, la fatigue, le manque de sommeil, la lecture, l’exposition à la lumière, la mastication ou des positions particulières de la tête. Le HFS est souvent diagnostiqué à tort comme étant fonctionnel ou psychogène (dans 38 % des cas), des tics (dans 29 % des cas) et une paralysie du nerf facial (dans 9 % des cas).19 La présentation clinique implique des spasmes initiaux de l’orbicularis oculi qui progressent ou s’étendent progressivement avec le temps pour impliquer d’autres muscles sur une moitié du visage, tels que le frontalis, l’orbicularis oris, le triangularis ou le mentalis, et même le muscle platysma.7,18 Les symptômes du HFS peuvent persister pendant le sommeil, alors que ceux du BEB ne le font pas.
La pathophysiologie du HFS implique une compression du nerf facial au niveau de sa zone de sortie de la racine (REZ) du tronc cérébral, qui a été décrite pour la première fois en 1947.20 La compression peut être causée par des vaisseaux aberrants, notamment l’artère cérébelleuse inférieure antérieure, l’artère cérébelleuse inférieure postérieure, l’artère basilaire, l’artère vertébrale ; des malformations artério-veineuses ; et très rarement par des tumeurs telles que les schwannomes acoustiques, les méningiomes, les tumeurs de la glande parotide et les astrocytomes pilocytiques7. Bien que le diagnostic de l’HFS soit principalement clinique, une IRM doit toujours être réalisée pour exclure une compression du nerf facial comme décrit ci-dessus. Un test électromyographique peut également être effectué pour démontrer une réponse pathognomonique de propagation latérale des impulsions entre les fibres voisines du nerf facial (« transmission éphaptique »).20
Le pilier du traitement de l’HFS sont les injections de toxine botulique comme décrit ci-dessus pour le BEB. Pour l’HFS, cinq à dix sites sont injectés sur le côté affecté du visage avec des doses totales d’onabotulinumtoxinA allant de 10 à 34 unités par traitement.20 Le traitement définitif de l’HFS est la décompression microvasculaire neurochirurgicale (DMV) pour soulager la compression du nerf facial au niveau de son REZ. Dans des études antérieures, environ 95 % des patients qui ont subi une DMV pour une SFS ont obtenu de bons, voire d’excellents résultats, avec des effets indésirables tels qu’une paralysie du nerf facial dans 19 % des cas, des déficiences auditives dans 7 % des cas et des paralysies des nerfs crâniens inférieurs dans 2,8 % des cas21. Compte tenu du caractère invasif et des risques associés au fait de subir une intervention neurochirurgicale, il est de la plus haute importance d’avoir une discussion franche avec les patients concernant les risques et les avantages de la MVD par rapport aux injections de toxine botulique, ou une combinaison des deux, pour la gestion du SFS.
Le traitement définitif du spasme hémifacial est la décompression microvasculaire (MVD) neurochirurgicale pour soulager la compression du nerf facial à sa zone de sortie radiculaire.
En conclusion, les spasmes des paupières et du visage représentent un spectre de troubles involontaires des mouvements faciaux qui peuvent avoir un impact sévère sur la qualité de vie et le bien-être psychologique des patients. Bien que l’évitement des facteurs incitatifs soit recommandé dans la prise en charge, les injections de toxine botulique se sont imposées comme traitement de première intention, en particulier pour le BEB et le HFS. Le traitement chirurgical du BEB et du HFS peut toutefois être poursuivi dans les cas réfractaires ou chez les patients intolérants aux injections de toxine botulique. Compte tenu des erreurs fréquentes de diagnostic de ces troubles, il est important que les médecins connaissent les signes et symptômes les plus courants afin de mettre ces patients en relation avec des neurologues ou des ophtalmologistes pour une évaluation et une prise en charge plus poussées. REVUE
Le Dr Gervasio est résident en ophtalmologie au Wills Eye Hospital. Le Dr Moster est médecin traitant au service de neuro-ophtalmologie de Wills et professeur de neurologie et d’ophtalmologie à l’université Thomas Jefferson de Philadelphie. Il est président du service de neuro-ophtalmologie au Einstein Medical Center de Philadelphie.
1. Hwang CJ, Eftekhari K. Benign essential blepharospasm : Ce que nous savons et ce que nous ne savons pas. Int Ophthalmol Clin 2018;58:1:11-24.
2. Miller NR. Myokymie des paupières. Surv Ophthalmol 2011;56:3:277-8.
3. Barmettler A, Dinkin MJ, Lelli GJ. Myokymie des paupières : Pas toujours bénigne. Orbit 2011;30:6:289-90.
4. Jordan DR, Anderson RL, Thiese SM. Myokymie orbiculaire réfractaire : Alternatives de traitement. Ophthalmic Surg 1989;20:4:280-3.
5. Horowitz SH. Spasme hémifacial et myokymie faciale : Résultats électrophysiologiques. Muscle Nerve 1987;10:422-427.
6. Mackenzie W. Case of intense and long-continued photophobia and blepharospasm, relieved by the inhalation of chloroform. Med Chir Trans 1857;40:175-178.
7. Ozzello DJ, Giacometti JN. Toxines botuliques pour le traitement du blépharospasme essentiel et du spasme hémifacial. Int Ophthalmol Clin 2018;58:1:49-61.
9. Baker RS, Andersen AH, Morecraft RJ, et al. Une étude d’imagerie par résonance magnétique fonctionnelle chez les patients atteints de blépharospasme essentiel bénin. J Neuroophthalmol 2003;23:11-15.
10. Schicatano EJ, Basso MA, Evinger C. Le modèle animal explique les origines de la dystonie crânienne blépharospasme essentiel bénin. J Neurophysiol 1997;77:2842-2846.
11. Yen MT. Développements dans le traitement du blépharospasme essentiel bénin. Curr Opin Ophthalmol 2018;29:440-44.
12. Coscarelli JM. Blépharospasme essentiel. Semin Ophthalmol 2010;25:3:104-8.
13. Herz NL, Yen MT. Modulation de la photophobie sensorielle dans le blépharospasme essentiel avec des lentilles chromatiques. Ophthalmology 2005;112:2208-2211.
14. Broadbent TJ, Wesley RE, Mawn LA. Une enquête sur les modèles actuels de traitement du blépharospasme parmi les chirurgiens oculoplastiques. Ophthalmic Plast Reconstr Surg 2016;32:1:24-7.
15. Ben Simon GJ, McCann JD. Blépharospasme essentiel bénin. Int Ophthalmol Clin 2005;45:49-75.
16. Auger RG, Whisnant JP. Spasme hémifacial à Rochester et dans le comté d’Olmsted, Minnesota, de 1960 à 1984. Arch Neurol 1990;47:1233-34.
17. Nilsen B, Le KD, Dietrichs E. Prévalence du spasme hémifacial à Oslo, Norvège. Neurology 2004;63:1532-33.
18. Lefaucheur JP, Daamer NB, Sangla S, Guerinel CL. Diagnostic du spasme hémifacial primaire. Neurochiurgie 2018;64:2:82-86.
19. Martinez AR, Nunes MD, Immich ND, et al. Le mauvais diagnostic du spasme hémifacial est un événement fréquent dans le cadre des soins primaires. Arq Neuropsiquiatr 2014;72:119-22.
20. Campbell E, Keedy C. Spasme hémifacial : Une note sur l’étiologie dans deux cas. J Neurosurg 1947;4:342-47.
21. Huh R, Han IB, Moon JY, et al. Décompression microvasculaire pour spasme hémifacial : Analyses des complications opératoires chez 1582 patients consécutifs. Surg Neurol 2008;69:153-57.