INTRODUCTION
慢性収縮性心膜炎は、心膜の線維化と肥厚を引き起こす慢性炎症性プロセスにより発症し、拡張期心室充填を制限する弾力性を喪失させる稀な疾患である。 心膜切除術は、心動態を改善する唯一の治療法として確立されている。 本研究では、慢性収縮性心膜炎に対して手術を行った患者の短期および長期の成績について解析した
METHODS
1982年11月から2005年6月に当センターで慢性収縮性心膜炎に対して心膜切除を行った全患者について後向き研究を行った。 臨床的,心エコー的,血行動態的に心膜収縮の徴候があり,切除組織の病理学的解析により診断が確定した患者を対象とした。 特発性心膜収縮症では,膠原病や尿毒症などの他の全身性疾患を除外した。 これらの基準を満たしたのは、連続した31人の患者であった。 51歳(21歳)の男性17名、女性14名である。 1982年から1990年には6例,1991年から1997年には10例,1998年から2005年には15例の手術が行われた. 心膜切除術は全例、体外循環を行わず、灌流装置を準備した上で、胸骨正中切開で行われた。 手術中、冠動脈疾患のために静脈グラフトを必要とした症例は1例もなかった。 平均入院日数は17日(範囲5~46、中央値13)であった。 平均追跡期間は6.7年(<221><7075>院内死亡は,術後30日以内または院内での死亡と定義した。 生存した患者と≦6か月で死亡した患者の連続変数の差は,ノンパラメトリックのMann-Whitney U検定を用いて決定した。 質的変数はχ2を用いて解析した。 累積生存確率はKaplan-Meier生存曲線で決定した。 結果はパーセンテージと平均値(SD)、変数の分布が正規分布でない場合は中央値で表した。 P
RESULTS
心膜炎の病因は,特発性15例(48%),結核性9例(29%),放射線療法後3例(9%),新生物2例(6%),心臓手術後2例(6%)であった. 図1は1982-1990年、1991-1997年、1998-2005年の慢性収縮性心膜炎の原因分布を示している。 術後の狭窄は心臓弁膜症の手術後14年以上で臨床的に現れ、放射線治療後の発表はホジキン病に対する治療後6年以上であった。
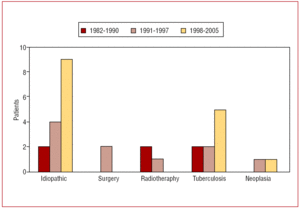
図1.心膜切除術を受けた患者における慢性収縮性心膜炎の原因の時間的分布
症状の平均経過は17(1-120;5)カ月であった。 表1に評価した変数を示す。 術前のNYHA(New York Heart Association)機能分類で患者を分類すると、9人(29%)がクラスI、21人(67%)がII~III、1人(3%)がIVであった。

院内死亡率は16%(5/31人)であった。 死亡率は3つの期間に以下のように分布していた。 1982-1990年は6例中0例,1991-1997年は10例中3例,1998-2005年は15例中2例が手術された。 死因は心室充満圧上昇を伴う右室不全による低心拍出量3例,心不全に伴う敗血症1例,心房裂傷,凝固低下,血液量減少性ショックによる出血1例であり,術前NHA機能分類III-IVの14例中3例が心不全で,機能分類I-IIの17例は心不全1,出血1(2/17例,11.7%)で死亡していた. 臨床的,心エコー的,血行動態的な変数,症状の進展時間,死亡率との間に関連はみられなかった. 石灰化の有無は死亡率の上昇と関連しなかった。石灰化のある患者6名が生存し、2名が心不全で死亡した。
図2は生存者26名の術前術後の機能分類を示したものである。 機能分類は手術にもかかわらず6名であまり改善せず、放射線治療を受けた1名で徐々に悪化した。
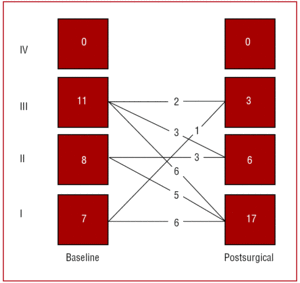
図2. 慢性収縮性心膜炎に対する心膜切除術前後の機能クラス。
追跡期間中に4名が死亡した。1名は晩期心不全(放射線照射後)、2名は新生物(胸膜中皮腫によるホジキンリンパ腫患者、転移性腺癌1名)で死亡した。 残りの1名は脳卒中で死亡した。 累積数理生存率は6カ月で82%,1~9年で82%,10年で64%であった(図3)
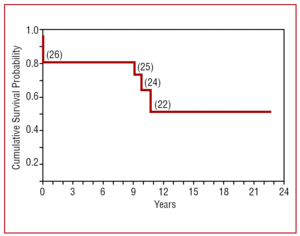
図3. 慢性収縮性心膜炎に対して心膜切除術を受けた患者の累積生存確率。 221>
DISCUSSION
過去、慢性収縮性心膜炎の最も頻繁な病因は結核で、いくつかの国では心膜切除術の半数の原因となっている。1 特定のセンターでは、縦隔照射後の心膜炎が患者の1/3の手術原因となり得る2 当センターでは特発性のものが最も頻繁な原因であった。 心臓手術後の慢性収縮性心膜炎はまれで、手術後数年経ってから出現する。 この合併症の発生率は0.025%~0.3%のオーダーである。3 本シリーズでは、僧帽弁手術後に狭窄を起こした患者は2名のみであった。
院内死亡率は16%であった。 他のシリーズでは、死亡率は5.3%~15%である。1 術後直後の死亡の主因は、右室不全を伴う低心拍出量症候群であった。 本研究では5例中4例がこの原因による死亡であった。 McCaughanら3 は、心膜切除後の患者の28%が、心膜切除の範囲とは無関係に低出力症候群を呈し、これは心拡張と心筋萎縮に伴う心室機能障害と関連していると報告している3,4。心膜切除後、ほとんどの患者の症状は改善するが、臨床反応は遅く数ヶ月を要することもある。 しかし、心膜切除術後、ほとんどの患者の症状は改善するが、臨床的な反応は遅く、数ヶ月かかる。後期追跡調査(平均21ヶ月)では、心臓ドップラーにより、術直後の患者の40%のみが拡張機能が正常で、43%が収縮-再狭窄の拡張パターンを示している5
我々のシリーズは、慢性狭窄性心膜炎は比較的少ないため調査患者数が少なく、予後の悪い要素を特定できなかった理由のひとつと思われる。 院内死亡率は,高齢,症状の持続期間,機能分類,心房細動の有無,左室機能障害,腎不全,低ナトリウム血症,高ビリルビン血症,右房圧上昇と関連している6-8。病因については,縦隔照射後の心膜切除が最も予後悪く,晩期生存率は1であるが,32年間で死亡率が16%から11%に低下したことを見出し,周術期治療の改善によるものと考えている。
コンピュータ断層撮影と磁気共鳴は、狭窄の範囲を決定し、石灰化の存在と隣接心筋の線維化または萎縮の程度を評価するのに特に有効な診断技術である9。 重度の慢性収縮性心膜炎では、心膜の肥厚はわずかであるが、心膜がかなり肥厚していると収縮が起こらないことがあることを忘れてはならない。 前者は左心室の露出が良好であるが,両骨神経の間にある前外側壁側心膜をすべて切除でき,右房・左房圧の低い薄壁の臓側心膜の切除や心外膜切除が容易で,胸腔の探査もできるため,我々は胸骨正中切開術を選択する。 心外膜が癒着していたり出血していたりして心外膜切除が不可能な部位では、線状に切開したり帯状に切除したりして、胸腔の拡張を可能にしている。 術後の低出力症候群の出現は、比較的高い院内死亡率の主な原因である。 経過観察中,拡張期心機能の完全な回復のために明らかな臨床的改善を示さない患者もいるが,これはおそらく隣接する線維性心筋の変化が原因である. 線維化および/または心筋萎縮を有する患者を特定することは、罹患率と死亡率の低減に役立つ可能性がある。