W komórkowym ramieniu adaptacyjnej odpowiedzi immunologicznej, krótkie peptydy są wiązane przez cząsteczki major histocompatibility complex (MHC) klasy I i klasy II i prezentowane na powierzchni komórek, gdzie są rozpoznawane przez receptory antygenowe limfocytów T. Związanie receptora komórek T (TCR), który rozpoznaje określony kompleks MHC-peptyd, indukuje różnicowanie się naiwnych limfocytów w komórki efektorowe (cytotoksyczne i pomocnicze komórki T), które niszczą zainfekowane komórki gospodarza lub stymulują wytwarzanie przeciwciał, oraz komórki pamięci, które zapewniają odporność ochronną przed ponowną infekcją.
Struktura i funkcja cząsteczek MHC
Dwie rodziny wielogenowe zlokalizowane w regionie genomowym MHC kodują cząsteczki wiążące antygen, które prezentują obce peptydy na powierzchni komórki. W rzeczywistości, cząsteczki MHC prezentują również peptydy pochodzące z własnego organizmu. Jednakże, negatywna selekcja grasicy przeciwko autoreaktywnym limfocytom T uniemożliwia kompleksom MHC-samopochodne peptydy wywołanie odpowiedzi immunologicznej. Cząsteczki MHC klasy I ulegają ekspresji na większości komórek jądrzastych i zwykle prezentują endogenne peptydy pochodzące z wewnątrzkomórkowych patogenów replikujących się w cytozolu (np. wirusów). Białka cytozolowe są degradowane do krótkich fragmentów peptydowych przez proteasom i są najpierw transportowane do retikulum endoplazmatycznego (ER) przez zależne od ATP transportery TAP1 & 2 w celu załadowania MHCI, a następnie na powierzchnię komórki w celu prezentacji krążącym cytotoksycznym limfocytom T CD8+, których funkcją jest wywołanie apoptozy i lizy zainfekowanej komórki docelowej. (Rysunki zostały zaadaptowane z Murphy et al. (2008) Rys. 3.12, 3.25, 5.5, & 5.11.)
Konstytutywna ekspresja loci MHC klasy II jest ograniczona do prezentujących antygen komórek układu odpornościowego (APC, np. makrofagów, komórek dendrytycznych i limfocytów B). Cząsteczki MHCII są stabilizowane i uniemożliwiane wiązanie antygenu podczas pobytu w ER poprzez asocjację z łańcuchem niezmiennym klasy II (Ii, lub CD74), a następnie są przekierowywane z domyślnego szlaku wydzielniczego na szlak endocytarny. Tam napotykają peptydy pochodzące od patogenów replikujących się w pęcherzykach wewnątrzkomórkowych lub od patogenów zewnątrzkomórkowych i białek transportowanych do wnętrza komórki. Stabilne wiązanie peptydów jest katalizowane przez nieklasyczny dimer MHCII DMα/β i umożliwia kompleksom MHCII-peptyd wydostanie się ze szlaku endocytarnego w celu prezentacji na powierzchni komórki. Rozpoznanie przez komórki CD4+ T aktywuje docelową komórkę gospodarza do pobudzenia mechanizmów antybakteryjnych (w makrofagach) lub do uruchomienia produkcji przeciwciał i humoralnej odpowiedzi immunologicznej.
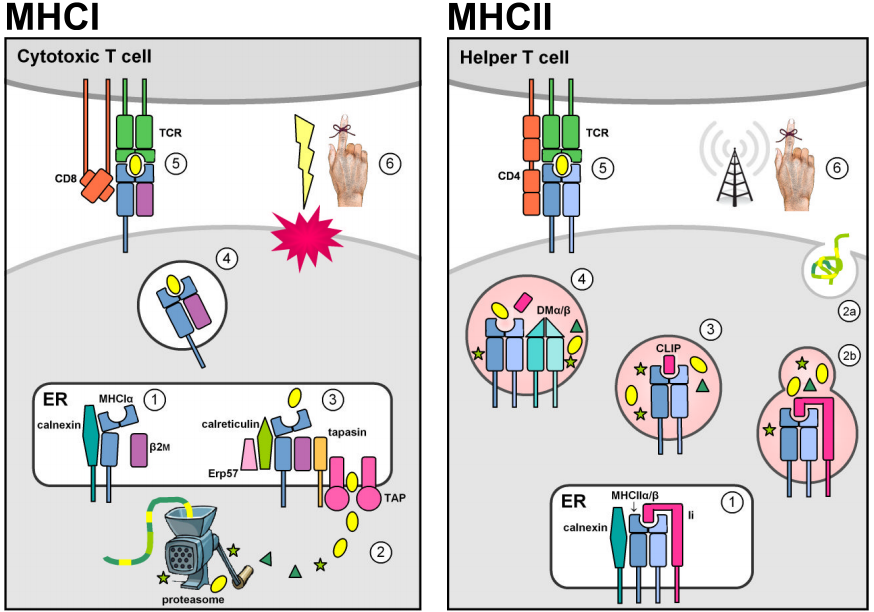
Podobieństwa strukturalne cząsteczek MHCI i MHCII prawdopodobnie odzwierciedlają ich pochodzenie od wspólnego przodka. Dojrzałe cząsteczki MHC są integralnymi glikoproteinami błonowymi typu I, składającymi się z rowka wiążącego peptydy oraz domen immunoglobulinopodobnych, transmembranowych i cytoplazmatycznych. Zewnątrzkomórkowe części cząsteczek MHC składają się z dwóch domen błonowo-dystalnych, które razem tworzą jamę wiążącą peptydy, ograniczoną przez dwie przerwane helisy α spoczywające na szczycie antyrównoległej blaszki β, oraz dwie błonowo proksymalne domeny immunoglobulinopodobne (Ig-like), które uczestniczą w wiązaniu receptorów rdzeniowych CD4 i CD8.
Pomimo tych strukturalnych podobieństw, podjednostki białkowe są kodowane odmiennie dla cząsteczek klasy I i II. Cząsteczki MHCI są heterodimerami utworzonymi przez niekowalencyjne połączenie łańcucha ciężkiego MHCIα z β2-mikroglobuliną (β2m), która jest kodowana przez w dużej mierze niezmienne locus znajdujące się poza regionem genomu MHC. Łańcuch ciężki zawiera zarówno szczelinę wiążącą peptydy, jak i jedną z domen Ig-podobnych, podczas gdy β2m zawiera tylko drugi region Ig-podobny, pozbawiony kotwicy transmembranowej. Cząsteczki MHC klasy II są heterodimerami, które powstają w wyniku niekowalencyjnego połączenia łańcucha α i β, z których oba wnoszą pojedyncze domeny Ig-podobne wiążące peptydy i zakotwiczone w błonie, a każdy z nich jest transkrybowany z odrębnego locus, zwykle znajdującego się w regionie MHC.
Członków rodziny genów MHC można dalej podzielić na klasyczne i nieklasyczne loci, oprócz niefunkcjonalnych pseudogenów. Klasyczne loci MHC Ia ulegają szerokiej ekspresji i są zwykle związane z dużą zmiennością sekwencji i pozytywną selekcją działającą na substytucje w resztach regionu wiążącego peptydy (PBR). Nieklasyczne loci MHC Ib charakteryzują się natomiast zmniejszoną ekspresją lub ograniczoną dystrybucją tkankową, mniejszym polimorfizmem i mogą pełnić ograniczone lub zmodyfikowane funkcje. W przypadku genów klasy II termin „klasyczny” odnosi się zwykle do wszystkich loci prezentujących antygen, podczas gdy termin „nieklasyczny” jest zarezerwowany dla genów takich jak DMα/β, które pełnią rolę pomocniczą w szlaku prezentacji antygenów. Chociaż ta funkcjonalna kategoryzacja członków rodziny genów zapewnia użyteczne słownictwo robocze, granica między klasycznymi i nieklasycznymi loci nie zawsze jest jasna w praktyce, a niektóre nieklasyczne loci MHCI są polimorficzne, szeroko wyrażone lub wiążą ligandy peptydowe w tradycyjny sposób klasycznych genów.
Wysoki polimorfizm na poziomie populacji i dowody równoważącej selekcji wskazują, że znaczna zmienność alleliczna genów MHC jest prawdopodobnie potrzebna do rozpoznania i odpowiedzi na zróżnicowany zestaw patogenów. Jednakże, pomimo rozległej duplikacji genów u niektórych gatunków, osobniki zwykle wykazują jedynie umiarkowaną liczbę klasycznych loci MHC, a powrót do dziedziczenia disomicznego obserwuje się także u niektórych poliploidalnych gatunków Xenopus. Uważa się, że ograniczenia wewnątrz-indywidualnej zmienności MHC (przynajmniej w przypadku wysoko wyrażonych klasycznych loci) odzwierciedlają funkcjonalny kompromis między zwiększeniem repertuaru alleli w celu prezentacji większej różnorodności patogennych peptydów a towarzyszącą temu redukcją repertuaru komórek T, która byłaby konieczna do utrzymania samotolerancji. Poszczególne cząsteczki MHC muszą być zatem zdolne do permisywnego wiązania peptydów, aby odpowiednio rozpoznawać szeroki zakres obcych antygenów. Jednakże, istnieje również potrzeba wytworzenia stabilnych kompleksów MHC-peptyd, które będą utrzymywać się przez wystarczający czas, aby umożliwić rozpoznanie komórek T i które nie będą wymieniać peptydów na powierzchni komórek, co mogłoby spowodować zniszczenie niezainfekowanych komórek. Taka stabilność jest ogólnie związana z wysokim powinowactwem, a zatem ograniczającymi oddziaływaniami międzycząsteczkowymi.
.