ATP, NAD I FAD
ATP
Komórki wykorzystują cząsteczkę zwaną trójfosforanem adenozyny (lub ATP) jako źródło energii (patrz rysunek 2). Fosforany w tej cząsteczce mogą dostarczać energię do substratów w naszych komórkach. W naszych komórkach istnieją enzymy, które mogą usunąć fosforan z ATP i dołączyć go do innej cząsteczki – zwykle do białka (patrz rysunek 3). Kiedy tak się dzieje, mówimy, że białko zostało ufosforylowane. Pomyśl o trzecim fosforanie jako o małym woreczku energii. Kiedy zostaje on przeniesiony do białka, energia ta może zostać wykorzystana do wykonania jakiejś czynności. Na przykład, na rysunku 3, białko zmienia swój kształt, gdy zostaje ufosforylowane. Kiedy białka zmieniają swój kształt, często nazywamy to zmianą konformacyjną struktury białka. W organizmie istnieje wiele białek, które wykorzystują fosforan z ATP do wywołania zmiany konformacyjnej. Ta zmiana kształtu białka ostatecznie umożliwia skurcz mięśni, ruchliwość komórek, transport membranowy i działanie enzymów. Komórki i życie istnieją tylko wtedy, gdy dostępna jest spójna i stała dostawa ATP.
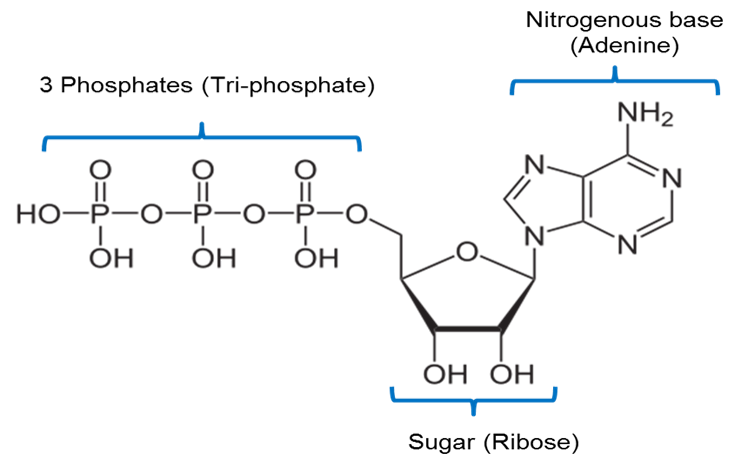
Image created by JS at BYU Idaho F2013.
Powyższy obraz jest reprezentacją struktury chemicznej ATP. ATP zawiera zasadę azotową zwaną adeniną połączoną z 5-węglowym cukrem zwanym rybozą oraz 3 grupy fosforanowe.
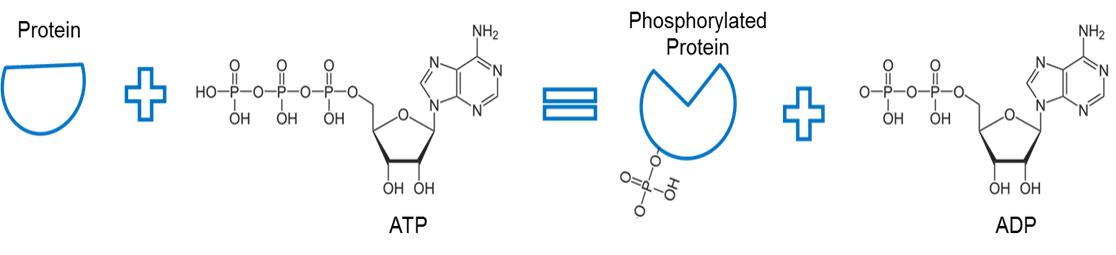
Image created by JS at BYU Idaho F2013.
ATP jest używany do fosforylacji białka. Enzym, zwany kinazą (nie pokazano) usuwa fosforan z ATP i ułatwia wiązanie między fosforanem a innym białkiem. Wiązanie fosforanu z białkiem w ten sposób nazywane jest fosforylacją. Kość fosforanowa z białkiem ma wyższą energię. Zauważ, że fosforylacja wykorzystuje tę energię do wywołania zmiany konformacyjnej kształtu białka.
NAD i FAD
Dinukleotyd nikotynamidowo-adeninowy (NAD) i dinukleotyd flawinowo-adeninowy (FAD) są koenzymami biorącymi udział w odwracalnych reakcjach utleniania i redukcji. Często mówi się, że związki te są nośnikami elektronów, ponieważ przyjmują one elektrony (ulegają redukcji) podczas katabolicznych etapów rozpadu cząsteczek organicznych, takich jak węglowodany i lipidy. Następnie, te zredukowane koenzymy mogą przekazać te elektrony do innej reakcji biochemicznej normalnie zaangażowanej w proces, który jest anaboliczny (jak synteza ATP).
NAD+ / NADH
Dinukleotyd nikotynamido-adeninowy w stanie utlenionym jest nazywany NAD+, po zredukowaniu (lub przyjęciu elektronów), jest określany jako NADH. Zobacz rysunek 4, aby zapoznać się z ilustracją molekularną. Witamina Niacyna (zwana również B3) jest używana do otrzymywania tego związku. Niacyna zapewnia organiczną strukturę pierścienia, która bezpośrednio uczestniczy w transferze atomu wodoru i 2 elektronów. NAD+ jest często spotykany w połączeniu z enzymem „dehydrogenazą”. Reakcja dehydrogenazy usuwa dwa atomy wodoru; jeden jako wodorek (:H-) (wodorek to atom wodoru z 2 elektronami) i jeden jako kation wodoru (H+) (oczywiście, kation wodoru nie ma elektronów). Wodorek łączy się z NAD+ i tworzy zredukowany związek dinukleotydu nikcynoamidowo-adeninowego (NADH). Drugi atom wodoru (H+) jest uwalniany do roztworu patrz rysunek 4.
Jak zbadasz reakcje metabolizmu, poszukaj reakcji, które dają NADH. NADH będzie ważny, ponieważ dostarczy hydrogeny i elektrony, które odbiera do procesów biochemicznych, które mogą wykorzystać elektrony i hydrogeny do wytworzenia ATP.
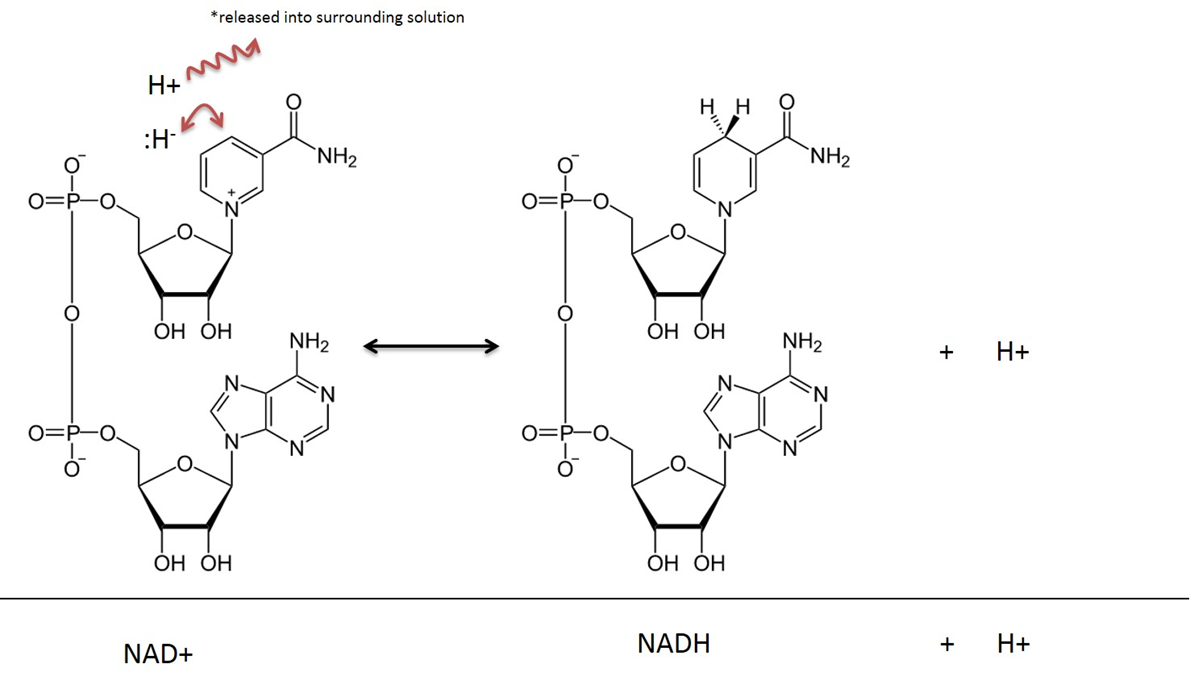
Image created by JS at BYU Idaho F2013.
W reakcjach metabolicznych, które angażują NAD, dwa atomy wodoru i dwa elektrony są usuwane z substratu i przenoszone na NAD+. NAD+ przyjmuje jon wodorkowy (wodór z 2 elektronami) i staje się dinukleotydem nikotynamidowo-adeninowym w formie zredukowanej (NADH). Kation wodorowy, który również został wychwycony w tej reakcji, jest uwalniany do otaczającego roztworu. Pamiętaj, że ta reakcja jest odwracalna.
W wyjaśnieniu reakcji zachodzących w Metabolizmie, powszechne jest ignorowanie H+ uwalnianego do roztworu i w tym tekście wynik redukcji NAD będzie przedstawiony jako po prostu NADH, a nie NADH + H+.
FAD / FADH2
Dinukleotyd adeninowy flawiny w stanie utlenionym jest nazywany FAD. Po zredukowaniu nazywany jest FADH2. Zobacz rysunek 5, aby zobaczyć ilustrację molekularną. Witamina, ryboflawina (lub B2) jest używana do otrzymywania tego związku. Ryboflawina dostarcza struktur pierścieniowych, które będą bezpośrednio uczestniczyć w przeniesieniu dwóch atomów wodoru (tym razem każdy z jednym elektronem). Podobnie jak NAD, FAD działa w połączeniu z enzymem „dehydrogenazą”. W wyniku reakcji usuwane są dwa atomy wodoru; każdy z nich to proton z jednym elektronem. Oba atomy wodoru wiążą się z FAD. Ta reakcja nie uwalnia H+ do roztworu, tak jak redukcja NAD.
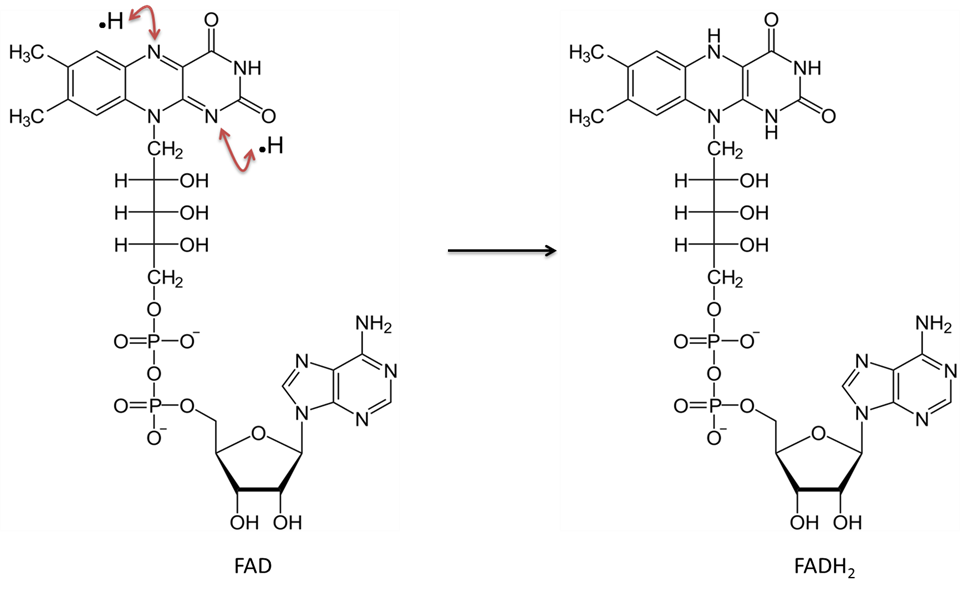
Obraz stworzony przez JS w BYU Idaho F2013.
Dinukleotyd adeninowy flawiny w formie utlenionej (FAD) przyjmuje dwa atomy wodoru (każdy z jednym elektronem) i staje się FADH2.
Jak zbadasz reakcje metabolizmu, poszukaj reakcji, która daje FADH2. Podobnie jak NADH, FADH2 będzie ważny, ponieważ dostarczy hydrogeny i elektrony do procesów biochemicznych, które mogą wykorzystać elektrony i hydrogeny do wytworzenia ATP.
**Możesz użyć poniższych przycisków, aby przejść do następnej lub poprzedniej lektury w tym module**

