Nazwa ogólna: chlorowodorek naftifiny
Postać dawkowania: żel
Medically reviewed by Drugs.com. Ostatnia aktualizacja w dniu 1 kwietnia 2020 r.
- Przegląd
- Skutki uboczne
- Dawkowanie
- Profesjonalista
- Ciąża
- Więcej
- Wskazania i stosowanie Stosowanie leku Naftin Żel
- Naftin Żel dawkowanie i podawanie
- Postacie dawkowania i moc
- Przeciwwskazania
- Ostrzeżenia i środki ostrożności
- Lokalne działania niepożądane
- Działania niepożądane
- Doświadczenia z badań klinicznych
- Doświadczenia po wprowadzeniu leku na rynek
- STOSOWANIE W POSZCZEGÓLNYCH POPULACJACH
- Ciąża
- Laktacja
- Stosowanie u dzieci
- Stosowanie w pediatrii
- Naftin Gel Opis
- Naftin Żel – Farmakologia kliniczna
- Mechanizm działania
- Farmakodynamika
- Farmakokinetyka
- Mikrobiologia
- Toksykologia niekliniczna
- Carcinogenesis, Mutagenesis, Impairment of Fertility
- Badania kliniczne
- Jak dostarczać/składować and Handling
- Informacje dla pacjenta
- PRINCIPAL DISPLAY PANEL – 45g Tube Carton
- PRINCIPAL DISPLAY PANEL – 60 g Tube Carton
- Więcej o Naftin (naftifine topical)
- Zasoby dla konsumentów
- Zasoby dla profesjonalistów
- Inne preparaty
- Poradniki dotyczące leczenia
Wskazania i stosowanie Stosowanie leku Naftin Żel
NAFTIN ® Żel jest alilaminowym lekiem przeciwgrzybiczym wskazanym w leczeniu grzybicy stóp wywołanej przez organizmy Trichophyton rubrum, Trichophyton mentagrophytes i Epidermophyton floccosum.
Naftin Żel dawkowanie i podawanie
Nakładać cienką warstwę NAFTIN ®Żelu raz dziennie na zmienione chorobowo miejsca plus około ½ cala marginesu zdrowej otaczającej skóry przez 2 tygodnie.
Do stosowania wyłącznie miejscowego. NAFTIN ® Żel nie jest przeznaczony do stosowania okulistycznego, doustnego lub dopochwowego.
Postacie dawkowania i moc
Żel, 2%. Każdy gram zawiera 20 mg chlorowodorku naftifiny w postaci bezbarwnego do żółtego żelu.
Przeciwwskazania
Brak.
Ostrzeżenia i środki ostrożności
Lokalne działania niepożądane
Jeżeli podczas stosowania leku NAFTIN ® Gel wystąpi podrażnienie lub nadwrażliwość, leczenie należy przerwać.
Działania niepożądane
Doświadczenia z badań klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych danego leku nie może być bezpośrednio porównywana z częstością obserwowaną w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanej w praktyce klinicznej.
W dwóch randomizowanych badaniach kontrolowanych z użyciem nośnika, 1143 uczestników było leczonych NAFTIN ® Żelem w porównaniu do 571 uczestników leczonych nośnikiem. Uczestnicy badania mieli od 12 do 92 lat, byli głównie mężczyznami (76%) i w 59% byli rasy kaukaskiej, w 38% czarnoskórzy lub afroamerykańscy, a w 23% latynoscy lub latynoscy. Uczestnicy otrzymywali dawki raz na dobę, miejscowo, przez 2 tygodnie, aby pokryć chorobowo zmienione obszary skóry oraz ½-calowy margines otaczającej zdrowej skóry. Najczęstszymi działaniami niepożądanymi były reakcje w miejscu aplikacji, które występowały z częstością 2% w ramieniu z lekiem Naftin Gel i 1% w ramieniu z lekiem. Większość działań niepożądanych miała łagodne nasilenie.
W otwartym badaniu farmakokinetyki i bezpieczeństwa u dzieci 22 pacjentów w wieku 12-17 lat z grzybicą stóp otrzymywało NAFTIN ® Żel. Częstość występowania działań niepożądanych w populacji dziecięcej była podobna do obserwowanej w populacji dorosłych.
Kumulacyjne badanie działania drażniącego wykazało możliwość wywoływania podrażnień przez NAFTIN ®Żel. Nie było dowodów na to, że NAFTIN ® Gel powoduje uczulenie kontaktowe, fototoksyczność lub fotoalergiczność w zdrowej skórze.
Doświadczenia po wprowadzeniu leku na rynek
Ponieważ reakcje te są zgłaszane dobrowolnie z populacji o niepewnej wielkości, nie zawsze jest możliwe wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek. Podczas stosowania chlorowodorku naftifiny po zatwierdzeniu zidentyfikowano następujące działania niepożądane: pęcherze, uczucie pieczenia, tworzenie się strupów, suchość, rumień/czerwoność, zapalenie, podrażnienie, maceracja, ból, świąd/swędzenie, wysypka i obrzęk.
STOSOWANIE W POSZCZEGÓLNYCH POPULACJACH
Ciąża
Podsumowanie ryzyka
Brak dostępnych danych dotyczących stosowania NAFTIN®Żel u kobiet w ciąży w celu oceny związanego z lekiem ryzyka wystąpienia poważnych wad wrodzonych, poronienia lub niekorzystnych wyników matczynych lub płodowych.
W badaniach nad reprodukcją na zwierzętach nie zaobserwowano niekorzystnego wpływu na rozwój zarodka w przypadku dawek doustnych podawanych w okresie organogenezy do 37-krotności maksymalnej zalecanej dawki u ludzi (MRHD) u ciężarnych szczurów lub dawek podskórnych podawanych w okresie organogenezy do 4-krotności MRHD u ciężarnych szczurów lub 7-krotności MRHD u ciężarnych królików (patrz Dane).
Wszystkie ciąże obarczone są ryzykiem tła wad wrodzonych, utraty lub innych niekorzystnych wyników. Szacowane ryzyko tła poważnych wad wrodzonych i poronień dla wskazanej populacji jest nieznane. W populacji ogólnej Stanów Zjednoczonych szacowane ryzyko tła poważnych wad wrodzonych i poronień w ciążach rozpoznanych klinicznie wynosi odpowiednio od 2 do 4% i od 15 do 20%.
Dane
Dane dotyczące zwierząt
Badania systemowego rozwoju embrionalnego przeprowadzono na szczurach i królikach. W celu porównania dawek stosowanych u zwierząt z dawkami stosowanymi u ludzi, MRHD ustalono na poziomie 4 g 2% żelu na dobę (1,33 mg/kg/dobę dla osobnika o masie ciała 60 kg).
Dawki doustne 30, 100 i 300 mg/kg/dobę chlorowodorku naftifiny podawano w okresie organogenezy ciężarnym samicom szczurów. W przypadku dawek do 300 mg/kg/dobę (37-krotność MRHD w oparciu o porównanie mg/m 2) nie odnotowano żadnego wpływu związanego z leczeniem na toksyczność embrionalną. Podskórne dawki 10 i 30 mg/kg/dobę chlorowodorku naftifiny podawano w okresie organogenezy ciężarnym samicom szczurów. Nie stwierdzono wpływu leczenia na toksyczność embrionalną przy dawce 30 mg/kg/dobę (4-krotność MRHD w oparciu o porównanie mg/m 2). Podskórne dawki 3, 10 i 30 mg/kg/dobę chlorowodorku naftifiny podawano w okresie organogenezy ciężarnym samicom królików. Nie stwierdzono wpływu związanego z leczeniem na toksyczność embrionalną przy dawce 30 mg/kg/dobę (7-krotność MRHD na podstawie porównania mg/m 2).
Badanie rozwoju około- i pourodzeniowego przeprowadzono u szczurów. Samicom szczurów podawano doustnie dawki 30, 100 i 300 mg/kg/dobę chlorowodorku naftifiny od 14. dnia ciąży do 21. dnia laktacji. Zmniejszony przyrost masy ciała samic w czasie ciąży i potomstwa w czasie laktacji odnotowano przy dawce 300 mg/kg/dobę (37-krotność MRHD w oparciu o porównanie mg/m 2). Nie stwierdzono toksyczności rozwojowej przy dawce 100 mg/kg/dobę (12-krotność MRHD w oparciu o porównanie mg/m 2).
Laktacja
Podsumowanie ryzyka
Brak dostępnych informacji na temat obecności chlorowodorku naftifiny w mleku ludzkim, wpływu leku na niemowlę karmione piersią lub wpływu leku na wytwarzanie mleka po zastosowaniu miejscowym żelu Naftin u kobiet karmiących piersią. Nie wiadomo, czy chlorowodorek naftifiny jest wydzielany do mleka ludzkiego. Ponieważ wiele leków jest wydzielanych do mleka ludzkiego, należy zachować ostrożność w przypadku podawania chlorowodorku naftifiny kobiecie karmiącej piersią.
Brak danych klinicznych w okresie laktacji wyklucza jednoznaczne określenie ryzyka, jakie stwarza Naftin Gel dla niemowlęcia w okresie laktacji. Dlatego należy rozważyć korzyści rozwojowe i zdrowotne wynikające z karmienia piersią wraz z kliniczną potrzebą stosowania produktu leczniczego Naftin Gel przez matkę oraz wszelkie potencjalne działania niepożądane u niemowlęcia karmionego piersią wynikające ze stosowania produktu leczniczego Naftin Gel lub z podstawowego stanu zdrowia matki.
Stosowanie u dzieci
Bezpieczeństwo i skuteczność stosowania produktu leczniczego NAFTIN® Gel zostały ustalone w grupie wiekowej od 12 do 18 lat z grzybicą międzypalcową stóp.
Stosowanie NAFTIN® Gel w tej grupie wiekowej jest poparte dowodami z odpowiednich i dobrze kontrolowanych badań u dorosłych z dodatkowymi danymi dotyczącymi bezpieczeństwa i PK z badania otwartego, przeprowadzonego na 22 nastolatkach w wieku ≥12 lat, którzy byli narażeni na NAFTIN® Gel w dawce około 4 g/dobę .
Bezpieczeństwo i skuteczność u pacjentów pediatrycznych w wieku <12 lat nie zostały ustalone.
Stosowanie w pediatrii
Podczas badań klinicznych 99 uczestników (9%) w wieku 65 lat i starszych było narażonych na działanie produktu NAFTIN® Żel. Bezpieczeństwo i skuteczność były podobne do tych zgłaszanych przez młodsze osoby.
Naftin Gel Opis
NAFTIN ® Gel jest przezroczystym do żółtego żelem do stosowania wyłącznie miejscowego. Każdy gram NAFTIN ® Żelu zawiera 20 mg chlorowodorku naftifiny, syntetycznego allilaminowego związku przeciwgrzybiczego.
Chemicznie, chlorowodorek naftifiny jest (E)-N-Cinnamylo-N-metylo-1-napthalenemethylamine hydrochloride.
Wzór cząsteczkowy to C 21H 21N∙HCl o masie cząsteczkowej 323,86.
Wzór strukturalny chlorowodorku naftifiny to :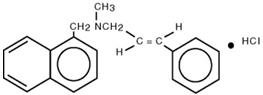
NAFTIN ®Żel zawiera następujące składniki nieaktywne: alkohol, alkohol benzylowy, disodu edetynian, hydroksyetyloceluloza, woda oczyszczona, glikol propylenowy, polisorbat 20 i trolamina.
Naftin Żel – Farmakologia kliniczna
Mechanizm działania
NAFTIN ® Żel jest lekiem przeciwgrzybiczym stosowanym miejscowo .
Farmakodynamika
Farmakodynamika leku NAFTIN ® Gel nie została ustalona .
Farmakokinetyka
Badania biodostępności in vitro i in vivo wykazały, że naftifina przenika do warstwy rogowej naskórka w stężeniu wystarczającym do zahamowania wzrostu dermatofitów.
Analiza farmakokinetyczna próbek osocza pobranych od 32 osób z grzybicą stóp leczonych średnią dawką 3,9 grama NAFTIN ® Gel stosowaną raz na dobę na obie stopy przez 14 dni wykazała zwiększoną ekspozycję w okresie leczenia, ze średnią geometryczną (CV%) AUC 0-24 (pole powierzchni pod krzywą stężenia w osoczu w funkcji czasu od czasu 0 do 24 godzin) wynoszącą 10,5 (118) ng∙hr/mL w dniu 1 i AUC 0-24 wynoszącą 70 (59) ng∙hr/mL w dniu 14. Współczynnik kumulacji na podstawie AUC wynosił około 6.
Stężenie maksymalne (C max) również zwiększało się w okresie leczenia; średnia geometryczna (CV%) C max po podaniu pojedynczej dawki wynosiła 0,9 (92) ng/ml w dniu 1; C max w dniu 14 wynosiła 3,7 (64) ng/ml. Mediana T max wynosiła 20,0 godzin (zakres: 8, 20 godzin) po podaniu pojedynczej dawki w dniu 1. i 8,0 godzin (zakres: 0, 24 godziny) w dniu 14. Niewielkie stężenia w osoczu zwiększały się podczas okresu badania i osiągnęły stan stacjonarny po 11 dniach. W tym samym badaniu farmakokinetycznym frakcja dawki wydalana z moczem w okresie leczenia była mniejsza lub równa 0,01% zastosowanej dawki.
W drugim badaniu oceniano farmakokinetykę produktu NAFTIN® Gel u 22 pacjentów pediatrycznych w wieku 12-17 lat z grzybicą stóp. Pacjenci byli leczeni średnią dawką 4,1 grama NAFTIN®Żelu nakładaną na zmienione chorobowo miejsca raz dziennie przez 14 dni. Wyniki wykazały, że ekspozycja ogólnoustrojowa zwiększała się w okresie leczenia. Średnia geometryczna (CV%) AUC0-24 wynosiła 15,9 (212) ng∙hr/mL w dniu 1. i 60,0 (131) ng∙hr/mL w dniu 14. Średnia geometryczna (CV%) Cmax po podaniu pojedynczej dawki wynosiła 1,40 (154) ng/mL w dniu 1. i 3,81 (154) ng/mL w dniu 14. Frakcja dawki wydalana z moczem w okresie leczenia była mniejsza lub równa 0,003% zastosowanej dawki.
Mikrobiologia
Mechanizm działania
Naftifina jest lekiem przeciwgrzybiczym należącym do klasy alliloamin. Chociaż dokładny mechanizm działania przeciw grzybom nie jest znany, chlorowodorek naftifiny wydaje się zaburzać biosyntezę steroli poprzez hamowanie enzymu 2, 3-epoksydazy skwalenu. Zahamowanie aktywności enzymu przez tę alliloaminę powoduje zmniejszenie ilości steroli, zwłaszcza ergosterolu, i odpowiednie nagromadzenie skwalenu w komórkach.
Mechanizm oporności
Do chwili obecnej nie zidentyfikowano mechanizmu oporności na naftifinę.
Naftifina wykazuje aktywność wobec większości izolatów następujących grzybów, zarówno w warunkach in vitro, jak i w zakażeniach klinicznych, zgodnie z opisem w punkcie WSKAZANIA I STOSOWANIE:
- Trichophyton rubrum
- Trichophyton mentagrophytes
- Epidermophyton floccosum
Toksykologia niekliniczna
Carcinogenesis, Mutagenesis, Impairment of Fertility
W 2-letnim badaniu rakotwórczości skórnej chlorowodorek naftifiny w kremie podawano szczurom Sprague-Dawley w dawkach 1%, 2% i 3% (10, 20, i 30 mg/kg/dobę chlorowodorku naftifiny). W badaniu tym nie stwierdzono żadnych nowotworów związanych z lekiem aż do największej dawki ocenianej w tym badaniu wynoszącej 30 mg/kg/dobę (36-krotność MRHD w oparciu o porównanie AUC).
Chlorowodorek naftyfiny nie wykazał żadnych dowodów potencjału mutagennego lub klastogennego w oparciu o wyniki dwóch testów genotoksyczności in vitro (test Amesa i test aberracji chromosomowej komórek jajnika chomika chińskiego) oraz jednego testu genotoksyczności in vivo (test mikrojądrowy szpiku kostnego myszy).
Ortalne podawanie chlorowodorku naftifiny szczurom, w okresie krycia, ciąży, porodu i laktacji, nie wykazało wpływu na wzrost, płodność lub reprodukcję, w dawkach do 100 mg/kg/dobę (12-krotność MRHD w oparciu o porównanie mg/m 2).
Badania kliniczne
NAFTIN ®ŻEL został oceniony pod względem skuteczności w dwóch randomizowanych, podwójnie ślepych, kontrolowanych nośnikiem, wieloośrodkowych badaniach, które objęły 1175 uczestników z objawową i dermatofito-pozytywną grzybicą międzypalcową. Badani byli randomizowani do otrzymywania NAFTIN ® ŻEL lub nośnika. Pacjenci stosowali 2% żel chlorowodorku naftifiny lub nośnik na zmienione chorobowo miejsce na stopie raz dziennie przez 2 tygodnie. Oceniano oznaki i objawy grzybicy międzypalcowej (obecność lub brak rumienia, świądu i łuszczenia), a po 6 tygodniach od pierwszego leczenia przeprowadzono badanie z użyciem wodorotlenku potasu (KOH) i wykonano hodowlę dermatofitów.
Średni wiek badanej populacji wynosił 45 lat; 77% stanowili mężczyźni; 60% było rasy kaukaskiej, 35% było rasy czarnej lub afroamerykańskiej, a 26% było rasy latynoskiej lub latynoskiej. Na początku badania u uczestników potwierdzono występowanie oznak i objawów grzybicy międzypalcowej, dodatni wynik badania KOH i potwierdzoną hodowlę dermatofitów. Pierwszorzędowym punktem końcowym skuteczności był odsetek uczestników z całkowitym wyleczeniem w 6 tygodniu po rozpoczęciu leczenia (4 tygodnie po ostatnim leczeniu). Całkowite wyleczenie zostało zdefiniowane jako zarówno wyleczenie kliniczne (brak rumienia, świądu i łuszczenia), jak i wyleczenie mikologiczne (ujemny wynik badania KOH i hodowli dermatofitów).
Wyniki skuteczności w tygodniu 6, cztery tygodnie po zakończeniu leczenia, przedstawiono w tabeli 1 poniżej.
| Trial 1 | Trial 2 | |||
|---|---|---|---|---|
| Endpoint | NAFTIN ® Gel, 2% N=382 n (%) |
Wynik N=179 n (%) |
NAFTIN ®Żel, 2% N=400 n (%) |
Wkład N=213 n (%) |
| * Całkowite wyleczenie jest złożonym punktem końcowym zarówno wyleczenia mikologicznego jak i klinicznego. Wyleczenie kliniczne definiuje się jako brak rumienia, świądu i łuszczenia się skóry (stopień 0). Skuteczne leczenie oznacza negatywny wynik preparatu KOH i negatywny wynik hodowli dermatofitów, rumień, łuszczenie się skóry i świąd w stopniu 0 lub 1 (nieobecne lub prawie nieobecne). Wyleczenie mikologiczne jest definiowane jako ujemny wynik testu KOH i hodowli dermatofitów. | ||||
| Kompletne wyleczenie * | 64 (17%) | 3 (2%) | 104 (26%) | 7 (3%) |
| Skuteczność leczenia † | 207 (54%) | 11 (6%) | 203 (51%) | 15 (7%) |
| Wyleczenie mikologiczne Leczenie ‡ | 250 (65%) | 25 (14%) | 235 (59%) | 22 (10%) |
Jak dostarczać/składować and Handling
How Supplied
NAFTIN ® Gel jest bezbarwnym do żółtego żelem dostarczanym w składanych tubach w następujących rozmiarach:
45g – NDC 54766-772-45
60g – NDC 54766-772-60
Przechowywanie
Przechowywać NAFTIN ® Gel w temperaturze 25°C (77°F); dopuszczalne są wypady do 15-30°C (59-86°F) .
Informacje dla pacjenta
- Poinformuj pacjenta, że NAFTIN ® Żel jest przeznaczony wyłącznie do stosowania miejscowego. NAFTIN ® Żel nie jest przeznaczony do stosowania okulistycznego, doustnego lub dopochwowego.
- Pacjentów należy poinformować, aby skontaktowali się z lekarzem, jeśli podczas stosowania NAFTIN ® Żelu wystąpi podrażnienie.
Dystrybuowane przez Sebela Pharmaceuticals Inc.
645 Hembree Parkway, Suite I, Roswell, GA 30076
www.sebelapharma.com
Toll Free 1-844-732-3521
©2020 Sebela Pharmaceuticals Inc. All rights reserved.
PRINCIPAL DISPLAY PANEL – 45g Tube Carton

NDC 54766-772-45
NAFTIN ®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Do stosowania wyłącznie miejscowego
Nie stosować doustnie, Oral or Intravaginal Use
45g
Rx Only
PRINCIPAL DISPLAY PANEL – 60 g Tube Carton

NDC 54766-772-60
NAFTIN®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Do stosowania wyłącznie miejscowego
Nie stosować doustnie, Oral or Intravaginal Use
60g
Rx Only
| NAFTIN naftifine hydrochloride gel |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Labeler -. Sebela Pharmaceuticals Inc. (079104574)
| Przedsiębiorstwo | |||
| Nazwa | Adres | ID/FEI | Operacje |
| DPT Laboratories, Ltd. | 832224526 | produkcja(54766-772), analiza(54766-772), etykieta(54766-772) | |
Więcej o Naftin (naftifine topical)
- Skutki uboczne
- W czasie ciąży lub karmienia piersią
- Dawkowanie Informacje
- Cena &Kupony
- En Español
- 3 Recenzje
- Dostępność generyczna
- Klasa leków: leki przeciwgrzybicze stosowane miejscowo
Zasoby dla konsumentów
- Informacje dla pacjentów
- Naftin Topical (Advanced Reading)
.
Zasoby dla profesjonalistów
- Informacje dla pacjentów
- Naftifine (AHFS Monograph)
Inne preparaty
- Naftin-MP Topical
Poradniki dotyczące leczenia
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Zrzeczenie się odpowiedzialności medycznej
.