Jon azydkowy: Structure, Properties, and Substitution Reactions
Jon azydkowy (N3- ) jest jedną z tych jednostek chemicznych, które po prostu wyglądają dziwnie.

- Trzy nitrogeny w rzędzie? sprawdzone
- Dwa ładunki ujemne i jeden dodatni, dla ładunku netto -1? sprawdzone
- Stabilny? sprawdzone (tak długo jak jest traktowany delikatnie).
Jak się okazuje, jon azydkowy może być niezwykle przydatny do tworzenia wiązań C-N w reakcjach substytucji nukleofilowej.
Table of Contents
- The Azide Ion Is A Great Nucleophile
- Organic Azides As „Masked” Amines
- Exploding On The Launchpad
- Nucleophilic Acyl Substitution With Azide Salts: Acyl Azides
- Rearanżacja azydków acylowych: The Curtius Rearrangement
- Więcej przykładów nukleofili azydkowych: Epoxide Opening And Conjugate Addition
- Notes
- (Advanced) References and Further Reading
- 1. The Azide Ion Is A Great Nucleophile In SN2 Reactions
- 2. Azydki organiczne jako „zamaskowane aminy”
- Exploding On The Launchpad
- 4. Nukleofilowa substytucja acylowa z solami azydkowymi tworzy azydki acylowe
- 5. Rearrangement of Acyl Azides: The Curtius Rearrangement
- Więcej przykładów nukleofili azydkowych: Epoxide Opening And Conjugate Addition
- Uwagi
- (Advanced) References and Further Reading
1. The Azide Ion Is A Great Nucleophile In SN2 Reactions
Jon azydkowy jest zasadą sprzężoną kwasu hydrazolowego, HN3. Mimo że jest tylko słabo zasadowy (pKa HN3 wynosi tylko 4,6), N3 jest wyjątkowo dobrym nukleofilem – według jednej z miar, bardziej nukleofilowym niż jakakolwiek amina (patrz post: Nukleofilowość amin). Nie jest trudno zrozumieć, dlaczego tak się dzieje, gdy się nad tym zastanowić. Z czterema nukleofilowymi samotnymi parami zamkniętymi w bardzo małej objętości, prawdopodobieństwo zderzenia z elektroforem, które skutkuje reakcją jest znacznie wyższe niż w przypadku amin z nieporęcznymi grupami alkilowymi, aby wziąć tylko jeden przykład.
Można myśleć o N3- jak o chudym, średnim, azotowym pocisku, który dostarcza swój ładunek na węgiel szybko, skutecznie i bez znaczących reakcji ubocznych.
W reakcjach SN2, pierwszo- i drugorzędowe halogenki alkilowe i sulfoniany są łatwo wypierane przez N3- , w wyniku czego powstają azydki alkilowe:
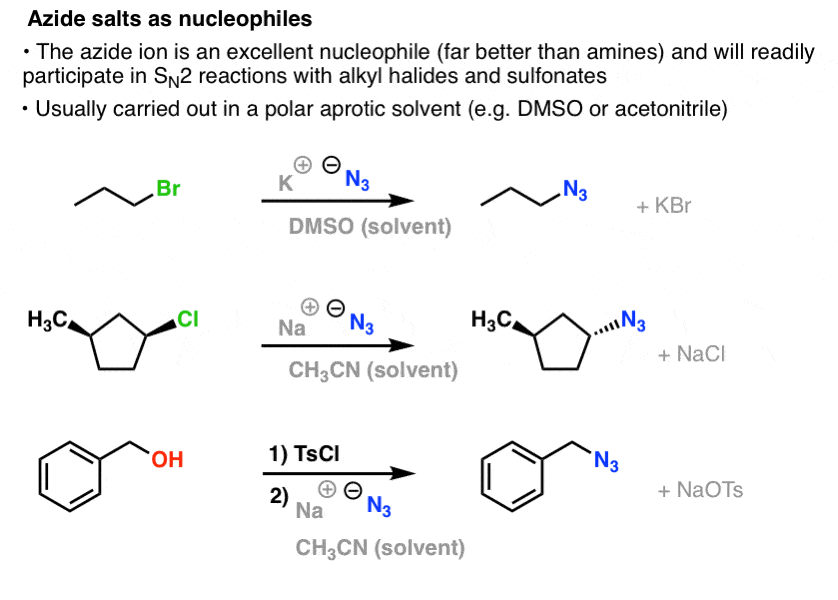
Zwykła procedura polega na użyciu soli azydkowej, takiej jak NaN3 lub KN3 z odpowiednim halogenkiem alkilowym w polarnym rozpuszczalniku aprotycznym, takim jak acetonitryl (CH3CN) lub dimetylosulfotlenek (DMSO).
Organiczne produkty azydkowe są dość stabilne, nawet jeśli wyglądają trochę dziwnie. Niektóre z nich znalazły nawet zastosowanie jako farmaceutyki (np. AZT, poniżej po prawej) lub jako użyteczne sondy do badania biologii chemicznej. .
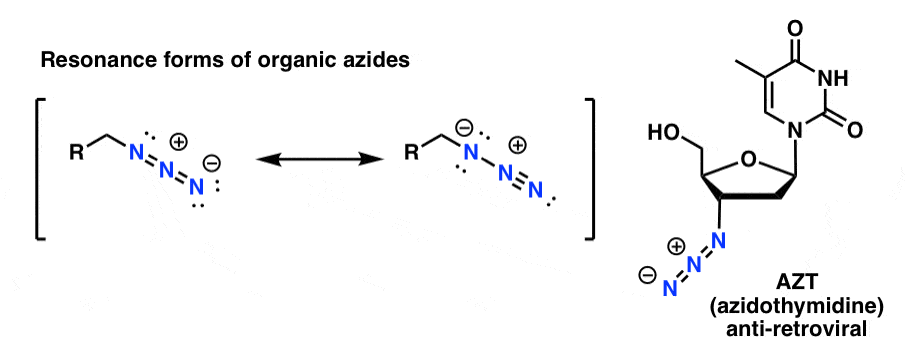
Dla naszych celów najbardziej użyteczną właściwością azydków organicznych jest to, że służą one jako „zamaskowane” aminy.
2. Azydki organiczne jako „zamaskowane aminy”
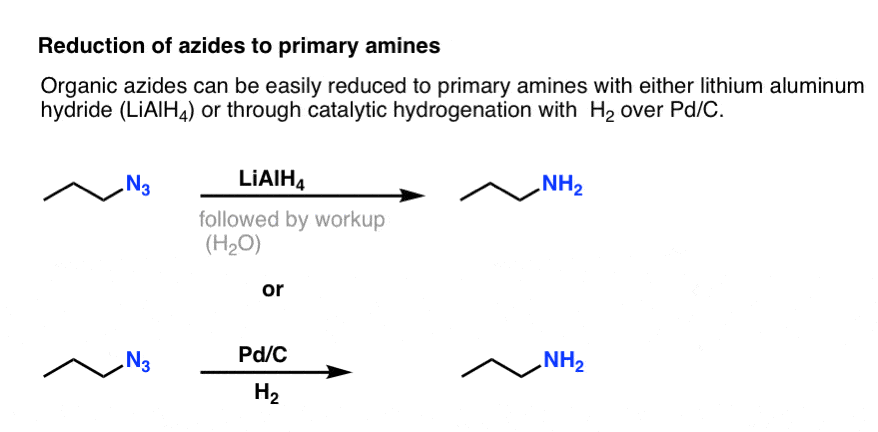
Zauważ powyższą formę rezonansową z potrójnym wiązaniem azot-nitrogen. Jeśli poddane działaniu środka redukującego, takiego jak LiAlH4 lub nawet katalitycznego uwodornienia (Pd/C , H2), azydki organiczne mogą być zredukowane do amin pierwszorzędowych, uwalniając N2 w procesie.
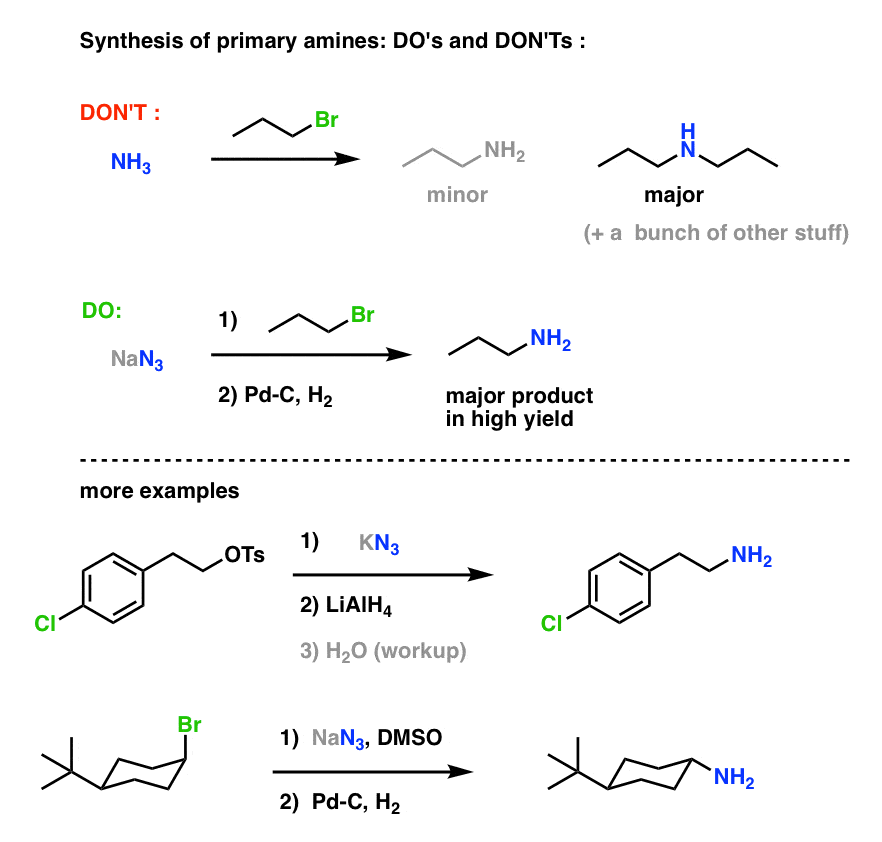
To sprawia, że bardzo użyteczna droga do amin pierwszorzędowych z halogenków alkilowych!
Wcześniej badaliśmy syntezę Gabriela jako drogę do pierwszorzędowych amin, ale ta droga jest lepsza, ponieważ azydek może być zredukowany do aminy w łagodnych warunkach (np. uwodornienie). Nie trzeba się martwić o żadne wysokotemperaturowe rozszczepianie ftalimidu hydrazyną.
Widzieliśmy również, że wytwarzanie amin pierwszorzędowych poprzez bezpośrednie traktowanie halogenków alkilowych za pomocą NH3 często nie skutkuje otrzymaniem pożądanego produktu, ponieważ aminy mają podobną do Cookie-Monster tendencję do wielokrotnego reagowania z halogenkami alkilowymi: ponieważ produkty aminowe mają tendencję do bycia bardziej nukleofilowymi niż reagenty, trudno jest skłonić aminy do poprzestania na schrupaniu tylko jednego halogenku alkilowego.
Exploding On The Launchpad
Jeśli N3 jest „pociskiem zakończonym azotem”, jak skomentowaliśmy powyżej, warto przypomnieć, co się dzieje, gdy pocisk nie jest obsługiwany ostrożnie: jest to w zasadzie bomba.
NaN3 i KN3 są białymi proszkami, które mogą być przechowywane w nieskończoność w temperaturze pokojowej i nabierane na ławkę bez żadnych problemów.
Ale kiedy są podgrzewane lub poddawane wstrząsom – wszystkie zakłady są wyłączone. To samo dotyczy wystawienia tych soli azydkowych na działanie kwasu, który tworzy potencjalnie wybuchowy HN3.
A NaN3 i KN3 to miłe azydki! Jeśli zmiesza się je z solami metali: ołowiu, rtęci, kadmu, cynku lub srebra, mogą powstać jeszcze bardziej wybuchowe związki azydkowe. Te azydki metali są kontaktowymi materiałami wybuchowymi, niektóre z nich są tak wrażliwe, że zdetonują się, jeśli ktoś pierdnie dwadzieścia stóp w korytarzu. Niektórzy szaleni chemicy nawet robią te rzeczy celowo, ale nie będziemy podróżować nigdzie w pobliżu promienia wybuchu tego tematu na tym blogu kiedykolwiek, kiedykolwiek.
NaN3 i KN3 powinny być używane w rozsądnie rozcieńczonych stężeniach, za osłoną przeciwwybuchową w skali preparatywnej, i nawiasem mówiąc nigdy nie powinny być używane z rozpuszczalnikiem CH2Cl2, co może skutkować wysoce wybuchowym diazydometanem.
Teraz, są chwile, kiedy nagły wybuch azotu jest użyteczny – i potencjalnie ratujący życie. Być może spędziłeś już część swojego dnia w pobliżu azydku sodu, nawet nie zdając sobie z tego sprawy. To dlatego, że NaN3 jest jednym z kilku materiałów pędnych, które znajdują zastosowanie w poduszkach powietrznych; po wyzwoleniu przez akcelerometr, detonacja NaN3 wyrzuca gaz N2 z prędkością ponad 200 mil na godzinę, nadmuchując poduszkę w ciągu 1/25 sekundy.
Yay for azide salts!
via GIPHY
(But don’t be this guy):
via GIPHY
Bottom line: Reakcje SN2 pomiędzy halogenkami alkilowymi lub sulfonianami z azydkami są prawdopodobnie najlepszym sposobem syntezy amin pierwszorzędowych z halogenków alkilowych. To na pewno bije Gabriel syntezy.
4. Nukleofilowa substytucja acylowa z solami azydkowymi tworzy azydki acylowe
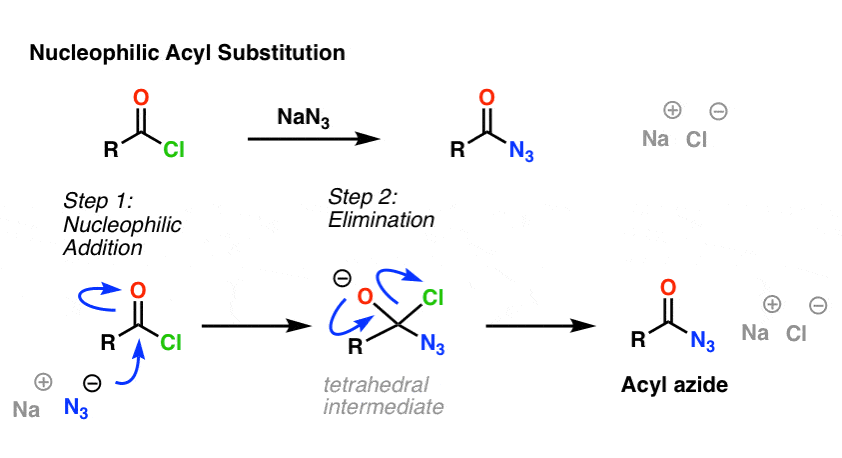
Reakcja SN2 nie jest jedynym typem reakcji substytucji, który zbadaliśmy. Istnieje również nukleofilowa substytucja acylowa. Karbonyl przyłączony do dobrej grupy opuszczającej (takiej jak chlorek lub bezwodnik kwasu) ulega substytucji po dodaniu odpowiedniego nukleofila.
W pierwszym etapie mechanizmu nukleofil (Nu) atakuje węgiel karbonylowy, tworząc C-Nu i rozrywając C-O (pi). Powoduje to powstanie tetraedrycznego intermediatu. W drugim etapie wiązanie C-O pi jest ponownie tworzone, a wiązanie węgiel-(grupa opuszczająca) jest zrywane, w wyniku czego powstaje produkt nukleofilowego podstawienia acylowego.
Przedstawiamy przykład reakcji nukleofilowego podstawienia acylowego pomiędzy chlorkiem kwasu a jonem N3, w wyniku której powstaje azydek acylowy:
5. Rearrangement of Acyl Azides: The Curtius Rearrangement
Najczęstszym zastosowaniem azydków acylowych jest to, że po podgrzaniu ulegają one przegrupowaniu dając izocyjaniany w reakcji znanej jako przegrupowanie Curtiusa.
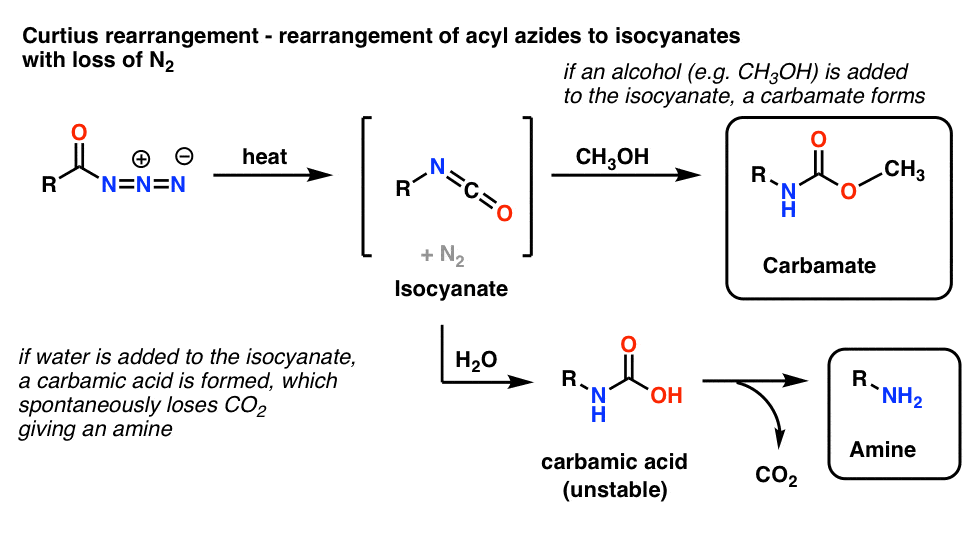
- Jeśli Curtius jest przeprowadzany w obecności alkoholu, takiego jak metanol, tworzy się karbaminian.
- Jeśli zamiast tego doda się wodę, na krótko powstaje niestabilny kwas karbaminowy, który następnie traci dwutlenek węgla, dając aminę pierwszorzędową.
Dlaczego może to być przydatne? Oto jeden ze sposobów.
Jest wiele metod wytwarzania aromatycznych kwasów karboksylowych, ale nie tak wiele wspaniałych sposobów tworzenia wiązań C-N na pierścieniach aromatycznych. Powiedzmy, że masz kwas benzoesowy (taki jak kwas p-metylobenzoesowy), ale musisz utworzyć (chronioną) aminę aromatyczną. Protokół Curtiusa stanowi dobry sposób na utworzenie nowego wiązania C-N na pierścieniu bez konieczności uciekania się do nitrowania + redukcji.
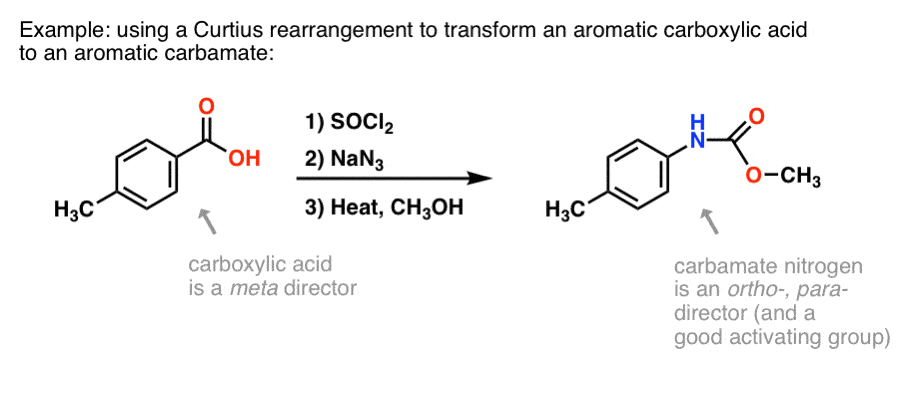
(W ten sposób jest to w pewnym sensie analogiczne do azotowego odpowiednika utleniania Baeyera-Villigera. )
Więcej przykładów nukleofili azydkowych: Epoxide Opening And Conjugate Addition
Dwa kolejne zastosowania jonu azydkowego jako nukleofila obejmują otwieranie epoksydów (w tym, co jest zasadniczo procesem SN2 – zwróć uwagę na odwrócenie konfiguracji), a także addycję sprzężoną alfa,beta nienasyconych ketonów:
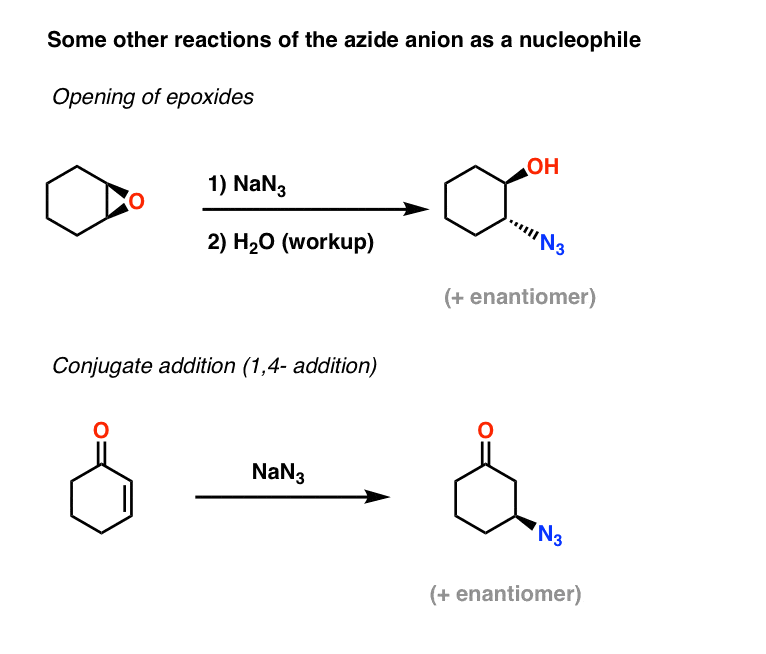
Wynikające z tego azydki alkilowe można następnie zredukować do amin pierwszorzędowych za pomocą metod opisanych powyżej.
Uwagi
Footnote: Azide-Alkyne Cycloadditions, a.k.a. „Click” chemistry
Ciekawym i użytecznym zastosowaniem azydków organicznych, które jeszcze nie trafiło do podręczników wprowadzających do chemii organicznej (ale prawdopodobnie trafi w niedalekiej przyszłości) jest proces technicznie nazywany „katalizowaną miedzią cykloaddycją azydkowo-alkynową”, ale częściej nazywany po prostu „reakcją kliknięcia alkinu z azydkiem”.
Gdy terminalny alkin jest traktowany katalizatorem miedziowym w obecności organicznego azydku, szybko dochodzi do cykloaddycji, prowadzącej do powstania 1,2,3-triazolu.
Nie będziemy zagłębiać się w szczegóły, ale ta reakcja tworzenia pierścienia obejmuje 6 elektronów pi i jest kuzynem reakcji Dielsa-Aldera (nitpckerzy słusznie zauważą, że wersja katalizowana miedzią nie jest technicznie procesem uzgodnionym, ale wersja niekatalizowana jest)
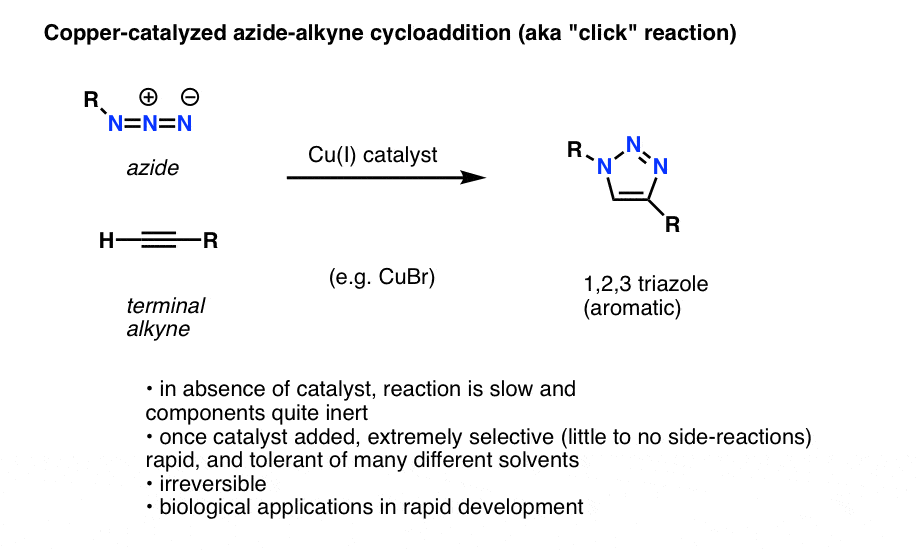
Reakcja ta jest godna uwagi z kilku powodów:
- reaktywni partnerzy (terminalny alkin i organiczny azydek) są stosunkowo obojętni przy braku katalizatora w większości warunków.
- po dodaniu miedzi reakcja zachodzi niezwykle szybko w łagodnych warunkach i w różnych rozpuszczalnikach (w tym w wodzie).
- jest ona niezwykle selektywna w tych warunkach, partnerzy alkinowy i azydkowy reagują tylko ze sobą, nieodwracalnie.
- produkt, pierścień triazolowy, jest aromatyczny i stabilny
Reakcja ta została nazwana reakcją „kliknięcia” przez jednego z jej pomysłodawców, Barry’ego Sharplessa, ponieważ jest to jedna z najbliższych rzeczy, jakie chemicy mają do reakcji, która jest jak płynne „kliknięcie” dwóch uzupełniających się klocków lego.
To, co uczyniło tę reakcję szczególnie użyteczną, to fakt, że partnerzy azydkowi i alkinowi mogą być instalowani w cząsteczkach o znaczeniu biologicznym i „klikani” razem, gdy jest to pożądane.
Na przykład:
- Umieszczenie acetylenu w pozycji 5′ cukru i azydku w pozycji 3′ zostało wykorzystane do wykonania „klikniętego” DNA, gdzie triazol zastępuje organofosforan.
- Niesamowite, jedna z grup stworzyła „kliknięte” DNA, umieściła je w ludzkich komórkach i udało jej się uzyskać transkrypcję przez messenger RNA.
- Azid zawierający AZT (powyżej) działa poprzez zagłuszanie maszynerii transkrypcyjnej. Niektórzy sprytni ludzie znaleźli sposób na zastosowanie reakcji kliknięcia azydkowo-alkilowego do szybkiego sekwencjonowania genomu, techniki znanej jako ClickSeq.
Takata używała azydku sodu we wczesnych latach 90-tych, a następnie przeniosła się do tetrazolu, a potem azotanu amonu.
Z „Sixty Million Car Bombs: Inside Takata’s Air Bag Crisis”.
Bazotan amonu był o jedną dziesiątą ceny tetrazolu, według Uphama, który również przejrzał patenty przemysłowe. Ale azotan amonu miał krytyczną wadę, która jego zdaniem doprowadziła innych producentów poduszek powietrznych do rezygnacji z niego: Azotan amonu ma pięć faz o różnej gęstości, które sprawiają, że trudno jest utrzymać jego stabilność w czasie. Materiał pędny wykonany z azotanu amonu pęczniał i kurczył się pod wpływem zmian temperatury, a w końcu tabletka rozpadała się na proszek. Woda i wilgoć przyspieszyłyby ten proces. Proszek spala się szybciej niż tabletka, więc poduszka powietrzna, której materiał pędny się rozpadł, prawdopodobnie zadziałałaby zbyt agresywnie. Kontrolowana eksplozja byłaby tylko eksplozją. „Wszyscy poszli pewną drogą, a tylko Takata poszła inną” – mówi Jochen Siebert, który śledzi branżę poduszek powietrznych od lat 90-tych, a obecnie jest dyrektorem zarządzającym w JSC Automotive Consulting. „Jeśli przeczytasz materiały konferencyjne z tamtych czasów, możesz zobaczyć, że ludzie mówili: 'Nie, nie powinniście. To jest niebezpieczne. „
Odłamki z wadliwych poduszek powietrznych zabiły 13 osób na całym świecie i zraniły ponad 100.
W dniu 25 czerwca 2017 r., w obliczu zobowiązań w wysokości ponad 11 miliardów dolarów, Takata złożyła wniosek o upadłość.
Primary amine synthesis „Do’s and Don’ts” :
(Advanced) References and Further Reading
Azydki są przydatne w syntezie organicznej, a podkreślenie chemii azydków znajduje się w poniższych odniesieniach.
- Reaktywność nukleofilowa jonu azydkowego w różnych rozpuszczalnikach
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI: 10.1002/poc.1063
Prof. Herbert Mayr (LMU, Monachium, Niemcy) poświęcił swoją karierę na wkład w podstawową fizyczną chemię organiczną poprzez ilościowe określenie elektrofilowości i nukleofilowości oraz opracowanie skal do porównywania reaktywności różnych nukleofili i elektrofilów. - The SN2 displacements at 2-norbornyl brosylates
Klaus Banert and Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI: 1021/ja00377a057 - An Improved Synthesis of Azidothymidine
I. Balagopala, A. P. Ollapally, & H. J. Lee
Nukleozydy, Nukleotydy & Nucleic Acids 1996, 4, 899-906
DOI: 10.1080/07328319608002136
Azydki mogą być stosowane jako nukleofile w reakcjach SN2. Ref. #3 pokazuje zastosowanie jonu azydkowego w syntezie AZT (azydotymidyny). Konwersja 1 do 5 poprzez 3 w ref. #3 wykorzystuje reakcję Mitsunobu, która umożliwia wypieranie grupy -OH przez nukleofil z odwróceniem konfiguracji. - Reduction of Organic Azides to Primary Amines with Lithium Aluminum Hydride
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
Redukcja azydków organicznych do amin pierwszorzędowych jest dogodną metodą syntezy amin pierwszorzędowych, które w przeciwnym razie są trudne do selektywnej syntezy standardowymi metodami. - Wrażliwość wybuchowa azydków metali na uderzenia
P. G. Fox
J. Solid State Chem. 1970, 2 (4), 491-502
DOI: 10.1016/0022-4596(70)90043-5
Badanie wrażliwości NaN3, TlN3 i Pb(N3)2 na wstrząsy. - Reakcja Curtiusa
Smith, P. A. S. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Stary, ale wyczerpujący przegląd reakcji Curtiusa, który obejmuje historię odkrycia tej rearanżacji, zakres substratów, ograniczenia, porównanie z innymi podobnymi reakcjami oraz procedury eksperymentalne. - Metody i reakcje syntetyczne. 121. Katalizowane jodkiem cynku otrzymywanie azydków aroilowych z chlorków aroilowych i azydku trimethylsilylowego
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, and George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051b
Wygodna procedura otrzymywania aromatycznych arylozydów od laureata Nagrody Nobla prof. Można je następnie wykorzystać do rearanżacji Curtiusa.
Otwieranie epoksydów i addycja koniugatowa:
- CYCLOHEXENE IMINE (7-AZA-BICYCLOHEPTANE)
Iain D. G. Watson, Nicholas Afagh and Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI: 10.15227/orgsyn.087.0161
Jest to szczególnie przydatna procedura, ponieważ jest to reakcja Staudingera służąca do przekształcania epoksydów w NH-azirydyny (azotowy analog epoksydów). Synteza może być podchwytliwa, ale podano tu wiele szczegółów, aby można było to odtworzyć, jako dopasowanie procedury w Organic Syntheses. - Amine-Catalyzed Addition of Azide Ion to α,β-Unsaturated Carbonyl Compounds
David J. Guerin, Thomas E. Horstmann, and Scott J. Miller
Organic Letters 1999, 1 (7), 1107-1109
DOI: 10.1021/ol9909076
Praca ta jest o tyle interesująca, że reprezentuje wczesną formę organokatalizy i prawdopodobnie przebiega poprzez pośredni jon iminowy lub iminowy. Niestety termin ten nie jest użyty nigdzie w pracy – autorzy mogliby pobić Prof. MacMillana o głowę! - Click Chemistry: Diverse Chemical Function from a Few Good Reactions
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI: 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
Katalizowana przez Cu cykloaddycja azydków z alkinami została nazwana reakcją „click” przez laureata Nagrody Nobla prof. K. Barry’ego Sharplessa (The Scripps Research Institute, La Jolla, CA) ze względu na jej prostotę, wysoką wydajność, szybką kinetykę oraz kompatybilność z szerokim zakresem warunków i substratów. Reakcje bez Cu są również możliwe, jeśli używane są naprężone alkiny (np. cyklooktyny).