Zlokalizowany vs. delokalizowany
Różnica pomiędzy „zlokalizowanym” i „delokalizowanym” istnieje tylko wtedy, gdy opisujemy ruch elektronów używając teorii wiązania Lewisa.
Zgodnie z tą teorią, zlokalizowane elektrony wykazują normalne zachowanie. Zlokalizowana para samotna pozostaje w pobliżu jednego atomu. Zlokalizowana para wiązań przemieszcza się pomiędzy dwoma atomami.
Resonansowe hybrydy z konieczności zawierają pewne „nienormalne” elektrony. Samotna para może wydawać się mieć pewne cechy wiązania; zamiast trzymać się blisko jednego atomu, odwiedza dwa atomy. Para wiązań może wydawać się poruszać pomiędzy dwoma różnymi parami atomów. Te elektrony wykraczają poza granice wyznaczone przez teorię Lewisa i uważamy je za zdelokalizowane.
Najprostszym sposobem na wykrycie zdelokalizowanych elektronów jest porównanie lokalizacji elektronów w dwóch formach rezonansowych. Jeśli para pojawia się w jednym miejscu w jednej formie, a w innym miejscu w innej formie, para jest zdelokalizowana.
Można zobaczyć zdelokalizowane zachowanie w formach rezonansowych I i II poniżej. Obie formy zawierają dwie zdelokalizowane pary elektronowe. Czy potrafisz je znaleźć? Jakie pary elektronowe są zdelokalizowane w każdej strukturze?
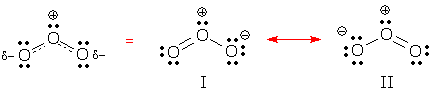
(Odpowiedź: te formy zawierają jedną zdelokalizowaną parę wiązań i jedną zdelokalizowaną parę samotną.)
Wiązania zdelokalizowane i zdelokalizowane ładunki
Oznaczenie „zdelokalizowany” stosuje się również do wiązań i ładunków.
Wiązanie zdelokalizowane to wiązanie, które pojawia się w niektórych formach rezonansowych, ale nie w innych. Forma rezonansowa I zawiera 2 wiązania zlokalizowane i 1 wiązanie zdelokalizowane.
Ładunek zdelokalizowany to ładunek formalny, który pojawia się na jednym atomie w niektórych formach rezonansowych i na innych atomach w innych formach. Ładunek ujemny Ozonu jest zdelokalizowany na dwóch końcowych O, podczas gdy ładunek dodatni jest zlokalizowany na środkowym O.
.