Skurcze powiek i twarzy mogą znacząco wpływać na jakość życia pacjenta, ale dotarcie do pierwotnej przyczyny skurczu – może to być miokymia, łagodny zasadniczy skurcz błon śluzowych powiek lub skurcz twarzy – może być wyzwaniem dla klinicysty. W tym artykule przedstawimy porady, które mogą pomóc w diagnozowaniu i leczeniu tych niekiedy trudnych stanów.
Przegląd
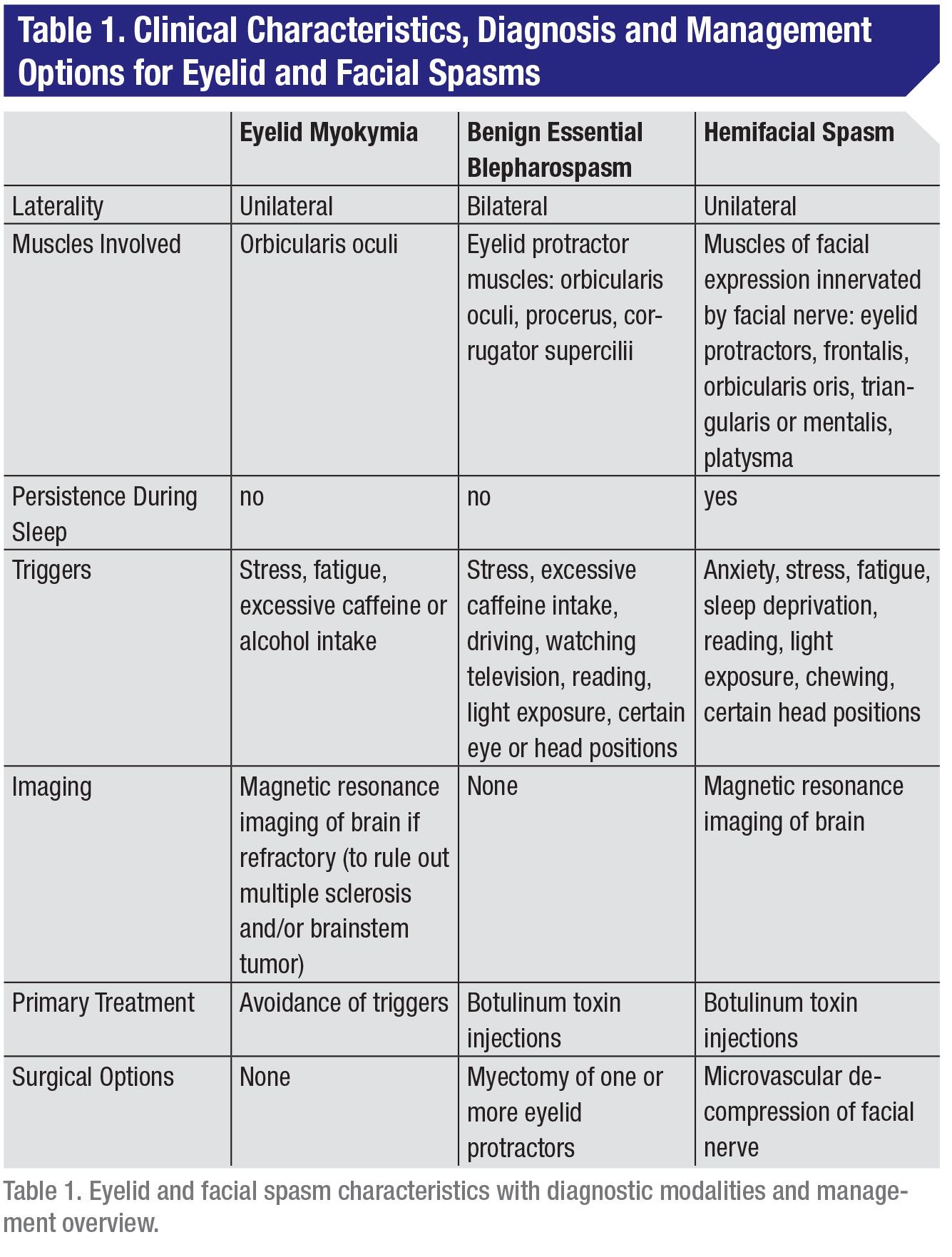
W ramach praktyki neurologicznej i okulistycznej spektrum skurczów powiek i twarzy, uszeregowanych od najmniej do najbardziej nasilonych, obejmuje miokymię powiek (mimowolne, niewielkie skurcze powiek), łagodny zasadniczy skurcz powiek (mimowolne skurcze, które powodują częściowe lub całkowite zamknięcie oka) oraz skurcz twarzy (skurcze mięśni kontrolujących mimikę twarzy) (tabela 1). Wszystkie te zaburzenia polegają na mimowolnych ruchach twarzy, które mogą być trudne do opanowania przez pacjentów w życiu codziennym.
Miokymia powiek
Najczęstszym zaburzeniem mimowolnych ruchów twarzy jest miokymia powiek. Miokymia powiek polega na mimowolnych, drobnych, ciągłych, pofałdowanych, niesynchronicznych skurczach włókien mięśniowych prążkowanych prostowników powiek. W elektrofizjologii charakteryzuje się ona spontanicznym asynchronicznym wyładowaniem przylegających jednostek motorycznych w dubletach lub tripletach z częstotliwością 30-70 herców, z odstępami 100-200 ms oddzielającymi poszczególne wyładowania.2,3 Miokymia powiek jest uważana za łagodny, samoograniczający się proces, który jest jednostronny i przerywany, z powieką dolną dotkniętą bardziej niż górną. Epizody są przemijające, trwają od kilku dni do kilku tygodni lub miesięcy, a skurcze pojawiają się z przerwami w ciągu dnia przez kilka godzin.4
Do czynników wywołujących należą stres, przemęczenie, nadmierne spożycie kofeiny lub alkoholu oraz wysiłek fizyczny.5 Eliminacja tych czynników wyzwalających jest zalecana jako część postępowania. Miokymia powiek jest najczęściej izolowana do mięśnia oczodołowego, ale może rozprzestrzeniać się na dodatkowe mięśnie jednej lub obu stron twarzy, w którym to przypadku jest określana jako miokymia twarzy.2
Miokymia twarzy jest spowodowana uszkodzeniem jądra nerwu twarzowego w pons z powodu chorób demielinizacyjnych, takich jak stwardnienie rozsiane lub ucisku z powodu guzów pnia mózgu. Rzadko opisywano uporczywą miokymię powiek jako objaw stwardnienia rozsianego lub guza pnia mózgu.3 Jeśli stan jest przewlekły, oporny na eliminację czynników wywołujących i wpływa na jakość życia pacjenta, skuteczne w leczeniu mogą być iniekcje toksyny botulinowej. Mechanizm i skuteczność wstrzyknięć toksyny botulinowej omówiono obszernie w dalszej części artykułu. Utrzymująca się miokymia powiek, oporna na powyższe metody leczenia, powinna wzbudzić podejrzenie zmiany w pniu mózgu, jak opisano powyżej, i uzasadnia analizę za pomocą rezonansu magnetycznego.
Benign Essential Blepharospasm
BEB został po raz pierwszy opisany w 1857 roku jako zaburzenie polegające na mimowolnych skurczach mięśni odwodzicieli powiek, które powodują częściowe lub całkowite zamknięcie powiek. Częstość występowania BEB wynosi od 1,4 do 13,3 przypadków na 100 000, trzykrotnie częściej dotyka kobiet niż mężczyzn i najczęściej występuje w piątej lub siódmej dekadzie życia.7,8 BEB jest najczęściej zaburzeniem sporadycznym, ale u 27% pacjentów stwierdzono występowanie dystonii u członków rodziny, co sugeruje możliwy komponent genetyczny.1
Patofizjologia BEB nie jest dobrze poznana. Badania z zastosowaniem pozytonowej tomografii emisyjnej i funkcjonalnego rezonansu magnetycznego wykazały aktywację regionów mózgu zaangażowanych w kontrolę i regulację mięśni odpowiedzialnych za mruganie, w tym wzgórza, striatum, przedniej kory wzrokowej, pierwotnej kory ruchowej i górnej części móżdżku.7,9W badaniach na zwierzętach wykazano, że niedobór dopaminy w istocie czarnej zmniejsza hamowanie trójdzielnego odruchu mrugania, co prowadzi do nadwrażliwości tego odruchu w odpowiedzi na światło i suchość.10 Do czynników wywołujących BEB należą: stres, nadmierne spożycie kofeiny, prowadzenie samochodu, oglądanie telewizji, czytanie, jasne światło, zanieczyszczone powietrze, wiatr, hałas oraz niektóre ruchy gałek ocznych i głowy.11,12
Kliniczna prezentacja BEB składa się z obustronnych mimowolnych skurczów jednego lub więcej mięśni odwodzących powieki, w tym mięśnia oczodołowego, mięśnia procerus i mięśnia corrugator, z objawami od łagodnie zwiększonej częstotliwości mrugania do przymusowego zamykania powiek, co może prowadzić do funkcjonalnej ślepoty.1 Objawy BEB nie utrzymują się podczas snu i jest to stan postępujący, w którym z czasem dochodzi do zajęcia kolejnych mięśni.7 U części pacjentów mogą wystąpić skurcze mięśni środkowej lub dolnej części twarzy, co określa się mianem zespołu Meige’a.1 U dodatkowej części pacjentów może rozwinąć się apraksja otwierania powiek, w której dochodzi do utraty współzahamowania między protraktorami i retraktorami powiek, co skutkuje nieparalityczną niemożnością otwarcia powiek przy braku skurczu mięśni.1
Pacjenci często skarżą się również na objaw czuciowy, jakim jest światłowstręt. Proponowane mechanizmy fotofobii obejmują sympatykotoniczne zaburzenia bólowe, w przypadku których blokady zwoju szyjnego górnego przyniosły ulgę we wcześniejszych doniesieniach.11 Dodatkowe opcje postępowania w celu opanowania fotofobii obejmują modulację fotochromatyczną za pomocą soczewek barwionych FL-41 lub twardówkowych soczewek kontaktowych z fluoresceiną w zbiorniku płynu, z których obie zwiększają natężenie światła tolerowane przez pacjentów z BEB.13
Leczeniem z wyboru w przypadku BEB jest wstrzykiwanie toksyny botulinowej do dotkniętych mięśni odwodzicieli powiek. Toksyna botulinowa hamuje uwalnianie acetylocholiny z terminala presynaptycznego złącza nerwowo-mięśniowego, blokując zdolność wstrzykniętego mięśnia do skurczu. Istnieje siedem serotypów toksyny botulinowej (od A do G). Typy A i B są zatwierdzone przez Amerykańską Agencję ds. Żywności i Leków do użytku klinicznego w Stanach Zjednoczonych. OnabotulinumtoxinA (Botox) został zatwierdzony przez FDA do leczenia BEB w 1989 roku i jest najczęściej stosowanym preparatem, choć do użytku dopuszczone są również: incobotulinumtoxinA, abobotulinumtoxinA i rimabotulinumtoxinB.14 Wstrzyknięcia są wymagane mniej więcej co trzy do czterech miesięcy.11 FDA zaleca dawkę początkową od 1,25 do 2,5 jednostki wstrzykiwanej w każde dotknięte miejsce, a dawka maksymalna wynosi 15 jednostek i trzy miejsca wstrzyknięcia na stronę.14 Jednakże badania wykazały, że chirurdzy okulistyczni mają tendencję do leczenia BEB przy użyciu średniej dawki początkowej 22,5 ±9,5 jednostek.14
Typowo, pięć do ośmiu miejsc jest wstrzykiwanych wokół każdego oka, z nie więcej niż 0,1 ml toksyny botulinowej wstrzykiwanej w każdym miejscu, aby zapobiec dyfuzji leku do sąsiednich mięśni.12 Podczas leczenia przedstarsowej części mięśnia oczodołowego w powiekach górnych klinicyści muszą uważać, aby wstrzyknięcia wykonywać przyśrodkowo i bocznie, aby uniknąć wstrzyknięcia do mięśnia levator palpebrae superioris, co może powodować ptozę. Podobnie w powiece dolnej iniekcje wykonuje się centralnie i bocznie, aby uniknąć wstrzyknięcia w mięsień skośny dolny, co mogłoby spowodować diplopię. Częstość występowania działań niepożądanych wstrzyknięć toksyny botulinowej u pacjentów z BEB wynosi około 20 procent, w tym wybroczyny w miejscu wstrzyknięcia, suchość oka, łzawienie, uczucie ciała obcego, lagoftalmoza, diplopia i ptoza.7
Inne leki, które były stosowane w leczeniu BEB obejmują leki przeciwpsychotyczne, przeciwpadaczkowe, anksjolityczne, przeciwdepresyjne, przeciwhistaminowe, uspokajające i pobudzające, chociaż nie wykazano długoterminowej skuteczności żadnego z nich.15 W szczególności agoniści dopaminy i inhibitory wychwytu dopaminy okazały się skuteczne w zmniejszaniu skurczów powiek, zważywszy na fakt, że niedobór dopaminy został uwzględniony w patogenezie BEB.11 Wykazano, że metylofenidat, który blokuje presynaptyczny wychwyt zwrotny dopaminy i noradrenaliny, zmniejsza skurcze powiek i punktację niepełnosprawności.11 U pacjentów z BEB wykazano częściową odpowiedź na agonistów kwasu gamma-aminomasłowego, takich jak benzodiazepiny, ale ich stosowanie jest ograniczone przez efekt uboczny w postaci senności.11
Gdy BEB jest oporne na leczenie farmakologiczne lub pacjent nie toleruje wstrzyknięć toksyny botulinowej, można rozważyć interwencję chirurgiczną z myektomią. Podstawowym celem tej procedury jest zmniejszenie nasilenia skurczu i wydłużenie odstępu czasu między kolejnymi wstrzyknięciami botuliny.11 W chirurgicznej myektomii wycina się jeden lub więcej mięśni prostowników. Ograniczona myektomia polega na wycięciu tylko części mięśnia okoruchowego powieki górnej, natomiast rozszerzona myektomia polega na dodatkowym usunięciu mięśnia fałdu górnego i odwodziciela.15
Do działań niepożądanych zabiegu należą zła kosmetyka i konieczność przeprowadzenia dodatkowych operacji. Odnotowano nawrót objawów po chirurgicznej myektomii w 30-50% przypadków po sześciu miesiącach.12 Alternatywna procedura polega na przecięciu nerwu twarzowego, co skutecznie odnercza kątnice powiek, ale wtórnie prowadzi do porażenia nerwu twarzowego i dlatego jest rzadko stosowana.15

Skurcz nerwu twarzowego
Na koniec, HFS jest jednostronnym mimowolnym zaburzeniem ruchów twarzy polegającym na skurczach mięśni mimicznych unerwianych przez nerw twarzowy. Szacowana częstość występowania wynosi około 10 przypadków na 100 000, na podstawie badań przeprowadzonych w Minnesocie i Norwegii.16,17 HFS występuje zwykle w czwartej lub piątej dekadzie życia, dwa do trzech razy częściej u kobiet niż u mężczyzn, a w populacjach azjatyckich częściej niż u osób rasy kaukaskiej.18 Nawet jedna trzecia pacjentów zgłasza czynniki nasilające HFS, w tym niepokój, stres, zmęczenie, brak snu, czytanie, ekspozycję na światło, żucie lub określone pozycje głowy.18 HFS jest często błędnie rozpoznawany jako czynnościowy lub psychogenny (w 38% przypadków), tiki (w 29%) i porażenie nerwu twarzowego (w 9%).19 Obraz kliniczny obejmuje początkowe skurcze oczodołu, które stopniowo postępują lub rozprzestrzeniają się w czasie, obejmując inne mięśnie jednej połowy twarzy, takie jak mięsień czołowy, oczodół, trójkątny lub mentalny, a nawet mięsień płaszczkowaty.7,18 Objawy HFS mogą utrzymywać się podczas snu, podczas gdy objawy BEB nie występują.
Patofizjologia HFS polega na ucisku nerwu twarzowego w strefie wyjścia korzenia (REZ) z pnia mózgu, który po raz pierwszy opisano w 1947 roku.20 Ucisk może być spowodowany przez nieprawidłowe naczynia, w tym tętnicę przednią dolną móżdżku, tętnicę tylną dolną móżdżku, tętnicę podstawną, tętnicę kręgową; malformacje tętniczo-żylne; oraz bardzo rzadko przez guzy, takie jak schwannoma akustyczna, oponiaki, guzy ślinianki przyusznej i astrocytoma pilocytic.7 Chociaż rozpoznanie HFS jest przede wszystkim kliniczne, zawsze należy wykonać badanie MRI, aby wykluczyć ucisk nerwu twarzowego, jak opisano powyżej. Badanie elektromiograficzne może być również przeprowadzone w celu wykazania patognomonicznej odpowiedzi bocznego rozprzestrzeniania się impulsów pomiędzy sąsiednimi włóknami nerwu twarzowego („transmisja efaptyczna”).20
Podstawą leczenia HFS są wstrzyknięcia toksyny botulinowej, jak opisano powyżej dla BEB. W przypadku HFS wstrzykuje się od pięciu do dziesięciu miejsc po stronie dotkniętej chorobą, a łączna dawka onabotulinumtoxinA wynosi od 10 do 34 jednostek na zabieg.20 Ostatecznym sposobem leczenia HFS jest neurochirurgiczna dekompresja mikronaczyniowa (MVD) w celu zmniejszenia ucisku nerwu twarzowego w jego REZ. We wcześniejszych badaniach u około 95% pacjentów, u których wykonano MVD z powodu HFS, uzyskano dobre lub nawet doskonałe wyniki, przy czym działania niepożądane obejmowały porażenie nerwu twarzowego u 19%, deficyty słuchu u 7% i porażenia dolnych nerwów czaszkowych u 2,8%.21 Biorąc pod uwagę inwazyjność i ryzyko związane z interwencją neurochirurgiczną, niezwykle ważne jest przeprowadzenie szczerej dyskusji z pacjentem na temat ryzyka i korzyści płynących z zastosowania MVD w porównaniu z iniekcjami toksyny botulinowej lub połączenia obu metod w leczeniu HFS.
Ostatecznym leczeniem spazmu nerwu twarzowego jest neurochirurgiczna mikronaczyniowa dekompresja (MVD) w celu zmniejszenia ucisku nerwu twarzowego w strefie jego wyjścia z korzenia.
Podsumowując, skurcze powiek i twarzy stanowią spektrum mimowolnych zaburzeń ruchowych twarzy, które mogą mieć poważny wpływ na jakość życia pacjentów i ich samopoczucie psychiczne. Podczas gdy w leczeniu zaleca się unikanie czynników wywołujących, iniekcje toksyny botulinowej stały się leczeniem pierwszego rzutu, szczególnie w przypadku BEB i HFS. Leczenie chirurgiczne w przypadku BEB i HFS może być jednak kontynuowane w przypadkach opornych na leczenie lub u pacjentów nietolerujących iniekcji toksyny botulinowej. Biorąc pod uwagę częstą błędną diagnozę tych zaburzeń, ważne jest, aby lekarze byli zaznajomieni z najczęstszymi objawami i symptomami, aby połączyć tych pacjentów z neurologami lub okulistami w celu dalszej oceny i postępowania. REVIEW
Dr Gervasio jest rezydentem okulistyki w Wills Eye Hospital. Dr Moster jest lekarzem prowadzącym w Neuro-Oftalmologii w Wills i profesorem neurologii i okulistyki na Uniwersytecie Thomasa Jeffersona w Filadelfii. Jest przewodniczącym neurooftalmologii w Einstein Medical Center w Filadelfii.
1. Hwang CJ, Eftekhari K. Benign essential blepharospasm: Co wiemy i czego nie wiemy. Int Ophthalmol Clin 2018;58:1:11-24.
2. Miller NR. Miokymia powiek. Surv Ophthalmol 2011;56:3:277-8.
3. Barmettler A, Dinkin MJ, Lelli GJ. Eyelid myokymia: Not always benign. Orbit 2011;30:6:289-90.
4. Jordan DR, Anderson RL, Thiese SM. Intractable orbicularis myokymia: Treatment alternatives. Ophthalmic Surg 1989;20:4:280-3.
5. Horowitz SH. Hemifacial spasm and facial myokymia: Electrophysiological findings. Muscle Nerve 1987;10:422-427.
6. Mackenzie W. Przypadek intensywnej i długo utrzymującej się fotofobii i blepharospasm, złagodzone przez wdychanie chloroformu. Med Chir Trans 1857;40:175-178.
7. Ozzello DJ, Giacometti JN. Toksyny botulinowe w leczeniu istotnego blepharospasm i hemifacial spasm. Int Ophthalmol Clin 2018;58:1:49-61.
8) Bradley EA, Hodge DO, Bartley GB. Benign essential blepharospasm among residents of Olmsted County, Minnesota, 1976-1995: An epidemiologic study. Ophthal Plast Reconstr Surg 2003;19:177-181.
9. Baker RS, Andersen AH, Morecraft RJ, et al. A functional magnetic resonance imaging study in patients with benign essential blepharospasm. J Neuroophthalmol 2003;23:11-15.
10. Schicatano EJ, Basso MA, Evinger C. Animal model explains the origins of the cranial dystonia benign essential blepharospasm. J Neurophysiol 1997;77:2842-2846.
11. Yen MT. Postępy w leczeniu łagodnego istotnego blepharospazmu. Curr Opin Ophthalmol 2018;29:440-44.
12. Coscarelli JM. Essential blepharospasm. Semin Ophthalmol 2010;25:3:104-8.
13. Herz NL, Yen MT. Modulation of sensory photophobia in essential blepharospasm with chromatic lenses. Ophthalmology 2005;112:2208-2211.
14. Broadbent TJ, Wesley RE, Mawn LA. A survey of current blepharospasm treatment patterns among oculoplastic surgeons. Ophthalmic Plast Reconstr Surg 2016;32:1:24-7.
15. Ben Simon GJ, McCann JD. Benign essential blepharospasm. Int Ophthalmol Clin 2005;45:49-75.
16. Auger RG, Whisnant JP. Hemifacial spasm in Rochester and Olmsted County, Minnesota, 1960 to 1984. Arch Neurol 1990;47:1233-34.
17. Nilsen B, Le KD, Dietrichs E. Prevalence of hemifacial spasm in Oslo, Norway. Neurology 2004;63:1532-33.
18. Lefaucheur JP, Daamer NB, Sangla S, Guerinel CL. Diagnostyka pierwotnego spazmu półkolistego. Neurochiurgie 2018;64:2:82-86.
19. Martinez AR, Nunes MD, Immich ND, et al. Misdiagnosis of hemifacial spasm is a frequent event in the primary care setting. Arq Neuropsiquiatr 2014;72:119-22.
20. Campbell E, Keedy C. Hemifacial spasm: A note on the etiology in two cases. J Neurosurg 1947;4:342-47.
21. Huh R, Han IB, Moon JY, et al. Microvascular decompression for hemifacial spasm: Analyses of operative complications in 1582 consecutive patients. Surg Neurol 2008;69:153-57.
.