Videnskab > Kemi > Tredje række elementer > Metallic Character of Third Row Elements
I denne artikel vil vi studere tendensen i metallic karakter af tredje række elementer.
Metalkarakter:
Tendensen hos et atom til at miste elektroner for at danne positivt ladede ioner kaldes dets metalkarakter eller elektropositive karakter. Typisk viser metaller glans og er gode ledere af varme og elektricitet.
Nonmetallisk karakter:
Tendensen hos et atom til at få elektroner til at danne negativt ladede ioner kaldes dets ikke-metalliske karakter eller elektronegative karakter.
Faktorer, der påvirker metalliske og ikke-metalliske karakterer:
- Størrelse af et atom
- Ioniseringsenthalpi
- Kerneladning
Tendenser i metalliske og ikke-metalliske karakterer:
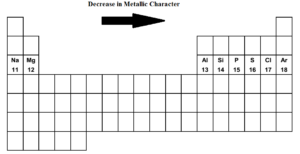
Når vi bevæger os gennem det periodiske system fra venstre til højre i.dvs. fra natrium til argon i den tredje periode falder metallisk karakter og ikke-metallisk karakter stiger. Natrium, magnesium og aluminium er typiske metaller. Silicium er en metalloid. (svagt ikke-metallisk). Fosfor, svovl og klor er ikke-metaller. Argon er en inert gas.
Natrium er det mest metalliske grundstof, mens klor er det mest ikke-metalliske grundstof. Både de ekstreme grundstoffer natrium og klor er ekstremt reaktive. Argon er hverken elektropositivt eller elektronegativt.
Videnskabelige begrundelser:
Da vi bevæger os gennem det periodiske system fra venstre mod højre, dvs. fra natrium til argon i den tredje periode, falder den metalliske karakter, og den ikke-metalliske karakter stiger.
Da vi bevæger os fra venstre mod højre i den tredje periode, stiger atomtallet. Når vi bevæger os fra natrium til argon, stiger kerneladningen således, og fra venstre til højre tilføjes der yderligere elektroner til den samme, dvs. tredje bane. På grund af stigningen i kerneladningen øges den tiltrækkende kraft på elektronerne i den yderste bane, og dermed falder atomets størrelse.
Da vi bevæger os fra venstre til højre i den tredje periode, stiger ioniseringsenthaltien. Fra venstre til højre i den tredje periode stiger elektronegativiteten, dvs. tendensen til at miste elektroner falder og tendensen til at få elektroner stiger. Når vi bevæger os fra venstre til højre i den tredje periode, stiger valensantallet. Når vi bevæger os gennem det periodiske system fra venstre til højre, dvs. fra natrium til argon i tredje periode, falder metallisk karakter og ikke-metallisk karakter stiger.
Natrium, magnesium og aluminium er typiske metaller.
Elementernes metalliske og ikke-metalliske karakterer afhænger af deres atomare størrelse, kerneladning og ioniseringspotentiale. Natrium, magnesium og aluminium har atomnummer henholdsvis 11, 12 og 13. De indeholder 1, 2, 3 valenselektroner i deres yderste skal.
Sammenlignet med andre grundstoffer i tredje række er deres atomstørrelser større. Tilsvarende er kerneladningerne også mindre. På grund af dette er tiltrækningskraften på valenselektronerne mindre. Sammenlignet med andre grundstoffer i tredje række er deres ioniseringsenthalpier lavere. Tendensen for disse grundstoffer er således at miste deres valenselektroner. Derfor er natrium, magnesium og aluminium typiske metaller.
Fosfor, svovl og klor er ikke-metaller.
Elementernes metalliske og ikke-metalliske karakterer afhænger af deres atomare størrelse, kerneladning og ioniseringspotentiale. Fosfor, svovl og klor har henholdsvis atomnummer 15, 16 og 17. De indeholder 5, 6, 7 valenselektroner i deres yderste skal.
Sammenlignet med andre grundstoffer i tredje række er deres atomstørrelser mindre. Tilsvarende er kerneladningerne også større. På grund af dette er tiltrækningskraften på valenselektronerne større. Sammenlignet med andre grundstoffer i tredje række er deres ioniseringsenthalpier højere. Tendensen for disse grundstoffer er således ikke at miste deres valenselektroner, men at få elektroner. Derfor er fosfor, svovl og klor ikke-metaller.
Argon er hverken et elektropositivt eller elektronegativt element.
Elementernes metalliske og ikke-metalliske karakterer afhænger af deres atomare størrelse, kerneladning og ioniseringspotentiale. Argon har atomnummer 18. Det indeholder 8 valenselektroner i deres yderste skal. Argon har komplet oktet og fuldstændigt fyldte s- og p-orbitaler og har dermed den mest stabile elektroniske konfiguration i tredje-rækkens grundstoffer, som det ikke vil forstyrre ved at acceptere eller miste elektroner.
I forhold til andre grundstoffer i tredje række er dets atomstørrelser større, men effekten af fyldte s- og p-orbitaler er dominerende. Sammenlignet med andre grundstoffer i tredje række er dets ioniseringsenthalpi den højeste. Argons tendens til at miste eller få valenselektroner er således næsten ikke til stede. Derfor er argon hverken et elektropositivt eller elektronegativt grundstof.
Natrium er det mest metalliske grundstof.
Grundstoffernes metalliske og ikke-metalliske karakterer afhænger af deres atomare størrelse, kerneladning og ioniseringspotentiale. Natrium har atomnummer 11. Det indeholder 1 valenselektron i sin yderste skal.
Sammenlignet med andre grundstoffer i tredje række er dets atomstørrelse større. På samme måde er kerneladningen også mindre. På grund af dette er den tiltrækkende kraft på valenselektronen mindre. Sammenlignet med andre grundstoffer i tredje række er dets ioniseringsenthalpi den laveste. Natrium har således en tendens til at miste sin valenselektron. Natrium er derfor det mest metalliske grundstof.
Chlor er det mest ikke-metalliske grundstof.
Elementernes metalliske og ikke-metalliske karakterer afhænger af deres atomare størrelse, kerneladning og ioniseringspotentiale. Klor har atomnummer 17. Det indeholder 7 valenselektroner i sin yderste skal.
Sammenlignet med de andre grundstoffer i tredje række er dets atomstørrelse den mindste. På samme måde er kerneladningen også større. På grund af dette er den tiltrækkende kraft på valenselektronerne større. Sammenlignet med andre grundstoffer i tredje række er dets ioniseringsenthalpi den højeste. Tendensen for klor er således ikke at miste sine valenselektroner, men at få elektroner. Derfor er klor det mest ikke-metalliske grundstof.