Ciência > Química > Elementos da terceira linha >Caracter metálico dos elementos da terceira linha
Neste artigo, estudaremos a tendência im caráter metálico dos elementos da terceira linha.
Caracter metálico:
A tendência de um átomo a perder electrões para formar iões com carga positiva é chamada o seu carácter metálico ou carácter electropositivo. Tipicamente os metais mostram brilho e são bons condutores de calor e electricidade.
Caracter não metálico:
A tendência de um átomo ganhar electrões para formar iões carregados negativamente chama-se o seu carácter não metálico ou carácter electronegativo.
Factores que afectam caracteres metálicos e não metálicos:
- Tamanho de um átomo
- Entalpia de ionização
- Carga nuclear
Tendências em caracteres metálicos e não metálicos:
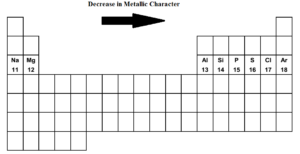
Como nos movemos através da tabela periódica da esquerda para a direita i.e. de sódio para argônio no terceiro período o caracter metálico diminui e o não metálico aumenta. Sódio, magnésio, alumínio são metais típicos. O silício é metalóide. (fracamente não metálico). Fósforo, enxofre, cloro são metais não metálicos. Argônio é um gás inerte.
Sódio é o elemento mais metálico, enquanto o cloro é o elemento mais não metálico. Ambos os elementos extremos, sódio e cloro, são extremamente reativos. O árgon não é nem electropositivo nem electronegativo.
Relações científicas:
Como nos movemos através da tabela periódica da esquerda para a direita, ou seja, do sódio para o árgon no terceiro período o carácter metálico diminui e o não metálico aumenta.
Como nos movemos da esquerda para a direita no terceiro período o número atómico continua a aumentar. Assim, à medida que passamos de sódio para argônio a carga nuclear aumenta e da esquerda para a direita um elétron adicional é adicionado à mesma, ou seja, à terceira órbita. Devido ao aumento da carga nuclear, a força atrativa sobre os elétrons na órbita mais externa aumenta e assim o tamanho do átomo diminui.
À medida que nos movemos da esquerda para a direita no terceiro período, a entalpia de ionização aumenta. Da esquerda para a direita no terceiro período a eletronegatividade aumenta, ou seja, a tendência de perda de elétrons diminui e a tendência de ganho de elétrons aumenta. medida que nos movemos da esquerda para a direita no terceiro período, o número de valências aumenta. Assim, conforme nos movemos na tabela periódica da esquerda para a direita, ou seja, do sódio para o árgon no terceiro período, os caracteres metálicos diminuem e os caracteres não metálicos aumentam.
Sódio, Magnésio, Alumínio são metais típicos.
Caracteres metálicos e não metálicos dos elementos dependem de seu tamanho atômico, carga nuclear e potencial de ionização. Sódio, magnésio, alumínio têm números atómicos 11, 12, 13 respectivamente. Eles contêm 1, 2, 3 elétrons de valência em sua casca mais externa.
Comparados com outros elementos da terceira linha, seus tamanhos atômicos são maiores. Da mesma forma, as cargas nucleares também são menores. Devido a esta força atrativa sobre os elétrons de valência é menor. Em comparação com outros elementos da terceira fila, suas entalpias de ionização são menores. Assim, a tendência destes elementos é perder seus elétrons de valência. Assim, sódio, magnésio, alumínio são metais típicos.
Fósforo, enxofre, cloro são não metais.
Caracteres metálicos e não metálicos dos elementos dependem do seu tamanho atómico, carga nuclear e potencial de ionização. Fósforo, enxofre e cloro têm números atómicos 15, 16, 17 respectivamente. Eles contêm 5, 6, 7 elétrons de valência em sua casca mais externa.
Comparados com outros elementos da terceira linha, seus tamanhos atômicos são menores. Da mesma forma, as cargas nucleares também são mais. Devido a esta força atrativa sobre os elétrons de valência é mais. Em comparação com outros elementos da terceira fila, suas entalpias de ionização são mais altas. Assim, a tendência destes elementos não é perder seus elétrons de valência, mas ganhar elétrons. Assim, fósforo, enxofre, cloro são não metais.
Argon não é elemento eletropositivo nem eletronegativo.
Caracteres metálicos e não metálicos dos elementos dependem de seu tamanho atômico, carga nuclear e potencial de ionização. O árgon tem número atómico 18. Contém 8 valências de elétrons em sua casca mais externa. O árgon tem o octeto completo e completamente preenchido s e orbitais p, portanto tem a configuração eletrônica mais estável em elementos de terceira linha, que não irá perturbar ao aceitar ou perder o elétron.
Comparado com outros elementos da terceira linha seus tamanhos atômicos são maiores, mas o efeito de preenchimento s e orbitais p é dominante. Em comparação com outros elementos da terceira fila sua entalpia de ionização é a mais alta. Assim, a tendência do Argon para perder ou ganhar elétrons de valência é quase inexistente. Assim o Argônio não é elemento eletropositivo nem eletronegativo.
Sódio é o elemento mais metálico.
Caracteres metálicos e não metálicos dos elementos dependem do seu tamanho atômico, carga nuclear e potencial de ionização. O sódio tem números atómicos 11. Contém 1 electrão de valência na sua casca mais externa.
Comparado com outros elementos da terceira fila o seu tamanho atómico é maior. Da mesma forma, a carga nuclear também é menor. Devido a esta força atractiva sobre o electrão de valência é menor. Em comparação com outros elementos da terceira fila, sua entalpia de ionização é a mais baixa. Assim, a tendência do sódio é perder o seu electrão de valência. Assim o Sódio é o elemento mais metálico.
Cloro é o elemento mais não metálico.
Os caracteres metálicos e não metálicos dos elementos dependem do seu tamanho atómico, carga nuclear e potencial de ionização. O cloro tem o número atómico 17. Contém 7 electrões de valência na sua casca mais exterior.
Comparado com outros elementos da terceira fila o seu tamanho atómico é o menor. Da mesma forma, a carga nuclear também é mais. Devido a esta força atrativa sobre os elétrons de valência é mais. Em comparação com outros elementos da terceira fila, sua entalpia de ionização é a mais alta. Assim, a tendência do Cloro não é perder seus elétrons de valência, mas ganhar elétrons. Assim o Cloro é o elemento mais não metálico.