Tiede > Kemia > Third Row Elements > Metallic Character of Third Row Elements
Tässä artikkelissa tutkimme kolmannen rivin alkuaineiden metallisen luonteen suuntausta im.
Metalliominaisuus:
Atomin taipumusta menettää elektroneja muodostaakseen positiivisesti varautuneen ionin kutsutaan sen metalliominaisuudeksi tai sähköpositiiviseksi luonteeksi. Tyypillisesti metallit kiiltävät ja johtavat hyvin lämpöä ja sähköä.
Metalliton luonne:
Atomin taipumusta saada elektroneja negatiivisesti varautuneen ionin muodostamiseksi kutsutaan sen epämetalliseksi tai elektronegatiiviseksi luonteeksi.
Tekijät, jotka vaikuttavat metallisiin ja ei-metallisiin luonteenpiirteisiin:
- Atomin koko
- Ionisaatioentalpia
- Ionisaatioentalpia
- Ydinvaraus
Trendit metallisissa ja ei-metallisissa luonteenpiirteissa:
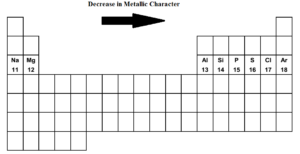
Kun liikumme jaksollisen järjestelmän läpi vasemmalta oikealle i.eli natriumista argoniin kolmannessa jaksossa metallinen luonne vähenee ja ei-metallinen luonne kasvaa. Natrium, magnesium ja alumiini ovat tyypillisiä metalleja. Pii on metalloidi. (heikosti epämetallinen). Fosfori, rikki ja kloori ovat epämetalleja. Argon on inertti kaasu.
Natrium on metallisin alkuaine, kun taas kloori on epämetallisin alkuaine. Molemmat äärialkuaineet natrium ja kloori ovat erittäin reaktiivisia. Argon ei ole sähköpositiivinen eikä elektronegatiivinen.
Tieteelliset perustelut:
Kun siirrymme jaksollisessa järjestelmässä vasemmalta oikealle eli natriumista argoniin kolmannessa jaksossa metallinen luonne vähenee ja epämetallinen luonne lisääntyy.
Kun siirrymme kolmannessa jaksossa vasemmalta oikealle, järjestysluku kasvaa. Näin ollen siirryttäessä natriumista argoniin ydinvaraus kasvaa ja vasemmalta oikealle lisätään ylimääräinen elektroni samalle eli kolmannelle radalle. Ydinvarauksen lisääntymisen vuoksi uloimmalla radalla oleviin elektroneihin kohdistuva vetovoima kasvaa ja näin ollen atomin koko pienenee.
Kun siirrymme kolmannessa jaksossa vasemmalta oikealle, ionisaatioentalpia kasvaa. Vasemmalta oikealle kolmannessa jaksossa elektronegatiivisuus kasvaa eli elektronien menettämisen taipumus pienenee ja elektronien saamisen taipumus kasvaa. Siirryttäessä kolmannessa jaksossa vasemmalta oikealle valenssiluku kasvaa. Näin ollen siirryttäessä jaksollisessa järjestelmässä vasemmalta oikealle eli natriumista argoniin kolmannessa jaksossa metallinen luonne pienenee ja epämetallinen luonne kasvaa.
Natrium, magnesium ja alumiini ovat tyypillisiä metalleja.
Elementtien metalliset ja epämetalliset luonteet riippuvat niiden atomikokosta, ydinvarauksesta ja ionisaatiopotentiaalista. Natriumilla, magnesiumilla ja alumiinilla on atomiluvut 11, 12 ja 13. Niillä on 1, 2, 3 valenssielektronia uloimmassa kuoressaan.
Vertailtuna muihin kolmannen rivin alkuaineisiin niiden atomikoko on suurempi. Samoin myös ydinvaraukset ovat pienemmät. Tästä johtuen valenssielektronien vetovoima on pienempi. Verrattuna muihin kolmannen rivin alkuaineisiin niiden ionisaatioentalpiat ovat pienempiä. Näin ollen näillä alkuaineilla on taipumus menettää valenssielektroneitaan. Näin ollen natrium, magnesium ja alumiini ovat tyypillisiä metalleja.
Fosfori, rikki ja kloori ovat epämetalleja.
Alkuaineiden metalliset ja epämetalliset ominaisuudet riippuvat niiden atomikoosta, ydinvarauksesta ja ionisaatiopotentiaalista. Fosforin, rikin ja kloorin järjestysluvut ovat 15, 16 ja 17. Niiden uloimmassa kuoressa on 5, 6 ja 7 valenssielektronia.
Vertailtuna muihin kolmannen rivin alkuaineisiin niiden atomikoko on pienempi. Samoin myös ydinvaraukset ovat suuremmat. Tästä johtuen valenssielektronien vetovoima on suurempi. Verrattuna muihin kolmannen rivin alkuaineisiin niiden ionisaatioentalpiat ovat suurempia. Näin ollen näillä alkuaineilla ei ole taipumusta menettää valenssielektroneitaan vaan saada elektroneja. Näin ollen fosfori, rikki ja kloori ovat epämetalleja.
Argon ei ole sähköpositiivinen eikä elektronegatiivinen alkuaine.
Alkuaineiden metalliset ja epämetalliset ominaisuudet riippuvat niiden atomikoosta, ydinvarauksesta ja ionisaatiopotentiaalista. Argonin järjestysluku on 18. Se sisältää 8 valenssielektronia uloimmassa kuoressaan. Argonilla on täydellinen oktetti ja täysin täytetyt s- ja p-orbitaalit, joten sillä on kolmannen rivin alkuaineista vakain elektronikonfiguraatio, jota se ei häiritse hyväksymällä tai menettämällä elektronia.
Vertailtuna muihin kolmannen rivin alkuaineisiin sen atomikoko on suurempi, mutta täytettyjen s- ja p-orbitaalien vaikutus on hallitseva. Verrattuna muihin kolmannen rivin alkuaineisiin sen ionisaatioentalpia on suurin. Argonilla ei siis ole juuri lainkaan taipumusta menettää tai saada valenssielektroneita. Argon ei siis ole sen enempää sähköpositiivinen kuin elektronegatiivinenkaan alkuaine.
Natrium on metallisin alkuaine.
Alkuaineiden metalliset ja epämetalliset ominaisuudet riippuvat alkuaineiden atomikoosta, ydinvarauksesta ja ionisaatiopotentiaalista. Natriumilla on atomiluku 11. Se sisältää 1 valenssielektronin uloimmassa kuoressaan.
Vertailtuna muihin kolmannen rivin alkuaineisiin sen atomikoko on suurempi. Samoin ydinvaraus on pienempi. Tästä johtuen valenssielektroniin kohdistuva vetovoima on pienempi. Verrattuna muihin kolmannen rivin alkuaineisiin sen ionisaatioentalpia on pienin. Näin ollen natriumilla on taipumus menettää valenssielektroninsa. Näin ollen natrium on metallisin alkuaine.
Kloori on epämetallisin alkuaine.
Alkuaineiden metalliset ja epämetalliset ominaisuudet riippuvat niiden atomikoosta, ydinvarauksesta ja ionisaatiopotentiaalista. Kloorin järjestysluku on 17. Se sisältää 7 valenssielektronia uloimmassa kuoressaan.
Kolmannen rivin muihin alkuaineisiin verrattuna sen atomikoko on pienin. Samoin myös ydinvaraus on suurempi. Tästä johtuen valenssielektronien vetovoima on suurempi. Verrattuna muihin kolmannen rivin alkuaineisiin sen ionisaatioentalpia on suurin. Näin ollen kloorilla ei ole taipumusta menettää valenssielektroneitaan vaan saada elektroneja. Näin ollen kloori on kaikkein epämetallisin alkuaine.