Science >Chimie >Éléments de troisième rang >Caractère métallique des éléments de troisième rang
Dans cet article, nous étudierons la tendance im caractère métallique des éléments de troisième rang.
Caractère métallique:
La tendance d’un atome à perdre des électrons pour former un ion chargé positivement est appelée son caractère métallique ou caractère électropositif. Généralement, les métaux présentent un éclat et sont de bons conducteurs de chaleur et d’électricité.
Caractère non métallique :
La tendance d’un atome à gagner des électrons pour former un ion chargé négativement est appelée son caractère non métallique ou caractère électronégatif.
Facteurs affectant les caractères métalliques et non métalliques :
- Taille d’un atome
- Ethalpie d’ionisation
- Charge nucléaire
Tendances des caractères métalliques et non métalliques :
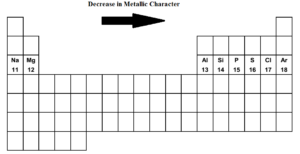
En parcourant le tableau périodique de gauche à droite c’est-à-dire du sodium à l’argon dans le tableau périodique.c’est-à-dire du sodium à l’argon dans la troisième période, le caractère métallique diminue et le caractère non métallique augmente. Le sodium, le magnésium, l’aluminium sont des métaux typiques. Le silicium est un métalloïde. (faiblement non métallique). Le phosphore, le soufre et le chlore sont des non-métaux. L’argon est un gaz inerte.
Le sodium est l’élément le plus métallique tandis que le chlore est l’élément le plus non métallique. Les deux éléments extrêmes que sont le sodium et le chlore sont extrêmement réactifs. L’argon n’est ni électropositif ni électronégatif.
Raisons scientifiques:
A mesure que nous nous déplaçons dans le tableau périodique de gauche à droite, c’est-à-dire du sodium à l’argon dans la troisième période, le caractère métallique diminue et le caractère non métallique augmente.
A mesure que nous nous déplaçons de gauche à droite dans la troisième période, le numéro atomique continue d’augmenter. Ainsi, en allant du sodium à l’argon, la charge nucléaire augmente et de gauche à droite, un électron supplémentaire est ajouté à la même c’est-à-dire à la troisième orbite. En raison de l’augmentation de la charge nucléaire, la force d’attraction sur les électrons dans l’orbite la plus extérieure augmente et donc la taille de l’atome diminue.
A mesure que nous allons de gauche à droite dans la troisième période, l’enthalpie d’ionisation augmente. De gauche à droite dans la troisième période l’électronégativité augmente c’est-à-dire que la tendance à perdre des électrons diminue et la tendance à gagner des électrons augmente. En allant de gauche à droite dans la troisième période, le nombre de valence augmente. Par conséquent, en traversant le tableau périodique de gauche à droite c’est-à-dire du sodium à l’Argon dans la troisième période le caractère métallique diminue et le caractère non métallique augmente.
Le sodium, le magnésium, l’aluminium sont des métaux typiques.
Les caractères métalliques et non métalliques des éléments dépendent de leur taille atomique, de leur charge nucléaire et de leur potentiel d’ionisation. Le sodium, le magnésium, l’aluminium ont respectivement les numéros atomiques 11, 12, 13. Ils contiennent 1, 2, 3 électrons de valence dans leur coquille la plus externe.
Par rapport aux autres éléments de la troisième rangée, leurs tailles atomiques sont plus grandes. De même, les charges nucléaires sont également moins importantes. En raison de cela, la force d’attraction sur les électrons de valence est moindre. Par rapport aux autres éléments de la troisième rangée, leurs enthalpies d’ionisation sont plus faibles. Ainsi, la tendance de ces éléments est de perdre leurs électrons de valence. D’où le sodium, le magnésium, l’aluminium sont des métaux typiques.
Le phosphore, le soufre, le chlore sont des non-métaux.
Les caractères métalliques et non métalliques des éléments dépendent de leur taille atomique, de leur charge nucléaire et de leur potentiel d’ionisation. Le phosphore, le soufre, le chlore ont respectivement les numéros atomiques 15, 16, 17. Ils contiennent 5, 6, 7 électrons de valence dans leur coquille la plus externe.
Par rapport aux autres éléments de la troisième rangée, leurs tailles atomiques sont plus petites. De même, les charges nucléaires sont également plus importantes. En raison de cette force d’attraction sur les électrons de valence est plus. Par rapport aux autres éléments de la troisième rangée, leurs enthalpies d’ionisation sont plus élevées. Ainsi, la tendance de ces éléments n’est pas de perdre leurs électrons de valence mais de gagner des électrons. Par conséquent, le phosphore, le soufre, le chlore sont des non-métaux.
L’argon n’est pas un élément électropositif ni électronégatif.
Les caractères métalliques et non métalliques des éléments dépendent de leur taille atomique, de leur charge nucléaire et de leur potentiel d’ionisation. L’argon a le numéro atomique 18. Il contient 8 électrons de valence dans leur coquille la plus externe. L’argon a un octuor complet et des orbitales s et p complètement remplies donc il a la configuration électronique la plus stable des éléments de la troisième rangée qu’il ne perturbera pas en acceptant ou en perdant l’électron.
Par rapport aux autres éléments de la troisième rangée ses tailles atomiques sont plus grandes mais l’effet des orbitales s et p remplies est dominant. Par rapport aux autres éléments de la troisième rangée, son enthalpie d’ionisation est la plus élevée. Ainsi, la tendance de l’argon à perdre ou à gagner des électrons de valence est presque absente. Par conséquent, l’Argon n’est ni un élément électropositif ni un élément électronégatif.
Le sodium est l’élément le plus métallique.
Les caractères métalliques et non métalliques des éléments dépendent de leur taille atomique, de leur charge nucléaire et de leur potentiel d’ionisation. Le sodium a un numéro atomique de 11. Il contient 1 électron de valence dans sa coquille la plus externe.
Par rapport aux autres éléments de la troisième rangée, sa taille atomique est plus grande. De même, sa charge nucléaire est également moindre. En raison de cette force d’attraction sur l’électron de valence est moindre. Par rapport aux autres éléments de la troisième rangée, son enthalpie d’ionisation est la plus faible. Le sodium a donc tendance à perdre son électron de valence. Par conséquent, le Sodium est l’élément le plus métallique.
Le chlore est l’élément le plus non métallique.
Les caractères métalliques et non métalliques des éléments dépendent de leur taille atomique, de leur charge nucléaire et de leur potentiel d’ionisation. Le chlore a le numéro atomique 17. Il contient 7 électrons de valence dans sa coquille la plus externe.
Par rapport aux autres éléments de la troisième rangée, sa taille atomique est la plus petite. De même, sa charge nucléaire est également plus importante. En raison de cette force d’attraction sur les électrons de valence est plus. Par rapport aux autres éléments de la troisième rangée, son enthalpie d’ionisation est la plus élevée. Ainsi, la tendance du chlore n’est pas de perdre ses électrons de valence mais de gagner des électrons. D’où le fait que le chlore est l’élément le plus non métallique.
Science >Chimie >Éléments de troisième rang >Caractère métallique des éléments de troisième rang
.