Vetenskap > Kemi > Third Row Elements > Metallic Character of Third Row Elements
I den här artikeln kommer vi att studera trenden i metallic character of third row elements.
Metallisk karaktär:
Tendensen hos en atom att förlora elektroner för att bilda en positivt laddad jon kallas dess metalliska karaktär eller elektropositiva karaktär. Metaller uppvisar vanligtvis glans och är goda ledare för värme och elektricitet.
Nonmetallisk karaktär:
Tendensen hos en atom att vinna elektroner för att bilda en negativt laddad jon kallas dess icke-metalliska karaktär eller elektronegativa karaktär.
Faktorer som påverkar metalliska och icke-metalliska karaktärer:
- Atomens storlek
- Ioniseringsenthalpi
- Kärnladdning
Trender i metalliska och icke-metalliska karaktärer:
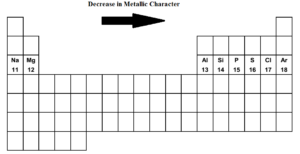
När vi rör oss över det periodiska systemet från vänster till höger i.t.ex. från natrium till argon i den tredje perioden minskar metallisk karaktär och icke-metallisk karaktär ökar. Natrium, magnesium och aluminium är typiska metaller. Kisel är en metalloid. (svagt icke-metallisk). Fosfor, svavel och klor är icke-metaller. Argon är en inert gas.
Natrium är det mest metalliska grundämnet medan klor är det mest icke-metalliska grundämnet. Både de extrema grundämnena natrium och klor är extremt reaktiva. Argon är varken elektropositivt eller elektronegativt.
Vetenskapliga skäl:
När vi rör oss genom det periodiska systemet från vänster till höger, dvs. från natrium till argon i den tredje perioden, minskar den metalliska karaktären och den icke-metalliska karaktären ökar.
När vi rör oss från vänster till höger i den tredje perioden ökar atomnumret. När vi rör oss från natrium till argon ökar alltså kärnladdningen och från vänster till höger läggs ytterligare en elektron till i samma, dvs. den tredje banan. På grund av ökningen av kärnladdningen ökar attraktionskraften på elektronerna i den yttersta banan och därmed minskar atomens storlek.
När vi rör oss från vänster till höger i den tredje perioden ökar joniseringsenthalpin. Från vänster till höger i den tredje perioden ökar elektronegativiteten dvs. tendensen att förlora elektroner minskar och tendensen att vinna elektroner ökar. När vi rör oss från vänster till höger i den tredje perioden ökar valensantalet. När vi rör oss över det periodiska systemet från vänster till höger, dvs. från natrium till argon i den tredje perioden, minskar den metalliska karaktären och den icke-metalliska karaktären ökar.
Natrium, magnesium och aluminium är typiska metaller.
Elementens metalliska och icke-metalliska karaktärer beror på deras atomstorlek, kärnladdning och joniseringspotential. Natrium, magnesium och aluminium har atomnummer 11, 12 respektive 13. De innehåller 1, 2, 3 valenselektroner i sitt yttersta skal.
Vid jämförelse med andra grundämnen i den tredje raden är deras atomstorlek större. På samma sätt är kärnladdningarna också mindre. På grund av detta är attraktionskraften på valenselektronerna mindre. Jämfört med andra grundämnen i den tredje raden är deras joniseringsenthalpier lägre. Dessa grundämnen tenderar således att förlora sina valenceelektroner. Natrium, magnesium och aluminium är därför typiska metaller.
Fosfor, svavel och klor är icke-metaller.
Elementens metalliska och icke-metalliska egenskaper beror på deras atomstorlek, kärnladdning och joniseringspotential. Fosfor, svavel och klor har atomnummer 15, 16 respektive 17. De innehåller 5, 6, 7 valenselektroner i sitt yttersta skal.
Vid jämförelse med andra grundämnen i den tredje raden är deras atomstorlek mindre. På samma sätt är kärnladdningarna också större. På grund av detta är attraktionskraften på valenselektronerna större. Jämfört med andra grundämnen i den tredje raden är deras joniseringsenthalpier högre. Tendensen hos dessa grundämnen är således inte att förlora sina valenceelektroner utan att vinna elektroner. Därför är fosfor, svavel och klor icke-metaller.
Argon är varken ett elektropositivt eller elektronegativt grundämne.
Gruppernas metalliska och icke-metalliska egenskaper beror på deras atomstorlek, kärnladdning och joniseringspotential. Argon har atomnummer 18. Det innehåller 8 valenselektroner i sitt yttersta skal. Argon har fullbordad oktett och helt fyllda s- och p-orbitaler och har därmed den mest stabila elektroniska konfigurationen bland grundämnena i tredje raden, som den inte kommer att störa genom att acceptera eller förlora elektroner.
Jämfört med andra grundämnen i tredje raden är dess atomstorlekar större men effekten av fyllda s- och p-orbitaler är dominerande. Jämfört med andra grundämnen i den tredje raden är dess joniseringsenthalpi den högsta. Argons tendens att förlora eller vinna valenselektroner är således nästan obefintlig. Därför är argon varken ett elektropositivt eller elektronegativt grundämne.
Natrium är det mest metalliska grundämnet.
Gruppernas metalliska och icke-metalliska egenskaper beror på deras atomstorlek, kärnladdning och joniseringspotential. Natrium har atomnummer 11. Det innehåller 1 valenselektron i sitt yttersta skal.
Vid jämförelse med andra grundämnen i den tredje raden är dess atomstorlek större. På samma sätt är kärnladdningen också mindre. På grund av detta är attraktionskraften på valenselektronen mindre. Jämfört med andra grundämnen i den tredje raden är dess joniseringsenthalpi lägst. Natrium tenderar alltså att förlora sin valenselektron. Natrium är därför det mest metalliska grundämnet.
Klor är det mest icke-metalliska grundämnet.
Elementens metalliska och icke-metalliska egenskaper beror på deras atomstorlek, kärnladdning och joniseringspotential. Klor har atomnummer 17. Det innehåller 7 valenselektroner i sitt yttersta skal.
Vid jämförelse med andra grundämnen i den tredje raden är dess atomstorlek den minsta. På samma sätt är kärnladdningen också större. På grund av detta är attraktionskraften på valenselektronerna större. Jämfört med andra grundämnen i den tredje raden är dess joniseringsenthalpi högst. Klorets tendens är således inte att förlora sina valenselektroner utan att vinna elektroner. Därför är klor det mest icke-metalliska grundämnet.