Ciencia >Química >Elementos de tercera fila >Carácter metálico de los elementos de tercera fila
En este artículo, estudiaremos la tendencia im carácter metálico de los elementos de tercera fila.
Carácter metálico:
La tendencia de un átomo a perder electrones para formar iones con carga positiva se denomina carácter metálico o carácter electropositivo. Normalmente los metales muestran brillo y son buenos conductores del calor y la electricidad.
Carácter no metálico:
La tendencia de un átomo a ganar electrones para formar iones con carga negativa se denomina carácter no metálico o carácter electronegativo.
Factores que afectan a los caracteres metálicos y no metálicos:
- Tamaño de un átomo
- Entalpía de ionización
- Carga nuclear
Tendencias de los caracteres metálicos y no metálicos:
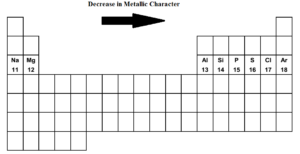
Al recorrer la tabla periódica de izquierda a derecha i.es decir, desde el sodio hasta el argón en el tercer período el carácter metálico disminuye y el carácter no metálico aumenta. El sodio, el magnesio y el aluminio son metales típicos. El silicio es un metaloide (débilmente no metálico). El fósforo, el azufre y el cloro son no metales. El argón es un gas inerte.
El sodio es el elemento más metálico mientras que el cloro es el elemento más no metálico. Ambos elementos extremos, el sodio y el cloro, son extremadamente reactivos. El argón no es ni electropositivo ni electronegativo.
Razones científicas:
A medida que nos desplazamos por la tabla periódica de izquierda a derecha, es decir, desde el sodio hasta el argón en el tercer período, el carácter metálico disminuye y el carácter no metálico aumenta.
A medida que nos desplazamos de izquierda a derecha en el tercer período el número atómico va aumentando. Así, al pasar del sodio al argón la carga nuclear aumenta y de izquierda a derecha se añade un electrón adicional a la misma, es decir, a la tercera órbita. Debido al aumento de la carga nuclear la fuerza de atracción sobre los electrones en la órbita más externa aumenta y por lo tanto el tamaño del átomo disminuye.
A medida que nos movemos de izquierda a derecha en el tercer período la entalpía de ionización aumenta. De izquierda a derecha en el tercer período la electronegatividad aumenta, es decir, la tendencia a perder electrones disminuye y la tendencia a ganar electrones aumenta. A medida que nos movemos de izquierda a derecha en el tercer período el número de valencia aumenta. Por lo tanto, a medida que nos movemos a través de la tabla periódica de izquierda a derecha, es decir, desde el sodio hasta el argón en el tercer período, el carácter metálico disminuye y el carácter no metálico aumenta.
El sodio, el magnesio y el aluminio son metales típicos.
Los caracteres metálicos y no metálicos de los elementos dependen de su tamaño atómico, carga nuclear y potencial de ionización. El sodio, el magnesio y el aluminio tienen números atómicos 11, 12 y 13 respectivamente. Contienen 1, 2, 3 electrones de valencia en su capa más externa.
En comparación con otros elementos de la tercera fila sus tamaños atómicos son mayores. Del mismo modo, las cargas nucleares también son menores. Debido a esto la fuerza de atracción sobre los electrones de valencia es menor. En comparación con otros elementos de la tercera fila sus entalpías de ionización son menores. Por lo tanto, la tendencia de estos elementos es a perder sus electrones de valencia. De ahí que el sodio, el magnesio y el aluminio sean metales típicos.
El fósforo, el azufre y el cloro son no metales.
Los caracteres metálicos y no metálicos de los elementos dependen de su tamaño atómico, carga nuclear y potencial de ionización. El fósforo, el azufre y el cloro tienen números atómicos 15, 16 y 17 respectivamente. Contienen 5, 6, 7 electrones de valencia en su capa más externa.
En comparación con otros elementos de la tercera fila sus tamaños atómicos son menores. Del mismo modo, las cargas nucleares también son mayores. Debido a esto la fuerza de atracción sobre los electrones de valencia es mayor. En comparación con otros elementos de la tercera fila sus entalpías de ionización son mayores. Por lo tanto, la tendencia de estos elementos no es perder sus electrones de valencia sino ganar electrones. De ahí que el fósforo, el azufre y el cloro sean no metales.
El argón no es un elemento ni electropositivo ni electronegativo.
Los caracteres metálicos y no metálicos de los elementos dependen de su tamaño atómico, carga nuclear y potencial de ionización. El argón tiene el número atómico 18. Contiene 8 electrones de valencia en su capa más externa. El argón tiene el octeto completo y los orbitales s y p completamente llenos, por lo que tiene la configuración electrónica más estable de los elementos de la tercera fila, que no perturbará aceptando o perdiendo el electrón.
En comparación con otros elementos de la tercera fila, sus tamaños atómicos son mayores, pero el efecto de los orbitales s y p llenos es dominante. En comparación con otros elementos de la tercera fila, su entalpía de ionización es la más alta. Por lo tanto, la tendencia del argón a perder o ganar electrones de valencia es casi inexistente. Por lo tanto, el argón no es un elemento ni electropositivo ni electronegativo.
El sodio es el elemento más metálico.
Los caracteres metálicos y no metálicos de los elementos dependen de su tamaño atómico, carga nuclear y potencial de ionización. El sodio tiene el número atómico 11. Contiene 1 electrón de valencia en su capa más externa.
En comparación con otros elementos de la tercera fila su tamaño atómico es mayor. Del mismo modo, la carga nuclear también es menor. Debido a esto la fuerza de atracción sobre el electrón de valencia es menor. En comparación con otros elementos de la tercera fila, su entalpía de ionización es la más baja. Por lo tanto, la tendencia del sodio es a perder su electrón de valencia. Por lo tanto, el sodio es el elemento más metálico.
El cloro es el elemento más no metálico.
Los caracteres metálicos y no metálicos de los elementos dependen de su tamaño atómico, carga nuclear y potencial de ionización. El cloro tiene el número atómico 17. Contiene 7 electrones de valencia en su capa más externa.
Comparado con otros elementos de la tercera fila su tamaño atómico es el más pequeño. Del mismo modo, la carga nuclear también es mayor. Debido a esto la fuerza de atracción sobre los electrones de valencia es mayor. En comparación con otros elementos de la tercera fila su entalpía de ionización es la más alta. Por lo tanto, la tendencia del cloro no es perder sus electrones de valencia sino ganar electrones. Por lo tanto, el cloro es el elemento más no metálico.