シスチンの腎輸送
アミノ酸は糸球体で容易にろ過され、近位尿細管細胞によってほぼ完全に再吸収される。 濾過されたシスチンはわずか0.4%しか尿中に現れない。 ヒト、ラット、ウサギの近位尿細管から得た細胞膜におけるアミノ酸の輸送について様々な著者が研究してきた。 シスチンの再吸収には少なくとも次の2つの輸送系がある:
-
高親和性システム。 シスチン尿症患者ではこの系が障害される。 高親和性システムは、近位尿細管の直線第三分節(S3)の頂膜で10%のL-シスチンおよび二塩基性アミノ酸の取り込みを仲介する。
-
低親和性システム。 近位尿細管のS1-S2部分に存在し、L-シスチンの再吸収の90%を担っているシステムである。 低親和性プロセスは高親和性プロセスを補強する。 吸収後、シスチン1分子は細胞内でシステイン2分子に変換される。 システインは側底膜から排出される。
シスチン尿症の家族からのDNAの遺伝子研究により、第2染色体上に欠損した遺伝子があることが明らかになった。 シスチントランスポーターをコードする遺伝子は当初rBATと呼ばれていたが、現在ではSLC3A1(SLCはsolute carrierの略)と国際的なゲノムデータベースで呼ばれている。 19番染色体上の第2のシスチン尿症遺伝子はSLC7A9と呼ばれている。 正常なSLC7A9遺伝子はb 0,+ AT (amino acid transporter)と呼ばれるシスチントランスポーターのサブユニットをコードしている。 シスチンの取り込みのプロセスは、SLC3A1とSLC7A9の遺伝子産物によって活性化されている。 L-シスチンのブラシボーダー膜小胞における輸送は、ナトリウム非依存性で電気泳動的である。 シスチン尿症患者では、尿細管細胞から血液中へのシスチンまたはシステインの移動は影響を受けない。
シスチンの腸管輸送
高親和性トランスポーターは空腸の頂部刷子縁膜に存在し、シスチンや二塩基アミノ酸の吸収に関与している。
通常、シスチンおよび他の二塩基性アミノ酸(すなわち、オルニチン、リジン、アルギニン)は、糸球体でろ過され、近位輸液管で高親性内膜貫通チャネルにより再吸収される。 このチャネルの欠陥は、尿中の二塩基性アミノ酸の分泌量を増加させる。 オルニチン、リジン、アルギニンは完全に溶解するが、シスチンは生理的尿pH5-7ではpKa8.3と比較的不溶性である。 尿のpHが7.8と8では、シスチンの溶解度はそれぞれほぼ2倍と3倍になる。
Dent and Seniorは、シスチンの溶解度がpH依存的であることを実証した。 尿中のシスチンの溶解度は、pH7までは約250mg/L(1mmol/L)ですが、下の画像に描かれているように、pH7.5以上では最大で500mg/L(2mmol/L)以上とpHが高くなるほど溶解度が高くなります。 尿中の測定結果から、シスチンの溶解度はイオン強度の上昇に伴って直線的に増加することが明らかになっている。 Pakらは、イオン強度が0.005~0.3まで上昇すると、1リットルの溶液に約70mgのシスチンが追加で溶解することを明らかにした。 また、同じイオン強度、pHであっても、電解質の種類によってシスチンの溶解度は異なる。
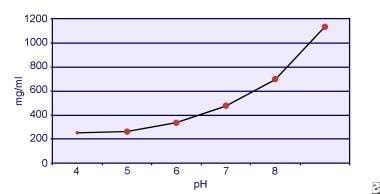 尿中のシスチンの溶解度。
尿中のシスチンの溶解度。 1983年のPakとFullerによるin vitroの実験では、塩化カルシウムの存在下で最も高い溶解度が達成され、次いで塩化マグネシウムと塩化ナトリウムが続くことが明らかにされました。 さらに、シスチンの溶解度は尿の高分子の影響も受ける。 正常尿中のコロイドの存在はシスチンの溶解度を増加させることが示されているが、その作用機序は明らかでない。 シスチンの結晶化を阻害するものはないため、主な決定要因は尿中の過飽和度である。 シスチン結晶化の危険因子としては、(1)低pHレベル、(2)イオン強度の低下、(3)シスチン結晶の存在、(4)尿中高分子の低レベル、が挙げられる。
シスチンはシステインのジスルフィド結合したホモダイマーで、以下の構造を持っています:
COOH-CHNH2-CH2 -S-S-CH2-CHNH2- COOH シスチン
COOH-CHNH2-CH2 -SH システイン
シスチンは小腸で腎臓と同様の方法で吸収されています。 シスチン尿症の人では、程度の差こそあれ、シスチンの腸管吸収も障害される。 メチオニンの代謝も血清シスチンの供給源となる。 2つのタイプII膜糖タンパク質ドメインが細胞膜を介したアミノ酸の輸送に関与していることが知られている。 1つはrBATで、もう1つは4F2HC(4F2抗原の重鎖)である
結石を形成するシスチン尿症の人の2/3は純粋なシスチン結石を作り、1/3はシスチンおよびシュウ酸カルシウムの混合結石を持つ。 2002年にMartinsらは、シュウ酸カルシウムの沈殿は、不均質核形成の過程ではなく、塩析の過程、すなわち、系に別の物質が加わることによる物質の溶解度の減少によって起こることを報告した。 シスチン尿症では、低尿酸血症、高カルシウム尿症、高尿酸血症もしばしば認められる。 シスチン結石は、ラメラ切断面を持たない比較的均一な結晶構造であるため、Dretlerの結石脆弱性指標では最も硬い結石の1つである。 ローゼンバーグI型、II型、III型に分類される。 シスチン尿症I型は最も一般的な変異型で、band 2p16.3にマッピングされている。 I型のヘテロ接合体では正常なアミノ酸尿を示す。 古典的なシスチン尿症であるII型とIII型は対立遺伝子変異であると考えられていたが、連鎖解析の結果、III型はバンド19q13.1上の未同定遺伝子(SLC7A9)の欠陥であることが判明した。 II型とIII型のヘテロ接合体は、しばしばシスチン結石を伴わないシスチン尿症を呈し、他のタイプの尿路結石のリスクを高める可能性がある。 3862>
III型ホモ接合体はI型、II型ホモ接合体とは異なり、シスチン経口投与により血漿シスチン濃度の上昇を示す。 Harrisらは、シスチン尿症プロバンドの両親(義務的ヘテロ接合体)の尿中シスチン排泄量を測定し、完全劣性対立遺伝子(両親とも基準範囲内のシスチン排泄)と優性対立遺伝子(両親とも高濃度のシスチン排泄)を見出し、シスチン尿症の遺伝学の複雑性を報告した。
シスチン尿症を臨床的に分類するには、プロバンドの各親で尿中シスチンを測定し、表現型I(劣性、尿中シスチン濃度<100μmol/g of creatinine)、表現型II(優性、尿中シスチン濃度>1000μmol/g of creatinine)、表現型III(部分優性、尿中シスチン濃度100~1000μmol/g of creatinine)とすることが可能である。 シスチン尿症はまた、症状が最初に現れた年齢(すなわち、乳児期、若年期、思春期)に基づいて分類される。
健常者では、シスチン排泄量の上限はクレアチニン20mg/g(<10μmol/mmol of Creatinine)である。 ホモ接合体では400mg/d(1.7mmol/d)以上排泄され、ホモ患者のシスチン排泄量は通常600~1400mg/d(2.5~5.8mmol/d)である。 I型およびIII型のヘテロ接合体のシスチン尿症では、排泄量は200mg/d(0.8mmol/d)未満であり、結石を形成することはない。 II型のヘテロ接合体は200-400mg/dまで排泄されるが、これらの患者は結石を形成する可能性がある。 3862>
遺伝学
近年、分子生物学の進歩により、シスチン尿症の病態生理に関する新しい知見が蓄積されてきている。 1992年、Xenopus laevis卵母細胞にシスチンと二塩基性アミノ酸をナトリウム非依存的に取り込ませる2.3キロベースの腎cDNA(D2HまたはrBAT)の発現クローニングが数人の研究者により報告された。 rBAT遺伝子は第2染色体(バンド2p21)のD2S119とD2S288の間にマッピングされた。 この遺伝子は現在Genome DatabaseでSLC3A1と名付けられている。
Immunohistochemical and in situ hybridization studiesは、rBATが近位尿細管と小腸のS3 (pars recta) セグメントの細胞で、ルーメンブラシ境界膜に発現していることを明らかにしている。 1995年、Gaspariniらは、SLC3A1の変異がI型シスチン尿症患者に生じ、II型、III型シスチン尿症患者には生じないことを報告した。 現在までに、この遺伝子からのDNA塩基対の小さな欠失と大きな欠失の両方を含む160以上の異なる変異が報告されている。 SLC3A1の最も一般的な遺伝子変異の一つはM467Tと呼ばれ、ほとんどの変異は集団特異的である傾向がある。 M467T変異は地中海沿岸の集団にかなり多く見られる。 興味深いことに、スペインの家族コホートでは変異の40%を占め、カナダのケベック州で研究された患者ではまれであった。
1999年にSLC7A9(BAT1)遺伝子が分離された。 この遺伝子は487アミノ酸のタンパク質をコードしており、19番染色体(band 19q13)のD19S414とD19S220の間にマッピングされた。 BAT1産物は、12個の膜貫通領域を持つ膜タンパク質であると思われる。 BAT1遺伝子の変異は、おそらく非I型シスチン尿症(Rosenberg II型とIII型)の原因となる。 19q遺伝子座の変異はリビア系ユダヤ人に特に多く、このような19q遺伝子座の変異を2つ受け継いだ患者の尿路結石のリスクは、rBAT変異を2つ受け継いだ患者のそれとほぼ同等である
この遺伝子に116の変異が報告されている。 リビア系ユダヤ人に最も多い変異は、タンパク質のバリンアミノ酸残基がメチオニンに置き換わったものである(V170M)。 V170M変異を持つヘテロ接合体では、尿中シスチン濃度はクレアチニンに対して86-1238μmol/gの範囲にある。 したがって、V170Mヘテロ接合体における値の一部はIII型シスチン尿症と一致し、その他はII型シスチン尿症と一致する。
II型とIII型シスチン尿症の明らかな区別点は、II型ホモ接合体の腸内シスチン吸収がないことである。 2000年、Prasは分子解析に基づく新しい分類を提案した。 最近、Dello Strologoらは、以下のような新しい遺伝子分類を提案している。
-
A型、SLC3A1の両アレルに変異がある場合:ヘテロ接合体は正常なアミノ酸尿パターンを示す。
-
B型、SLC7A9の両アレルに変異がある場合:通常システィンと二価アミノ酸尿中の排泄量の増加が見られる。
-
AB型、SLC3A1の1変異とSLC7A9の1変異によるシスチン尿症:混合型シスチン尿症は2つの異なる変異遺伝子の相互作用によって引き起こされると考えられ、19q遺伝子がコードするタンパク質は近位尿細管のS3セグメントでrBATと直接相互作用する(表参照)。
Martens et al (2008) は最近、A型シスチン尿症に関連する3つの遺伝子欠失症候群、2p21欠失症候群、低血圧性シスチン尿症候群(HCS)、低血圧性シスチン尿症候群の非典型型、を報告している。 HCSの患者では、SLC3A1とPREPLの両アレルが欠損している。 非定型のHCSでは、さらに1つの遺伝子(C2orf34)が欠失している。
表. シスチン尿症の分類(新しいウィンドウで表を開く)
|
Rosenberg et al |
Type I |
Type II |
Type III |
||
|
Molecular |
I型 |
非I型 |
|||
|
応答性遺伝子 SLC3A1 |
SLC7A9 |
||||
|
バンド |
2p21 |
19q13.P |
Bound |
||
|
No. 変異数 |
>60 |
||||
|
Most common mutation |
M467 |
V170M |
|||
|
影響を受ける人々 |
リビア系ユダヤ人 |
||||
|
消滅率 54% |
25% |
||||
|
蛋白質 |
rBAT |
BAT1 |
|||
|
アミノ酸輸送系 |
|||||
|
近位変換細管に局在 |
S3 |
S1.S1.S1.S2.S2.S2.S2.S2.S2.S2.S2.S2.S2.S3.S2.3, S2 |
|||
|
トランスポーター特性 |
低親和性である。 高容量 |
||||
|
臨床的特徴 |
|||||
|
ホモ接合体 |
症状のある |
約90%が有症状 |
|||
|
Heterozygote |
Asmptomatic |
約 10%- です。13%有症状 |
|||
|
尿中シスチン値 |
正常 |
上昇 +++ |
上昇 + |
||
|
プラズマシスチンレベル 経口負荷試験後 |
同上 |
上昇 |
|||
|
腸内輸送 |
なし |
低減 |
|||
最近の証拠では、4F2HC/4F2LC複合体は、以下のことを説明する 腸管や腎臓の近位尿細管細胞の基底側面におけるY+Lアミノ酸輸送系で、バンド14q11-上の4F2LC遺伝子(SLC7A7)の変異が13は、リジンタンパク質不耐症と呼ばれる稀な劣性疾患を引き起こします。
要旨
rBATは90kdのII型糖タンパク質で、ネズミの近位回盲部における二塩基性アミノ酸の高親和性、ナトリウム非依存性のトランスポーターである。 興味深いことに、連鎖分析により、この領域はシスチン尿症遺伝子座SLC3A1が同定されている領域と同じであることが示唆されている。世界中のシスチン尿症患者において、SLC3A1遺伝子に160種類、SLC7A9遺伝子に116種類の変異が同定されています。
III型およびII型シスチン尿症(非I型)はバンド19p13.1(SLC7A9)と関連しているが、SLC7A9遺伝子の正確な役割を明らかにするためには、さらなる研究が必要である。 SLC3A1遺伝子に2つの変異を有する小児(古典的ホモ接合型I型シスチン尿症)の約50%は、生後10年以内に少なくとも1つの結石を発症している
。