
Grafik mit Genehmigung verwendet. Daniel D. Brown, LaughingMantis.com.
Stachelhäuter sind eine der am stärksten abgeleiteten Tiergruppen mit vielen Arten als wichtige Bestandteile verschiedener mariner Gemeinschaften. Sie werden durch drei grundlegende gemeinsame Merkmale klassifiziert: 1) pentaradiale Symmetrie, 2) ein Skelett aus dreidimensionalen Kalzitelementen und 3) das Vorhandensein eines Wassergefäßsystems mit einer äußeren Öffnung. Insbesondere dieses Wassergefäßsystem (WVS) ist eine einzigartige Anwendung eines hydraulischen Systems, das Druckgradienten erzeugt, die Hunderte von winzigen, bewundernswerten Röhrenfüßen befähigen, über unebene Oberflächen zu kriechen und sich von hartschaligen Beutetieren wie Muscheln zu ernähren.
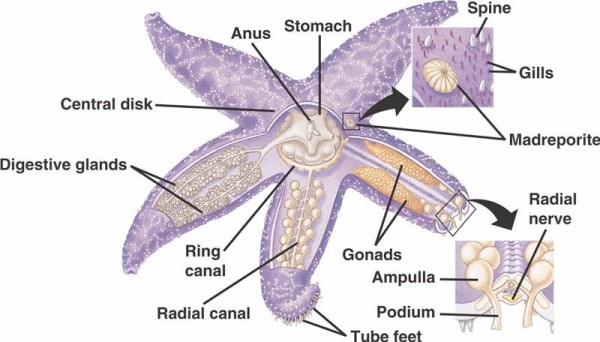
Die grundlegenden Komponenten des WVS bei nicht-crinoiden Stachelhäutern (siehe unten) umfassen einen zirkumoralen Ringkanal, von dem fünf Radialkanäle ausgehen. An den Ringkanal schließt sich das Madreporit an, das als Tor zwischen der äußeren Umgebung des Meeres und der inneren Umgebung des Stachelhäuters dient. Das Madreporit, benannt nach seiner Ähnlichkeit mit der Madreporaria-Koralle (was „Mutter der Poren“ bedeutet), ist mit Zellen ausgekleidet, die schwanzähnliche Geißeln in verschiedene Richtungen schlagen. Die Flüssigkeit im Inneren des WVS ähnelt in ihrer Zusammensetzung dem Meerwasser, enthält jedoch bis zu 60 % mehr Kaliumionen, etwas höhere Konzentrationen an Chloridionen und frei schwimmende Eiweißstoffe. Man hat auch festgestellt, dass Seegurken rote Blutkörperchen in ihren WVS haben.
Jeder Radialkanal hat sich seriell wiederholende Paare kürzerer Kanäle, die mit den Röhrenfüßen verbunden sind, die durch Muskelkontraktion der direkt über ihnen liegenden Ampullen betätigt werden. Denken Sie an eine Truthahnbratenspritze: Wenn Sie den Kolben zusammendrücken, wird Flüssigkeit aus dem Ende der Spritze herausgedrückt. Seelilien unterscheiden sich davon, weil ihnen sowohl diese kürzeren Kanäle als auch die Ampullen fehlen und ihre Röhrenfüße in Dreiergruppen auftreten, die direkt aus einem Kanal kommen, der dem Radialkanal ähnelt.
Crinoide haben die primitivste Form der WVS beibehalten. Man nahm an, dass die Röhrenfüße ursprünglich vollständig für die Atmung und als Nahrungsstrukturen verwendet wurden, aber fossile Stachelhäuter haben deutliche Poren zwischen den Skelettplatten, was Nichols (1972) zu der Schlussfolgerung veranlasste, dass das System der Röhrenfüße in der frühen Entwicklung der Stachelhäuter nicht sehr umfangreich war. Er zieht jedoch andere Interpretationen der Strukturen nicht in Betracht, z. B. Öffnungen für Innenteile, die mit der Fortbewegung oder der Ernährung zusammenhängen und nicht mit der Atmung. Carpoiden wie Gyrocystis und Dendrocystites, die in mittelkambrischen Sedimenten gefunden wurden, werden aufgrund der Ähnlichkeit der Skelettelemente als basal für die Stachelhäuter angesehen und haben vermutlich weiche, einziehbare innere Tentakelstrukturen. Das Vorhandensein eines primitiven WVS ist in den fossilen Aufzeichnungen der Carpoiden nicht schlüssig, es wird jedoch angenommen, dass es sich vor anderen Merkmalen der Stachelhäuter entwickelt hat. Der früheste Hinweis auf so etwas wie ein WVS stammt von den Helicoplacoidea, die in den Ablagerungen des unteren Kambriums gefunden wurden (auffällig durch das Vorhandensein hoch organisierter Reihen von Ambulakralporen). Nach Paul (1977) hat sich keine moderne Klasse von den Carpoiden abgesetzt, die seit dem Mesozoikum ausgestorben sind. Die Helicoplacoiden mit triradialer Symmetrie haben sich sehr früh von den Carpoiden abgegrenzt, und der Rest der Stachelhäuter hat sich auf dem Bauplan der Helicoplacoiden entwickelt.

Xyloplax aus Voight 2005.
Während der Stammbaum der Stachelhäuter nicht vollständig ausgearbeitet ist, erlebten sie ein kurzes Diversifizierungsereignis während des Kambriums und Ordiviziums, und der grundlegende Bauplan ist seitdem wenig verändert geblieben. Die vier Nicht-Stachelhäuter-Klassen haben eine ähnliche Struktur und Funktion in ihrem WVS. Die Holothuroiden sind auf Klassenebene wahrscheinlich am weitesten entwickelt, da ihre bucchalen Fütterungstentakel aus dem circumoralen Ringkanal herausragen und keine Skelettelemente enthalten. Der kürzlich entdeckte Xyloplax (links), eine seltsame Art von Seestern, hat eine noch einzigartigere WVS-Anordnung: ein neuartiges System mit doppelten Ringkanälen, die interradiale Verbindungen enthalten, und einem einreihigen Satz von Röhrenfüßen. Janies und McEdward (1994) vermuten, dass die einzigartige Geometrie des WVS durch eine Veränderung im Entwicklungsmechanismus eines juvenilen velatiden Asteroiden entstanden ist. Dieser Fall stellt die modernste und abgeleitete Evolution der WVS dar.
Die rasche Diversifizierung der Stachelhäuter, der Mangel an guter Erhaltung und das Fehlen von mehr als einem Typusexemplar für den Vergleich obskurer Fossilklassen stellt ein Problem dar, wenn man versucht, ihre Evolutionsgeschichte zu erklären. Die WVS ist streng genommen nicht nur ein einzigartiges Merkmal von Stachelhäutern. Es gibt Ähnlichkeiten mit Strukturen bei den Hemichordaten und den hydraulisch betriebenen Lophophoren. Ganz zu schweigen davon, dass embryologische Merkmale von Stachelhäutern auch bei Chordaten, Hemichordaten und Lophophoren zu finden sind. Darüber hinaus entwickelte sich der Ringkanal aus einem U-förmigen Vorläufer, der schließlich während der Ontogenese zu dem Ring verschmolz, den wir heute bei Stachelhäutern sehen. Dies scheint zu Nichols‘ (1967, 1972) Theorie zu passen, dass Stachelhäuter einen gemeinsamen Vorfahren mit einem Lophophoraten-ähnlichen Vorgänger haben, der ebenfalls U-förmige Eingeweide sowohl in der Larven- als auch in der Erwachsenenform aufweist.
Das WVS ist eine einzigartige und in den heutigen Stachelhäutern erfolgreiche Innovation. Es scheint plausibel, dass das komplizierte Netzwerk von Kanälen auf bereits existierenden anatomischen Strukturen wie dem Lophophor und dem U-förmigen Darm eines Lophophaten-ähnlichen gemeinsamen Vorfahren aufgebaut worden sein könnte, aber die Beweise sind unklar. Was mir auffällt, ist, dass eine solche Innovation in anderen Phyla nicht vorhanden ist. Das WVS entstand wahrscheinlich als Ernährungsstruktur bei frühen sessilen Stachelhäutern, wie Fossilieninterpretationen zeigen, und wurde erst in zweiter Linie zur Fortbewegung genutzt. Eine andere Deutung könnte sein, dass sich die WVS bei ausgestorbenen und noch lebenden Stachelhäutern mehr als einmal zu unterschiedlichen Zwecken (d. h. Atmung, Ernährung, Fortbewegung) entwickelt hat. So oder so ist die WVS eine erstaunliche Anpassung unter den Echinodermata.

Von Paul & Smith 1984
1) Baker A.N., Rowe F.W.E., Clark H.E.S. (1986) A new class of Echinodermata from New Zealand. Nature 321: 862-864.
2) Blake D.B., Guensburg T.E. (1988) The water vascular system and functional morphology of Paleozoic asteroids. Lethaia 21: 189-206.
3) Binyon J. (1972) Physiology of Echinoderms. Pergamon Press Ltd., Oxford.
4) Binyon J. (1984) A re-appraisal of the fluid loss resulting from operation of the water vascular system of the starfish, Asterias rubens. J. Mar. Biol. Ass. UK 64(3): 726.
5) Brusca R.C., Brusca G.J. (2003) Invertebrates. Sinauer Associates, Inc. Sunderland, MA.
6) Durham J.W. (1964) The Helioplacoidea and some possible implications. Yale Scient. Mag. 39(2): 24-28.
7) Hyman L. (1955) The Invertebrates: Vol. IV Echinodermata. McGraw-Hill, New York.
8) Janies D.A., McEdward L.R. (1993) Highly derived coelomic and water-vascular morphogensis in a starfish with pelagic direct development. Biol. Bull. 185: 56-76.
9) Janies D.A., McEdward L.R. (1994) Eine Hypothese für die Evolution des Wassergefäßsystems der Concentricycloiden. In Wilson Jr. W.H., Stricker S.A., Shinn G.L. (eds.): Reproduction and Development of Marine Invertebrates. John Hopkins University Press, Baltimore.
10) Jeffries R.P.S. (1988) How to characterize the Echinodermata-some implications of the sister-group relationship between echinoderms and chordates. In Paul C.R.C., Smith A.B. (eds.) Echinoderm Phylogeny and Evolutionary Biology. Oxford University Press, London: 1-13.
11) Jeffries R.P.S., Brown N.A., Daley P.E.J. (1996) Die frühe Phylogenie der Chordaten und Stachelhäuter und der Ursprung der Rechts-Links-Symmetrie der Chordaten und der bilateralen Symmetrie. Acta. Zool. 77: 101-122.
12) Lawrence J.M. (1987) A Functional Biology of Echinoderms. Croom Helm Ltd., London.
13) Lowe C.J., Wray G.A. (1997) Radikale Veränderungen in den Rollen der Homeobox-Gene während der Evolution der Stachelhäuter. Nature 389: 718-721.
14) Menge B.A. (1982) Auswirkungen der Ernährung auf die Umwelt: Asteroidea. In Jangoux M., Lawrence J.M. (eds.): Echinoderm Nutrition. A.A. Balkema, Rotterdam: 521-552.
15) Nichols D. (1967) The origin of echinoderms. In Millott N. (ed.): Echinoderm Biology. Academic Press Inc., London: 240-255.
16) Nichols D. (1972) The water-vascular system in living and fossil echinoderms. Paleontology 15(4): 519-538.
17) Paul C.R.C. (1977) Evolution of primitive echinoderms. In Hallam A. (ed.): Patterns of Evolution as Illustrated by the Fossil Record. Elsevier, Amsterdam: 123-158.
18) Paul C.R.C., Smith A.B. (1984) The early radiation and phylogeny of echinoderms. Biol. Rev. 59: 443-481.
19) Phelan T.F. (1977) Bemerkungen zum Wassergefäßsystem, zu den Nahrungsrillen und zur Abstammung der Clypeasteroiden Echinoiden. Bull. Mar. Sci. 27(3): 400-422.
20) Prusch R.D., Whoriskey F. (1976) Maintenance of fluid volume in the starfish water vascular system. Nature 262: 577-578.
21) Smith A.B. (1988) To group or not to group: The taxonomic position of Xyloplax. In Burke R.D., Mladenov P.V., Lambert P., Parsley R.L. (eds.): Echinoderm Biology. A.A. Balkema, Rotterdam,17-23.
22) Spencer W.K. (1938) Some aspects of evolution in Echinodermata. In de Beer O.R. (ed.): Evolution, Essays and Aspects of Evolutionary Biology Presented to E.S. Goodrich. Oxford University Press, London: 287-303.
23) Strathmann R.R. (1975) Limitations on diversity of forms: Verzweigung der Ambulakralsysteme von Stachelhäutern. Amer. Nat. 109: 177-190.
24) Turbeville J.M., Schulz J.R., Raff R.A. (1994) Deuterostome phylogeny and the sister group of the chordates: evidence from molecules and morphology. Mol. Biol. Evo. 11: 648-655.
25) Voight, J.R. (2005) First Report of the Enigmatic Echinoderm Xyloplax from the North Pacific. Biol. Bull. 208(2): 77-80.
26) Weber R.E., Vinogradov S.N. (2001) Nonvertebrate hemoglobins: Funktionen und molekulare Anpassungen. Phys. Rev. 81(2): 569-628.
27) Welsch U. (1998) Functional bauplan of the echinoderms. In Candia Carnevali M.D., Bonasoro F. (eds.): Echinoderm Research 1998. A.A. Balkema, Rotterdam: 39-47.
28) Wray G.A. (1999) Genes involved in the evolution of echinoderm morphology. In Candia Carnevali M.D., Bonasoro F. (eds.): Echinoderm Research 1998. A.A. Balkema, Rotterdam: 232.
Share the post „Veins of Water: The Evolution of the Echinoderm Water-Vascular System“
- Shares