
Graphie utilisée avec la permission. Daniel D. Brown, LaughingMantis.com.
Les échinodermes sont l’un des groupes d’animaux les plus fortement dérivés, avec de nombreuses espèces comme composantes importantes de plusieurs communautés marines. Ils sont classés par trois caractéristiques fondamentales partagées : 1) une symétrie pentaradiale, 2) un squelette constitué d’éléments calciques tridimensionnels, et 3) la présence d’un système vasculaire aquatique avec une ouverture externe. Ce système hydro-vasculaire (WVS), en particulier, reste une application unique d’un système hydraulique, générant des gradients de pression capables de commander des centaines de minuscules pieds tubulaires adorables pour ramper sur des surfaces inégales et se nourrir de proies à coquille résistantes comme les moules.
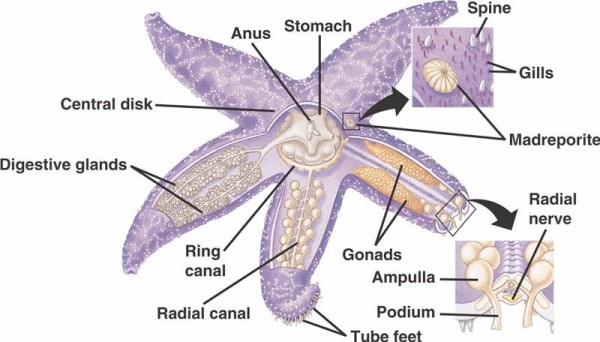
Les composants de base du WVS chez les échinodermes non-crinoïdes (ci-dessous) comprennent un canal annulaire circumoral avec cinq canaux radiaux s’étendant à partir de celui-ci. Le canal annulaire est également relié au madréporite, qui fait office de porte entre le milieu extérieur de la mer et le milieu intérieur de l’échinoderme. Le fluide à l’intérieur du WVS est similaire à l’eau de mer dans sa composition, mais contient jusqu’à 60 % d’ions potassium en plus, des concentrations légèrement plus élevées d’ions chlorure et des protéines albuminées flottant librement. On a également découvert que les concombres de mer avaient des globules rouges dans leur WVS.
Chaque canal radial possède des paires de canaux plus courts qui se répètent en série et qui s’attachent aux pieds tubulaires, lesquels sont actionnés par la contraction musculaire des ampoules situées directement au-dessus d’eux. Pensez à une poire à dinde : lorsque vous pressez le bulbe, le liquide est expulsé par l’extrémité de la poire, relâchez la pression et le liquide est aspiré vers le bulbe. Les crinoïdes diffèrent parce qu’ils n’ont pas à la fois ces canaux plus courts et ces ampoules et leurs pieds tubulaires se produisent par groupes de trois venant directement d’un canal similaire au canal radial.
Les crinoïdes conservent la forme la plus primitive de la WVS. On pensait que les pieds tubulaires étaient à l’origine entièrement utilisés pour la respiration ainsi que pour les structures d’alimentation, mais les éocrinoïdes fossiles ont des pores distincts entre les plaques squelettiques qui ont conduit Nichols (1972) à conclure que le système de pieds tubulaires n’était pas très étendu au début de l’évolution des crinoïdes. Mais il ne prend pas en considération d’autres interprétations de ces structures, comme des ouvertures pour des parties internes liées à la locomotion ou à l’alimentation et non liées à la respiration. Les carpoïdes, tels que Gyrocystis et Dendrocystites, trouvés dans les sédiments du Cambrien moyen sont considérés comme basaux à la lignée des échinodermes en raison de la similarité des éléments du squelette et on suppose qu’ils avaient des structures tentaculaires internes molles et protractiles. L’existence d’un WVS primitif n’est pas concluante dans les archives fossiles des carpoïdes, mais on considère qu’il a évolué avant les autres caractéristiques des échinodermes. La première suggestion de quelque chose qui ressemble à un WVS vient des Helicoplacoidea trouvés dans les dépôts du Cambrien inférieur (remarqués par la présence de rangées très organisées de pores ambulacraires). Selon Paul (1977), aucune classe moderne n’a divergé des carpoïdes, qui sont éteints depuis le Mésozoïque. Les hélicoplacoïdes, à symétrie triradiale, ont divergé très tôt des carpoïdes et le reste de la lignée des échinodermes a évolué sur le bauplan des hélicoplacoïdes.

Xyloplax de Voight 2005.
Bien que l’arbre généalogique des échinodermes ne soit pas entièrement élaboré, ils ont connu un court événement de diversification au cours du Cambrien et de l’Ordivicien et le bauplan de base est resté peu modifié depuis. Les quatre classes de non-crinoïdes ont une structure et une fonction similaires dans leur WVS. Les Holothuroïdes sont probablement les plus dérivés au niveau de la classe, parce que leurs tentacules d’alimentation bucchal sont étendus à partir du canal annulaire circumoral et ne contiennent aucun élément squelettique. Le Xyloplax (à gauche), une sorte d’étoile de mer récemment découverte, possède un arrangement WVS plus unique : un nouveau système avec des canaux annulaires doubles contenant des connexions interradiales et un ensemble mono-série de pieds tubulaires. Janies et McEdward (1994) suggèrent que la géométrie unique de son WVS a évolué via une modification du mécanisme de développement d’un astéroïde vélaire juvénile. Ce cas représente l’évolution la plus moderne et la plus dérivée de la WVS.
La diversification rapide des échinodermes, le manque de bonne conservation et l’absence de plus d’un spécimen type pour comparer des classes fossiles obscures présentent des problèmes lorsqu’on tente d’expliquer leur histoire évolutive. La WVS n’est pas, à proprement parler, une caractéristique unique des échinodermes. Il existe des similitudes avec des structures chez les hémichordés et le lophophore à fonctionnement hydraulique. Sans compter que les caractéristiques embryologiques des échinodermes sont également partagées par les chordés, les hémichordés et les lophophores. De plus, le canal annulaire s’est développé à partir d’un précurseur en forme de U qui finit par fusionner au cours de l’ontogénèse pour former l’anneau que nous voyons aujourd’hui chez les échinodermes. Cela semble correspondre à la théorie de Nichols (1967, 1972) selon laquelle les échinodermes ont partagé un ancêtre avec un prédécesseur de type lophophorate, qui ont également des boyaux en forme de U dans les formes larvaires et adultes.
Le WVS est une innovation unique et, chez les échinodermes actuels, réussie. Il semble plausible que le réseau complexe de canaux ait pu être construit sur des structures anatomiques préexistantes, comme le lophophore et l’intestin en forme de U d’un ancêtre commun de type lophophate, mais les preuves ne sont pas claires. Ce qui me frappe, c’est qu’une telle innovation n’est pas présente dans d’autres phyla. Le WVS est probablement apparu comme une structure d’alimentation chez les premiers échinodermes sessiles, comme le prouvent les interprétations fossiles, et a été utilisé secondairement pour la locomotion. Une autre interprétation peut être que la WVS a évolué plus d’une fois parmi les échinodermes éteints et existants à des fins différentes (c’est-à-dire la respiration, l’alimentation, la locomotion). Quoi qu’il en soit, le WVS est une adaptation étonnante chez les Echinodermata.

From Paul & Smith 1984
1) Baker A.N., Rowe F.W.E., Clark H.E.S. (1986) A new class of Echinodermata from New Zealand. Nature 321 : 862-864.
2) Blake D.B., Guensburg T.E. (1988) Le système vasculaire de l’eau et la morphologie fonctionnelle des astéroïdes paléozoïques. Lethaia 21 : 189-206.
3) Binyon J. (1972) Physiologie des échinodermes. Pergamon Press Ltd, Oxford.
4) Binyon J. (1984) Une réévaluation de la perte de fluide résultant du fonctionnement du système vasculaire de l’eau de l’étoile de mer, Asterias rubens. J. Mar. Biol. Ass. UK 64(3) : 726.
5) Brusca R.C., Brusca G.J. (2003) Invertébrés. Sinauer Associates, Inc. Sunderland, MA.
6) Durham J.W. (1964) The Helioplacoidea and some possible implications. Yale Scient. Mag. 39(2) : 24-28.
7) Hyman L. (1955) The Invertebrates : Vol. IV Echinodermata. McGraw-Hill, New York.
8) Janies D.A., McEdward L.R. (1993) Highly derived coelomic and water-vascular morphogensis in a starfish with pelagic direct development. Biol. Bull. 185 : 56-76.
9) Janies D.A., McEdward L.R. (1994) A hypothesis for the evolution of the Concentricycloid water-vascular system. Dans Wilson Jr. W.H., Stricker S.A., Shinn G.L. (eds.) : Reproduction et développement des invertébrés marins. John Hopkins University Press, Baltimore.
10) Jeffries R.P.S. (1988) How to characterize the Echinodermata-some implications of the sister-group relationship between echinoderms and chordates. In Paul C.R.C., Smith A.B. (eds.) Echinoderm Phylogeny and Evolutionary Biology. Oxford University Press, Londres : 1-13.
11) Jeffries R.P.S., Brown N.A., Daley P.E.J. (1996) The early phylogeny of chordates and echinoderms and the origin of chordate left-right symmetry and bilateral symmetry. Acta. Zool. 77 : 101-122.
12) Lawrence J.M. (1987) A Functional Biology of Echinoderms. Croom Helm Ltd, Londres.
13) Lowe C.J., Wray G.A. (1997) Altérations radicales des rôles des gènes homéobox au cours de l’évolution des échinodermes. Nature 389 : 718-721.
14) Menge B.A. (1982) Effets de l’alimentation sur l’environnement : Asteroidea. Dans Jangoux M., Lawrence J.M. (eds.) : Echinoderm Nutrition. A.A. Balkema, Rotterdam : 521-552.
15) Nichols D. (1967) L’origine des échinodermes. Dans Millott N. (ed.) : Echinoderm Biology. Academic Press Inc, London : 240-255.
16) Nichols D. (1972) The water-vascular system in living and fossil echinoderms. Paleontology 15(4) : 519-538.
17) Paul C.R.C. (1977) Evolution des échinodermes primitifs. Dans Hallam A. (ed.) : Patterns of Evolution as Illustrated by the Fossil Record. Elsevier, Amsterdam : 123-158.
18) Paul C.R.C., Smith A.B. (1984) The early radiation and phylogeny of echinoderms. Biol. Rev. 59 : 443-481.
19) Phelan T.F. (1977) Commentaires sur le système vasculaire aquatique, les sillons alimentaires et l’ascendance des échinodermes clypéastreux. Bull. Mar. Sci. 27(3) : 400-422.
20) Prusch R.D., Whoriskey F. (1976) Maintenance of fluid volume in the starfish water vascular system. Nature 262 : 577-578.
21) Smith A.B. (1988) To group or not to group : La position taxonomique de Xyloplax. Dans Burke R.D., Mladenov P.V., Lambert P., Parsley R.L. (eds.) : Echinoderm Biology. A.A. Balkema, Rotterdam,17-23.
22) Spencer W.K. (1938) Some aspects of evolution in Echinodermata. Dans de Beer O.R. (ed.) : Evolution, Essais et aspects de la biologie évolutive présentés à E.S. Goodrich. Oxford University Press, London : 287-303.
23) Strathmann R.R. (1975) Limitations de la diversité des formes : La ramification des systèmes ambulacraires des échinodermes. Amer. Nat. 109 : 177-190.
24) Turbeville J.M., Schulz J.R., Raff R.A. (1994) Deuterostome phylogeny and the sister group of the chordates : evidence from molecules and morphology. Mol. Biol. Evo. 11 : 648-655.
25) Voight, J.R. (2005) First Report of the Enigmatic Echinoderm Xyloplax from the North Pacific. Biol. Bull. 208(2) : 77-80.
26) Weber R.E., Vinogradov S.N. (2001) Nonvertebrate hemoglobins : Fonctions et adaptations moléculaires. Phys. Rev. 81(2) : 569-628.
27) Welsch U. (1998) Functional bauplan of the echinoderms. Dans Candia Carnevali M.D., Bonasoro F. (eds.) : Echinoderm Research 1998. A.A. Balkema, Rotterdam : 39-47.
28) Wray G.A. (1999) Genes involved in the evolution of echinoderm morphology. In Candia Carnevali M.D., Bonasoro F. (eds.) : Echinoderm Research 1998. A.A. Balkema, Rotterdam : 232.
Share the post « Veines d’eau : L’évolution du système hydro-vasculaire des échinodermes »
- Shares
.