
Grafika wykorzystana za zgodą. Daniel D. Brown, LaughingMantis.com.
Szkarłupnie są jedną z najbardziej pochodnych grup zwierząt z wieloma gatunkami jako znaczącymi składnikami kilku morskich społeczności. Są one klasyfikowane przez trzy podstawowe wspólne cechy: 1) symetrię pentaradialną, 2) szkielet zbudowany z trójwymiarowych elementów kalcytowych, oraz 3) obecność wodnego układu naczyniowego z otworem zewnętrznym. Ten system wodno-naczyniowy (WVS), w szczególności, pozostaje unikalnym zastosowaniem systemu hydraulicznego, generując gradienty ciśnienia, które są w stanie nakazać setkom maleńkich, przylegających stóp rurowych pełzanie po nierównych powierzchniach i żerowanie na twardych skorupach ofiar, takich jak małże.
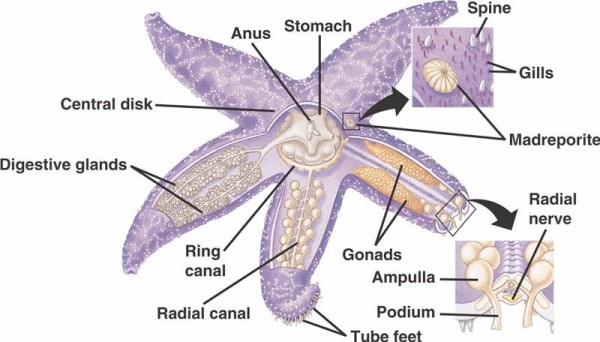
Podstawowe składniki WVS u szkarłupni niekrinoidalnych (poniżej) obejmują obwodowy kanał pierścieniowy z pięcioma kanałami promieniowymi wychodzącymi z niego. Do kanału pierścieniowego dołączony jest również madreporyt, który pełni rolę drzwi pomiędzy środowiskiem zewnętrznym morza a wewnętrznym szkarłupni. Madreporit, nazwany tak ze względu na podobieństwo do koralowca Madreporaria (co oznacza „matka porów”), jest wyścielony komórkami, które biją ogoniastymi flagelami w różnych kierunkach.Płyn wewnątrz WVS jest podobny w składzie do wody morskiej, ale zawiera do 60% więcej jonów potasu, nieco wyższe stężenie jonów chlorkowych i swobodnie pływające białko albuminowe. Ogórki morskie zostały również znalezione, aby mieć czerwone krwinki w ich WVS.
Każdy kanał promieniowy ma szeregowo powtarzające się pary krótszych kanałów, które dołączają do stóp rur, które są obsługiwane przez skurcz mięśni ampułek znajdujących się bezpośrednio nad nimi. Pomyśl o indyczym basterze: kiedy ściskasz bańkę, wypycha ona płyn na zewnątrz końcówki bistera, zwolnij nacisk, a płyn zostanie zassany z powrotem w kierunku bańki. Crinoids różnią się, ponieważ brakuje im zarówno tych krótszych kanałów i ampullae, a ich stopy rurkowe występują w grupach po trzy, wychodząc bezpośrednio z kanału podobnego do kanału promieniowego.
Krinoidy zachowują najbardziej prymitywną formę WVS. Stopy rurowe były uważane za pierwotnie używane całkowicie do oddychania, jak również struktury karmienia, ale kopalne eocrinoids mają wyraźne pory między płytkami szkieletowymi, które doprowadziły Nichols (1972) do wniosku, że system stóp rurowych nie był bardzo obszerny we wczesnym stadium ewolucji crinoid. Nie bierze on jednak pod uwagę innych interpretacji tych struktur, takich jak otwory dla wewnętrznych części związanych z lokomocją lub żerowaniem, a niezwiązanych z oddychaniem. Karpiowate, takie jak Gyrocystis i Dendrocystites, znalezione w osadach środkowego kambru są uważane za bazalne dla linii szkarłupni ze względu na podobieństwo elementów szkieletu i hipotezę, że mają miękkie, wysuwane wewnętrzne struktury mackowate. Istnienie prymitywnego WVS nie jest jednoznaczne w zapisie kopalnym karpiowatych, jednak uważa się, że wyewoluował on wcześniej niż inne cechy szkarłupni. Najwcześniejsza sugestia istnienia czegoś na kształt WVS pochodzi od Helicoplacoidea z osadów dolnego kambru (zwraca uwagę obecność wysoko zorganizowanych rzędów porów ambulakralnych). Według Paula (1977) żadna współczesna klasa nie oddzieliła się od karpoidów, które wymarły w mezozoiku. Helicoplacoids, o symetrii trójpodziałowej, bardzo wcześnie oddzieliły się od karpoidów, a reszta linii szkarłupni wyewoluowała z bauplanu Helicoplacoidów.

Xyloplax z Voight 2005.
Choć drzewo genealogiczne szkarłupni nie jest do końca dopracowane, to w kambrze i ordowiku doświadczyły one krótkiej dywersyfikacji, a podstawowy bauplan od tego czasu pozostał niewiele zmieniony. Cztery klasy nie-krinoidów mają podobną strukturę i funkcję w swoich WVS. Holothuroidy są prawdopodobnie najbardziej pochodną klasą, ponieważ ich macki żerne są przedłużone z kanału obwodowego i nie zawierają elementów szkieletowych. Niedawno odkryty Xyloplax (po lewej), dziwny rodzaj gwiazdy morskiej, ma bardziej unikalny układ WVS: nowatorski system z podwójnymi kanałami pierścieniowymi zawierającymi połączenia międzypromieniowe i monoseryjny zestaw odnóży rurkowych. Janies i McEdward (1994) sugerują, że unikalna geometria jej WVS wyewoluowała poprzez modyfikację mechanizmu rozwojowego młodocianego velatida Asteroida. Ten przypadek reprezentuje najbardziej nowoczesną i pochodną ewolucję WVS.
Szybka dywersyfikacja szkarłupni, brak dobrego zachowania i brak więcej niż jednego okazu typu dla porównania niejasnych klas skamieniałości stwarza problemy przy próbie wyjaśnienia ich historii ewolucyjnej. WVS nie jest, ściśle mówiąc, tylko unikalną cechą szkarłupni. Istnieją podobieństwa do struktur u hemichordates i hydraulicznie napędzanych lophophore. Nie wspominając o tym, że cechy embriologiczne szkarłupni są również wspólne dla chordates, hemichordates i lophophorates. Dodatkowo, kanał pierścieniowy rozwinął się z prekursora w kształcie litery U, który ostatecznie połączył się w trakcie ontogenezy, tworząc pierścień, jaki widzimy dziś u szkarłupni. To wydaje się pasować do teorii Nicholsa (1967, 1972), że szkarłupnie miały wspólnego przodka z lopoforopodobnym poprzednikiem, który również ma U-kształtne jelita w obu formach larwalnych i dorosłych.
WVS jest unikalną i, w dzisiejszych szkarłupniach, udaną innowacją. Wydaje się prawdopodobne, że skomplikowana sieć kanałów mogła zostać zbudowana na istniejących wcześniej strukturach anatomicznych, takich jak lophophore i U-kształtne jelito wspólnego przodka lophophate-like, ale dowody są niejasne. Dla mnie uderzające jest to, że taka innowacja nie jest obecna u innych fauny. WVS prawdopodobnie powstał jako struktura żerowa u wczesnych szkarłupni, co potwierdzają interpretacje skamieniałości, a wtórnie został wykorzystany do lokomocji. Inną interpretacją może być to, że WVS ewoluował więcej niż raz wśród wymarłych i wymarłych szkarłupni w różnych celach (tj. oddychanie, odżywianie, lokomocja). Tak czy inaczej, WVS jest niesamowitą adaptacją wśród Echinodermata.

Od Paula & Smith 1984
1) Baker A.N., Rowe F.W.E., Clark H.E.S. (1986) A new class of Echinodermata from New Zealand. Nature 321: 862-864.
2) Blake D.B., Guensburg T.E. (1988) The water vascular system and functional morphology of Paleozoic asteroids. Lethaia 21: 189-206.
3) Binyon J. (1972) Physiology of Echinoderms. Pergamon Press Ltd., Oxford.
4) Binyon J. (1984) A re-appraisal of the fluid loss resulting from operation of the water vascular system of the starfish, Asterias rubens. J. Mar. Biol. Ass. UK 64(3): 726.
5) Brusca R.C., Brusca G.J. (2003) Invertebrates. Sinauer Associates, Inc. Sunderland, MA.
6) Durham J.W. (1964) The Helioplacoidea and some possible implications. Yale Scient. Mag. 39(2): 24-28.
7) Hyman L. (1955) The Invertebrates: Vol. IV Echinodermata. McGraw-Hill, New York.
8) Janies D.A., McEdward L.R. (1993) Highly derived coelomic and water-vascular morphogensis in a starfish with pelagic direct development. Biol. Bull. 185: 56-76.
9) Janies D.A., McEdward L.R. (1994) A hypothesis for the evolution of the Concentricycloid water-vascular system. In Wilson Jr. W.H., Stricker S.A., Shinn G.L. (eds.): Reproduction and Development of Marine Invertebrates. John Hopkins University Press, Baltimore.
10) Jeffries R.P.S. (1988) How to characterize the Echinodermata-some implications of the sister-group relationship between echinoderms and chordates. In Paul C.R.C., Smith A.B. (eds.) Echinoderm Phylogeny and Evolutionary Biology. Oxford University Press, London: 1-13.
11) Jeffries R.P.S., Brown N.A., Daley P.E.J. (1996) The early phylogeny of chordates and echinoderms and the origin of chordate left-right symmetry and bilateral symmetry. Acta. Zool. 77: 101-122.
12) Lawrence J.M. (1987) A Functional Biology of Echinoderms. Croom Helm Ltd., London.
13) Lowe C.J., Wray G.A. (1997) Radical alterations in the roles of homeobox genes during echinoderms evolution. Nature 389: 718-721.
14) Menge B.A. (1982) Effects of feeding on the environment: Asteroidea. W Jangoux M., Lawrence J.M. (eds.): Echinoderm Nutrition. A.A. Balkema, Rotterdam: 521-552.
15) Nichols D. (1967) The origin of echinoderms. In Millott N. (ed.): Echinoderm Biology. Academic Press Inc, London: 240-255.
16) Nichols D. (1972) The water-vascular system in living and fossil echinoderms. Paleontology 15(4): 519-538.
17) Paul C.R.C. (1977) Evolution of primitive echinoderms. In Hallam A. (ed.): Patterns of Evolution as Illustrated by the Fossil Record. Elsevier, Amsterdam: 123-158.
18) Paul C.R.C., Smith A.B. (1984) The early radiation and phylogeny of echinoderms. Biol. Rev. 59: 443-481.
19) Phelan T.F. (1977) Comments on the water vascular system, food grooves, and ancestry of Clypeasteroid Echinoids. Bull. Mar. Sci. 27(3): 400-422.
20) Prusch R.D., Whoriskey F. (1976) Maintenance of fluid volume in the starfish water vascular system. Nature 262: 577-578.
21) Smith A.B. (1988) To group or not to group: The taxonomic position of Xyloplax. In Burke R.D., Mladenov P.V., Lambert P., Parsley R.L. (eds.): Echinoderm Biology. A.A. Balkema, Rotterdam,17-23.
22) Spencer W.K. (1938) Some aspects of evolution in Echinodermata. In de Beer O.R. (ed.): Evolution, Essays and Aspects of Evolutionary Biology Presented to E.S. Goodrich. Oxford University Press, London: 287-303.
23) Strathmann R.R. (1975) Limitations on diversity of forms: Branching of ambulacral systems of echinoderms. Amer. Nat. 109: 177-190.
24) Turbeville J.M., Schulz J.R., Raff R.A. (1994) Deuterostome phylogeny and the sister group of the chordates: evidence from molecules and morphology. Mol. Biol. Evo. 11: 648-655.
25) Voight, J.R. (2005) First Report of the Enigmatic Echinoderm Xyloplax from the North Pacific. Biol. Bull. 208(2): 77-80.
26) Weber R.E., Vinogradov S.N. (2001) Nonvertebratebrate hemoglobins: Functions and molecular adaptations. Phys. Rev. 81(2): 569-628.
27) Welsch U. (1998) Functional bauplan of the echinoderms. In Candia Carnevali M.D., Bonasoro F. (eds.): Echinoderm Research 1998. A.A. Balkema, Rotterdam: 39-47.
28) Wray G.A. (1999) Genes involved in the evolution of echinoderm morphology. In Candia Carnevali M.D., Bonasoro F. (eds.): Echinoderm Research 1998. A.A. Balkema, Rotterdam: 232.
Share the post „Veins of Water: The Evolution of the Echinoderm Water-Vascular System”
- Shares
.